1 . 请回答:
(1)Na2O2的电子式___________ 。
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由___________ 。
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______
① 请配平上述化学方程式。___________
② 浓盐酸在反应中显示出来的性质是___________
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为___________ 。
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的___________ 倍。
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________ 。
(1)Na2O2的电子式
(2)镁燃烧不能用CO2灭火,用化学方程式表示其理由
(3)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
_______KClO3+_______HCl(浓)=_______KCl+_______ClO2↑+_______Cl2↑+_______

① 请配平上述化学方程式。
② 浓盐酸在反应中显示出来的性质是
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
③若反应中生成标准状况下13.44L气体,则消耗还原剂的物质的量为
④ClO2具有很强的氧化性,常用作消毒剂,其消毒的效率(以单位物质的量得到的电子数表示)是H2O2的
(4)向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
名校
2 . 填空题
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是_______ (填序号,下同)。
Ⅱ.以上物质中属于非电解质的是_______ 。
Ⅲ.请写出①在水溶液中的电离方程式_______ 。
(2)配平化学方程式:_______ 。_______Cu + _______HNO3(稀)  _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O
(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:_______ 。
(1)现有以下物质:①Al2(SO4)3晶体,②稀盐酸 ,③冰醋酸(固态纯醋酸) ,④石墨, ⑤酒精(C2H5OH),⑥食盐水,⑦葡萄糖(C6H12O6),请回答下列问题:
Ⅰ.以上物质中属于电解质的是
Ⅱ.以上物质中属于非电解质的是
Ⅲ.请写出①在水溶液中的电离方程式
(2)配平化学方程式:
 _______Cu(NO3)2 + _______NO↑+_______H2O
_______Cu(NO3)2 + _______NO↑+_______H2O(3)新生成的氢氧化亚铁在空气中会迅速变为灰绿色、最后变为红褐色,其过程中涉及到的化学方程式为:
您最近一年使用:0次
2022-12-11更新
|
166次组卷
|
3卷引用:宁夏银川市第三十一中学2021-2022学年高一上学期期末学业检测化学试题
解题方法
3 . 高锰酸钾溶液常用于物质的定性检验与定量分析。实验宝里欲用KMnO4固体来配制200mL 0.1mol⋅L-1的KMnO4溶液。(已知KMnO4的摩尔质量:158g/mol)
(1)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、_______ 。
(2)计算所需KMnO4固体的质量为_______ g。
(3)写出配制的正确操作顺序(用字母表示,每个字母只能用一次):_______ 。
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)下列有关KMnO4溶液配制的操作,错误的有_______ 。
(5)配制过程中,下列操作导致溶液浓度偏小的是 _______(填序号)。
(6)为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。已知用其测定某补血剂片中亚铁的含量的过程中发生的化学反应方程式为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O。
测定步骤如下:
①称取含FeSO4·7H2O的补血剂片ag,充分研磨后溶于水,配成100mL溶液;
②取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
a.测定过程中共消耗_______ mol KMnO4,可计算出该补血剂中FeSO4·7H2O的质量分数为 _______ (用a表示,已知FeSO4•·7H2O的摩尔质量:278g/mol)。
b.请用双线桥表示该反应的电子转移情况:_______ 。
(1)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、
(2)计算所需KMnO4固体的质量为
(3)写出配制的正确操作顺序(用字母表示,每个字母只能用一次):
A.洗涤 B.称量、溶解 C.转移 D.摇匀 E.定容
(4)下列有关KMnO4溶液配制的操作,错误的有
| A.称量 | B.溶解 | C.转移时,玻璃棒插在刻度线以上 | D.定容 |
 | 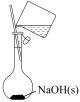 | 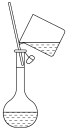 | 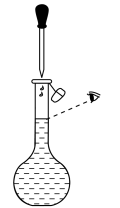 |
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容摇匀后,发现液面低于容量瓶刻度,又加水至刻度线 |
| D.称量KMnO4固体的质量时,托盘天平左侧放砝码 |
测定步骤如下:
①称取含FeSO4·7H2O的补血剂片ag,充分研磨后溶于水,配成100mL溶液;
②取25.00mL的该溶液与0.1mol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。
a.测定过程中共消耗
b.请用双线桥表示该反应的电子转移情况:
您最近一年使用:0次
名校
解题方法
4 . 某同学在疫情期间通过KClO3+H2C2O4→CO2↑+ClO2↑+K2CO3+H2O(未配平)的方程自制高效消毒剂ClO2,下列说法正确的是
| A.该反应方程式配平后各物质前的系数分别为2,1,1,2,1,1 |
| B.若有18g H2C2O4参与反应,则会生成8.96L的ClO2气体 |
| C.氧化剂和还原剂的物质的量之比为1:2 |
| D.每生成1mol ClO2转移2NA电子 |
您最近一年使用:0次
2022-12-02更新
|
188次组卷
|
2卷引用:宁夏银川三沙源上游学校2022-2023学年高一上学期期中考试化学试题
5 . 根据下列氧化还原反应:
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。
下列结论中正确的是
①2I-+Cl2=I2+2Cl-;
②2Fe3++2I-=2Fe2++I2;
③2Fe2++Cl2=2Fe3++2Cl-;
④2MnO
 +10Cl-+16H+=2Mn2++5Cl2+8H2O。
+10Cl-+16H+=2Mn2++5Cl2+8H2O。下列结论中正确的是
A.Mn2+是MnO 的氧化产物,I2是I-的还原产物 的氧化产物,I2是I-的还原产物 |
B.氧化性强弱顺序为:MnO >Cl2>Fe3+>I2 >Cl2>Fe3+>I2 |
| C.反应②中Fe3+被氧化,I-被还原 |
D.在溶液中不可能发生反应:MnO +5Fe2++8H+=Mn2++5Fe3++4H2O +5Fe2++8H+=Mn2++5Fe3++4H2O |
您最近一年使用:0次
名校
解题方法
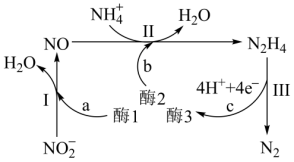
6 . 科学家发现某些生物酶体系可以促进H+和e-的转移(如a、b和c),能将海洋中的NO 转化为N2进入大气层,反应过程如图所示。下列说法错误的是
转化为N2进入大气层,反应过程如图所示。下列说法错误的是
 转化为N2进入大气层,反应过程如图所示。下列说法错误的是
转化为N2进入大气层,反应过程如图所示。下列说法错误的是
A.过程I中NO 发生还原反应 发生还原反应 |
| B.a和b中转移的e-数目不相等 |
C.过程II中参与反应的n(NO):n(NH )=1:4 )=1:4 |
D.过程I→III的总反应为NO +NH +NH =N2↑+2H2O =N2↑+2H2O |
您最近一年使用:0次
2022-11-22更新
|
339次组卷
|
4卷引用:宁夏银川市第二中学2022-2023学年高三上学期统练三化学试题
名校
7 . 滴定法是化学上常用的定量分析的方法,滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.氧化还原滴定与中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。某同学用0.1000 mol·L-1 KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液。填空完成问题:
(1)KMnO4溶液应放在______ (填“酸式”或“碱式”)滴定管中。
(2)写出KMnO4与H2C2O4反应的离子方程式______________ 。
(3)滴定终点的现象为_______ 。
(4)某学生根据 3次实验分别记录有关数据如下表:
①依据上表数据列式计算该H2C2O4溶液的物质的量浓度为________ 。(保留4位有效数字)
(5)滴定实验中一般要选择合适的指示剂,下列滴定中指示剂的选择或滴定终点颜色变化错误的是_______
(1)KMnO4溶液应放在
(2)写出KMnO4与H2C2O4反应的离子方程式
(3)滴定终点的现象为
(4)某学生根据 3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol·L-1 KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
②下列操作中可能使测定结果偏低的是
A.酸式滴定管未用标准液润洗就直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
(5)滴定实验中一般要选择合适的指示剂,下列滴定中指示剂的选择或滴定终点颜色变化错误的是
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓。
选项 | 滴定管中的溶液 | 锥形瓶中的溶液 | 指示剂 | 滴定终点颜色变化 |
A | NaOH溶液 | CH3COOH溶液 | 酚酞 | 无色→浅红色 |
B | 盐酸 | 氨水 | 甲基橙 | 黄色→橙色 |
C | 酸性KMnO4溶液 | K2SO3溶液 | 无 | 无色→浅紫红色 |
D | 碘水 | Na2S溶液 | 淀粉 | 蓝色→无色 |
您最近一年使用:0次
2022-11-21更新
|
193次组卷
|
2卷引用:宁夏回族自治区银川一中2022-2023学年高二上学期期中考试化学试题
名校
8 . 氮族元素包括氮、磷、砷、锑、铋等元素,其单质及其化合物在研究和生产中有着广泛的应用。试回答下列问题:
(1)NaNO2是一种重要的化工原料,有毒,NaNO2也是一种食品添加剂,使用时须严格控制用量。已知:HNO2有强氧化性,酸性H2SO3>HNO2>CH3COOH。
①氮原子核外共有____ 种能量不同的电子。
②亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到8e-结构,则其电子式为____ ,其水解会生成两种酸,写出水解的化学方程式____ 。
③往冷的NaNO2溶液中加入下列某种物质可得HNO2稀溶液,该物质是____ (填序号)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(2)砷化镓(GaAs)是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。基态As原子外围电子排布式为____ ,最高能级的电子云形状为____ ,As元素在元素周期表中的位置为____ 。
(3)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30min可制得疏松的灰色粉末状GaN,同时得到一种单质,请写出对应的化学方程式____ 。
(1)NaNO2是一种重要的化工原料,有毒,NaNO2也是一种食品添加剂,使用时须严格控制用量。已知:HNO2有强氧化性,酸性H2SO3>HNO2>CH3COOH。
①氮原子核外共有
②亚硝酰氯(NOCl)是一种红褐色液体,每个原子最外层都达到8e-结构,则其电子式为
③往冷的NaNO2溶液中加入下列某种物质可得HNO2稀溶液,该物质是
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.醋酸
(2)砷化镓(GaAs)是当前最重要,技术成熟度最高的半导体材料之一,我国“玉兔二号”月球车就是通过砷化镓太阳能电池提供能量。基态As原子外围电子排布式为
(3)GaN是一种直接能隙(directbandgap)的半导体,自1990年起常用在发光二极管中。工业上以镓粉为原料,用镍催化法生产GaN,在氨气流中于1050~1100℃下加热30min可制得疏松的灰色粉末状GaN,同时得到一种单质,请写出对应的化学方程式
您最近一年使用:0次
2022-11-08更新
|
225次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高二上学期期中考试(重点班)化学试题
名校
解题方法
9 . 金属钛是一种性能优越的结构材料和功能材料,被誉为“太空金属”。以云南富民钛铁精矿(主要成分为TiO2、FeO、Fe2O3,含SiO2、Al2O3等杂质)为原料,制备海绵状金属钛的流程设计如图:
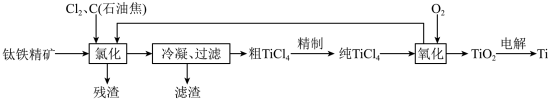
已知:TiCl4及所含杂质氯化物的性质
回答下列问题:
(1)“氯化”过程需在沸腾炉中进行,且需维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,则该反应的化学方程式为_______ ;氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_______ (填化学式)。
(2)“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4。第一步蒸馏分离出的杂质是_______ (填化学式);再将温度控制在一定的范围内蒸馏分离出纯TiCl4,所控制温度范围是_______ 。
(3)“氧化”过程的产物中可循环利用的是_______ (填化学式)。

已知:TiCl4及所含杂质氯化物的性质
| 化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 |
| 沸点/℃ | 58 | 136 | 181(升华) | 316 |
| 熔点/℃ | -69 | -25 | 193 | 304 |
| 在TiCl4中的溶解性 | 互溶 | —— | 微溶 | |
回答下列问题:
(1)“氯化”过程需在沸腾炉中进行,且需维持在1050℃,若TiO2氯化时生成的CO与CO2的物质的量之比为1:1,则该反应的化学方程式为
(2)“精制"过程中,粗TiC4经两步蒸馏得纯TiCl4。第一步蒸馏分离出的杂质是
(3)“氧化”过程的产物中可循环利用的是
您最近一年使用:0次
名校
10 . 下列有关描述对应的离子方程式书写正确的是
| A.将过量的H2S通入FeCl3溶液中 :2Fe3+ + 3S2- = 2FeS↓+ S↓ |
B.向KMnO4酸性溶液中滴入H2O2溶液 :2MnO +3H2O2+6H+ = 2Mn2+ +4O2↑+ 6H2O +3H2O2+6H+ = 2Mn2+ +4O2↑+ 6H2O |
C.用白醋浸泡过的淀粉-KI试纸检验加碘盐中的KIO3 :5I-+ IO + 6H+ = 3I2 + 3H2O + 6H+ = 3I2 + 3H2O |
D.用酸性重铬酸钾溶液测定白酒中乙醇的含量:2Cr2O +3C2H5OH+16H+ = 4Cr3++3CH3COOH+11H2O +3C2H5OH+16H+ = 4Cr3++3CH3COOH+11H2O |
您最近一年使用:0次



