名校
解题方法
1 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使 转化为
转化为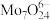 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
(5)应用。将 制成
制成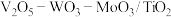 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度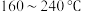 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: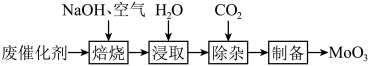
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使 转化为
转化为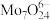 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成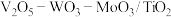 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度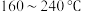 之间,
之间, 转化率不高的原因是
转化率不高的原因是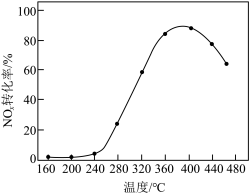
您最近一年使用:0次
2024-01-28更新
|
837次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
2 . ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制成NaClO2固体,以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图所示。

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是_______ ;冰水浴冷却的目的是_______ ,_______ (写两种)。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因_______ 。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_______ (用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是_______ ,馏出物是_______ 。
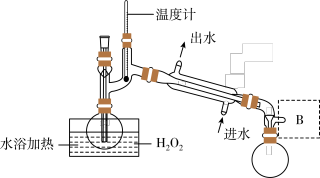

已知:
2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59 ℃、沸点11 ℃;H2O2沸点150 ℃
请回答:
(1)仪器A的作用是
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①
(4)H2O2浓度对反应速率有影响。通过如图所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是

您最近一年使用:0次
名校
解题方法
3 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系:
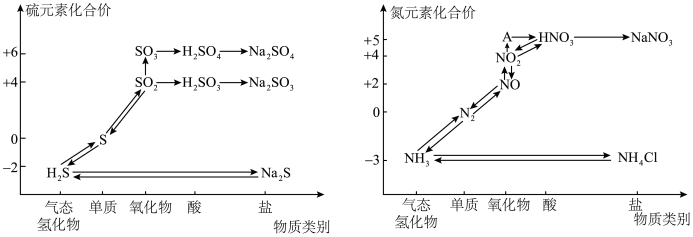
(1)根据 A 对应的化合价和物质类别,A 为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的含氮化合物有___________ 。
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式___________ 。
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择___________ ,反应的离子方程式为___________ 。
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:
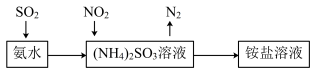
NO2 被吸收过程的离子方程式是___________ 。

(1)根据 A 对应的化合价和物质类别,A 为
(2)氮气的结构决定了氮气能够在空气中稳定存在,实验室可用加热 NaNO2与NH4Cl 的混合溶液制备N2,请写出反应的化学方程式
(3)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(4)工业生产中利用氨水吸收SO2 和NO2 ,原理如图所示:

NO2 被吸收过程的离子方程式是
您最近一年使用:0次
名校
解题方法
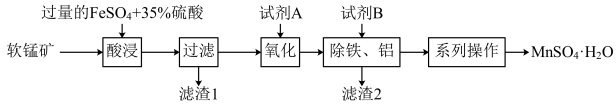
4 . 硫酸锰晶体(MnSO4·H2O)常用作动物饲料的添加剂。工业上以软锰矿(含MnO2和少量的Fe2O3、Al2O3、SiO2)为原料制备硫酸锰晶体的流程如图:
已知几种金属离子沉淀的pH如表所示:
回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,粉碎的目的是______ ,“酸浸”中MnO2和FeSO4反应的离子方程式为______ 。
(2)“滤渣1”的主要成分是_______ 填化学式)。“系列操作”包括______ 、降温结晶、过滤、洗涤、干燥等。
(3)从绿色化学角度分析,试剂A宜选择______ (填标号)。
a.HNO3 b.H2O2 c.Cl2 d.O3
(4)如果省略“氧化”工艺,产品中可能会混有______ (填化学式)。
(5)测定产品纯度:准确称取wg样品,加适量ZnO及H2O煮沸、冷却后,转移至锥形瓶中,用cmol•L-1KMnO4标准溶液滴定至溶液呈红色且半分钟不褪色,消耗KMnO4标准溶液VmL。MnSO4·H2O样品的纯度为______ (用含w、c、V的代数式表示)。
已知:①2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4。
②杂质不与KMnO4反应。

已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀的pH | 2.7 | 7.6 | 4.0 | 7.7 |
| 完全沉淀的pH | 3.7 | 9.6 | 5.2 | 9.8 |
回答下列问题:
(1)“酸浸”前需要将软锰矿粉碎,粉碎的目的是
(2)“滤渣1”的主要成分是
(3)从绿色化学角度分析,试剂A宜选择
a.HNO3 b.H2O2 c.Cl2 d.O3
(4)如果省略“氧化”工艺,产品中可能会混有
(5)测定产品纯度:准确称取wg样品,加适量ZnO及H2O煮沸、冷却后,转移至锥形瓶中,用cmol•L-1KMnO4标准溶液滴定至溶液呈红色且半分钟不褪色,消耗KMnO4标准溶液VmL。MnSO4·H2O样品的纯度为
已知:①2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4。
②杂质不与KMnO4反应。
您最近一年使用:0次
2023-03-02更新
|
211次组卷
|
3卷引用:湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题
湖南省邵东市第一中学2022-2023学年高二上学期期中考试化学试题四川省绵阳市高中2022-2023学年高二理科突击班下学期3月月考化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(工业流程题)
名校
解题方法
5 . 四溴化乙炔( )是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分
)是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分 ,少量CaS、
,少量CaS、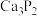 、
、 等)和
等)和 等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:

已知:四溴化乙炔熔点为1℃,沸点为244℃,密度为 ,难溶于水。
,难溶于水。
回答下列问题:
(1)装置Ⅰ中 与水反应的化学方程式为
与水反应的化学方程式为_______ ,该反应剧烈,为了得到平缓的乙炔气流,可采取的措施是_______ (任写一条)。
(2)装置Ⅱ的目的是除去 、
、 及
及 杂质,其中溶液与
杂质,其中溶液与 反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:
反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:_______ 。
(3)装置Ⅲ在液溴液面上加入一层水的目的是_______ ;装置Ⅲ中表明已反应完成的现象是_______ ;已知装置Ⅲ反应后的体系含有多种物质,简述获得纯净的四溴化乙炔的操作:_______ 。
(4)装置Ⅴ的目的是除去未反应的乙炔。在碱性条件下, 与
与 反应生成碳酸盐和
反应生成碳酸盐和 ,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
,则该反应中参与反应的氧化剂和还原剂的物质的量之比为_______ 。
 )是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分
)是一种无色液体,常用于合成季铵化合物。某同学在实验室模仿工业生产,以电石(主要成分 ,少量CaS、
,少量CaS、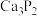 、
、 等)和
等)和 等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
等为原料制备少量四溴化乙炔,实验装置(夹持装置已省略)如图所示:
已知:四溴化乙炔熔点为1℃,沸点为244℃,密度为
 ,难溶于水。
,难溶于水。回答下列问题:
(1)装置Ⅰ中
 与水反应的化学方程式为
与水反应的化学方程式为(2)装置Ⅱ的目的是除去
 、
、 及
及 杂质,其中溶液与
杂质,其中溶液与 反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:
反应可生成铜、硫酸和砷酸,写出该反应的化学方程式:(3)装置Ⅲ在液溴液面上加入一层水的目的是
(4)装置Ⅴ的目的是除去未反应的乙炔。在碱性条件下,
 与
与 反应生成碳酸盐和
反应生成碳酸盐和 ,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
,则该反应中参与反应的氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
6 . 钒元素在酸性溶液中有多种存在形式,其中 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,Fe2+、
具有较强的氧化性,Fe2+、 等能把
等能把 还原为
还原为 。向
。向 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是
 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,Fe2+、
具有较强的氧化性,Fe2+、 等能把
等能把 还原为
还原为 。向
。向 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是
溶液,溶液颜色由蓝色变为淡黄色。下列说法不正确的是A.在酸性溶液中氧化性: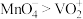 |
B. 溶液与足量酸性 溶液与足量酸性 溶液发生反应的离子方程式: 溶液发生反应的离子方程式: |
C.向 溶液中滴加酸性 溶液中滴加酸性 溶液反应化学方程式为 溶液反应化学方程式为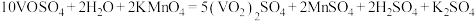 |
D.向含1mol 的酸性溶液中滴加1.25molFeSO4的溶液完全反应,转移电子为1mol 的酸性溶液中滴加1.25molFeSO4的溶液完全反应,转移电子为1mol |
您最近一年使用:0次
名校
7 . 下列反应方程式书写正确的是
A.铅蓄电池( 作电解质溶液)放电时正极上的反应: 作电解质溶液)放电时正极上的反应: |
B.将 通入苯酚钠溶液中出现浑浊:2 通入苯酚钠溶液中出现浑浊:2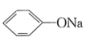 +CO2+H2O→2 +CO2+H2O→2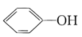 +Na2CO3 +Na2CO3 |
C.用稀盐酸处理铜器表面的铜锈: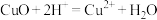 |
D.向硫化钡溶液中滴加硫酸铜溶液: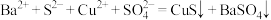 |
您最近一年使用:0次
2023-02-13更新
|
448次组卷
|
2卷引用:湖南省长沙市第一中学2022-2023学年高三上学期第四次月考化学试题
名校
解题方法
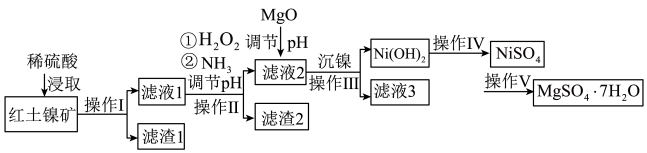
8 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下, 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;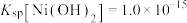 。
。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“浸取”时需将矿样研磨的目的是______ ,“滤渣1”的成分______ (填化学式)。
(2)“滤液1”中加入 的作用是
的作用是______ (用离子反应方程式表示)。
(3)操作II为达到实验目的,由表中的数据判断通入 调节溶液pH的范围是
调节溶液pH的范围是______ 。
(4)“滤液1”中是否存在 ,可用
,可用______ 检验。
(5)“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为______  。
。
(6)操作V是______ 、过滤、洗涤。
(7) 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为______ 。
 、
、 和铁的氧化物)为原料,采用酸溶法制取
和铁的氧化物)为原料,采用酸溶法制取 和
和 ,工业流程如图所示:
,工业流程如图所示:
已知:①常温下,
 易溶于水,
易溶于水, 和NiOOH不溶于水;
和NiOOH不溶于水;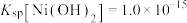 。
。②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
沉淀完全( | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“浸取”时需将矿样研磨的目的是
(2)“滤液1”中加入
 的作用是
的作用是(3)操作II为达到实验目的,由表中的数据判断通入
 调节溶液pH的范围是
调节溶液pH的范围是(4)“滤液1”中是否存在
 ,可用
,可用(5)“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为 。
。(6)操作V是
(7)
 在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
在碱性溶液中用NaClO氧化,可制得碱性镍镉电池电极材料NiOOH,该反应的离子方程式为
您最近一年使用:0次
2023-02-10更新
|
1019次组卷
|
7卷引用: 湖南师范大学附属中学2022-2023学年高二上学期期末考试化学试题
名校
解题方法
9 . 钪及其化合物具有许多优良的性能,在宇航、电子、超导等方面有着广泛的应用。从钛白工业废酸(含钪、钛、铁、锰等离子)中提取氧化钪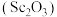 的一种流程如下:
的一种流程如下:
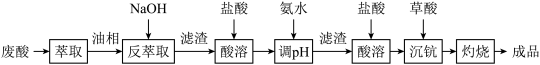
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是_______________________ 。
(2)常温下,先加入氨水调节 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是__________ ;再向滤液加入氨水调节 ,滤液中
,滤液中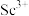 的浓度为
的浓度为__________ 。
{已知: 、
、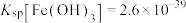 、
、 }
}
(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:___________________________ 。
(4)草酸钪“灼烧”氧化的化学方程式为________________________________________________ 。
(5)废酸中含钪量为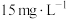 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为__________ 。
(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:
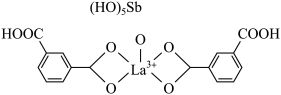
该结构中,中心离子 配位数为
配位数为__________ 。
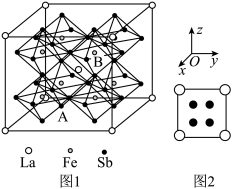
(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:
①若图中A点锑原子的坐标为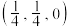 ,则B点铁原子的坐标为
,则B点铁原子的坐标为__________ 。
②若该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为__________ cm。
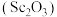 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)洗涤“油相”可除去大量的钛离子。洗涤水是用93%的硫酸、27.5%的双氧水和水按一定比例混合而成。混合的实验操作是
(2)常温下,先加入氨水调节
 ,过滤,滤渣主要成分是
,过滤,滤渣主要成分是 ,滤液中
,滤液中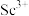 的浓度为
的浓度为{已知:
 、
、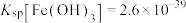 、
、 }
}(3)用草酸“沉钪”,写出“沉钪”得到草酸钪的离子方程式:
(4)草酸钪“灼烧”氧化的化学方程式为
(5)废酸中含钪量为
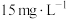 ,VL废酸最多可提取
,VL废酸最多可提取 的质量为
的质量为(6)镧与Sc同族位于第六周期,一种镧、锑形成的配合物结构如图所示:

该结构中,中心离子
 配位数为
配位数为(7)某铁、镧、锑的合金晶胞如图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如图2:

①若图中A点锑原子的坐标为
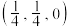 ,则B点铁原子的坐标为
,则B点铁原子的坐标为②若该晶体的密度为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则Sb原子与Sb原子的最近距离为
,则Sb原子与Sb原子的最近距离为
您最近一年使用:0次
2023-02-06更新
|
583次组卷
|
3卷引用:湖南师范大学附属中学2022-2023学年高三上学期月考卷(六)化学试题
名校
解题方法
10 . 废旧电器中电路板主要含有Fe、Cu、SnO2、PbO2、塑料等物质,研究小组从废旧电路板中回收金属锡(50Sn)的流程如图。下列说法正确的是
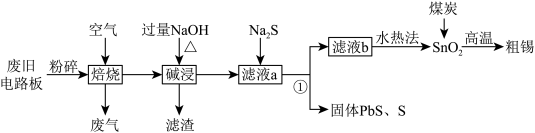
已知:SnO2、PbO2可与强碱共热反应生成易溶于水的Na2SnO3和Na2PbO3。

已知:SnO2、PbO2可与强碱共热反应生成易溶于水的Na2SnO3和Na2PbO3。
| A.Sn元素的核外电子排布式为[Kr]5s25p2 |
| B.焙烧的主要目的是将Fe和Cu变成氧化物 |
| C.若过滤后得到干燥的PbS和S的固体混合物27.1g,则反应①有NA个电子转移 |
D.焦炭和SnO2反应的方程式为2C+SnO2 Sn+2CO↑ Sn+2CO↑ |
您最近一年使用:0次





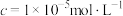 )时的pH
)时的pH

