1 . NF3是微电子工业中一种优良的等离子蚀刻气体,在1个标准大气压下,NF3的沸点为-129.0℃,能与空气中的水蒸气反应生成HF、NO和HNO3。NF3可通过如下方法制备:
(1)气-气反应:在常温下将OF2与干燥的空气混合即得NO2和NF3。
①原料OF2中氧元素的化合价为____ 。
②已知反应中每消耗1molN2转移7mol电子,配平反应:____ 。
____OF2+____N2+____O2=____NO2+____NF3
反应中氧化剂与还原剂的物质的量之比为____ 。
(2)气-固反应:由于气-气反应容易腐蚀设备,研究人员提出用气-固反应制备NF3。气-固反应包括如下两个步骤:
(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4
NH4AlF4+3F2=NF3+4HF+AlF3
①气-固反应的总化学方程式为____ ,若有0.5mol(NH4)3AlF6完全氧化,则可制得NF3____ L(标准状况下)。
②若要制备1.5molNF3,共有____ mol电子发生转移。
(3)NF3在空气中泄漏,还是易于发现的。判断发生了NF3泄漏的现象是____ 。一但NF3发生泄漏,可以用烧碱溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外还一定有____ (填化学式)。
(1)气-气反应:在常温下将OF2与干燥的空气混合即得NO2和NF3。
①原料OF2中氧元素的化合价为
②已知反应中每消耗1molN2转移7mol电子,配平反应:
____OF2+____N2+____O2=____NO2+____NF3
反应中氧化剂与还原剂的物质的量之比为
(2)气-固反应:由于气-气反应容易腐蚀设备,研究人员提出用气-固反应制备NF3。气-固反应包括如下两个步骤:
(NH4)3AlF6+6F2=2NF3+8HF+NH4AlF4
NH4AlF4+3F2=NF3+4HF+AlF3
①气-固反应的总化学方程式为
②若要制备1.5molNF3,共有
(3)NF3在空气中泄漏,还是易于发现的。判断发生了NF3泄漏的现象是
您最近一年使用:0次
名校
2 . 高铁酸钾纯品为暗紫色有光泽粉末。在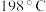 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是
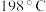 以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为
以下干燥空气中稳定。极易溶于水而形成浅紫红色溶液,静置后会分解放出氧气,并沉淀出水合三氧化二铁。溶液的碱性随分解而增大,在强碱性溶液中相当稳定,是极好的氧化剂。具有高效的消毒作用,比高锰酸钾具有更强的氧化性。高铁酸钾的分子式为 ,工业制备高铁酸钾的离子方程式为
,工业制备高铁酸钾的离子方程式为 (未配平),下列有关说法不正确的是
(未配平),下列有关说法不正确的是A.由上述反应可知,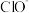 的氧化性强于 的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
C.上述反应氧化剂和还原剂的物质的量之比为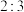 |
D. 处理水时,不仅能消毒杀菌,还生成 处理水时,不仅能消毒杀菌,还生成 水解形成 水解形成 胶体吸附水中悬浮杂质 胶体吸附水中悬浮杂质 |
您最近一年使用:0次
2022-10-30更新
|
218次组卷
|
3卷引用:宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题
宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题(已下线)专题04 氧化还原反应及其应用(练)-2023年高考化学二轮复习讲练测(新高考专用)广东省东莞市光正实验学校2023-2024学年高三上学期第一次月考化学试题
3 . I.智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为: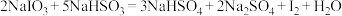
(1)反应中_______ 元素被氧化,_______ 是氧化剂。
(2)用单线桥标出电子转移方向和数目_______ 。
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为_______ 。
II.有一种“地康法”制取氯气的反应原理如图所示:
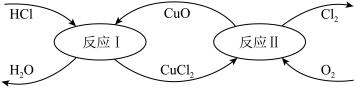
(4)反应I的离子方程式为_______ 。
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种: 、
、 、
、 、
、 、NaI、HI。已知该反应中
、NaI、HI。已知该反应中 只发生了如下过程:
只发生了如下过程: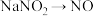 ;写出该反应的化学方程式
;写出该反应的化学方程式_______ 。
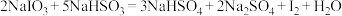
(1)反应中
(2)用单线桥标出电子转移方向和数目
(3)反应产物中,所得氧化产物与还原产物微粒个数之比为
II.有一种“地康法”制取氯气的反应原理如图所示:

(4)反应I的离子方程式为
(5)在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:
 、
、 、
、 、
、 、NaI、HI。已知该反应中
、NaI、HI。已知该反应中 只发生了如下过程:
只发生了如下过程: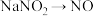 ;写出该反应的化学方程式
;写出该反应的化学方程式
您最近一年使用:0次
2022-10-12更新
|
272次组卷
|
3卷引用:宁夏吴忠市吴忠中学2022-2023学年高一上学期第一次测试化学试题(B卷)
4 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 。
(2)制备 需要在
需要在_______ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是_______ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化 水,至少需要
水,至少需要 的质量为
的质量为_______ kg。
(5)高铁酸钠 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取:
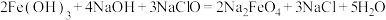
①该反应中氧化剂是_____ (用化学式表示,下同),____ 元素被氧化,还原产物为____ 。
②用双线桥法在方程式中标出电子转移的情况:_____ 。
(6)将 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目____ 。
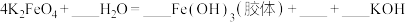
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气  通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放5mg  ,即可达到卫生标准 ,即可达到卫生标准…… |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)消毒净化
 水,至少需要
水,至少需要 的质量为
的质量为(5)高铁酸钠
 是一种新型的净水剂,可以通过下述反应制取:
是一种新型的净水剂,可以通过下述反应制取: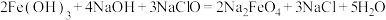
①该反应中氧化剂是
②用双线桥法在方程式中标出电子转移的情况:
(6)将
 与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目
与水反应的化学方程式补充完整并用双线桥表示出电子转移的方向和数目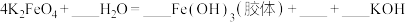
您最近一年使用:0次
5 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:

回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(2)为了提高锌的浸取效果,可采取的措施有_______ 。
(3)加入物质X调节溶液pH=5,最适宜使用的X是_______ (填标号)。
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是Fe(OH)3、_______ 、_______ 。
(4)向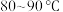 的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2、Fe(OH)3 ,该步反应的离子方程式为
的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2、Fe(OH)3 ,该步反应的离子方程式为_______ 。
(5)滤液②中加入锌粉的目的是_______ 。
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_______ 。

回答下列问题:
(1)菱锌矿焙烧生成氧化锌的化学方程式为
(2)为了提高锌的浸取效果,可采取的措施有
(3)加入物质X调节溶液pH=5,最适宜使用的X是
A.NH3·H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是Fe(OH)3、
(4)向
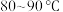 的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2、Fe(OH)3 ,该步反应的离子方程式为
的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2、Fe(OH)3 ,该步反应的离子方程式为(5)滤液②中加入锌粉的目的是
(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
名校
解题方法
6 . 硫氰酸钾(KSCN)俗称玫瑰红酸钾,是一种用途广泛的化学药品,常用于合成树脂、杀虫杀菌剂等。某化学小组用下图实验装置模拟工业制备硫氰酸钾,并进行相关实验探究。

已知:①NH3不溶于CCl4和CS2 ,CS2不溶于水且密度比水大;
②D中三颈烧瓶内盛放CS2、水和催化剂,发生反应 ,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
③KSCN的溶解度随温度变化较大。
回答下列问题:
(1)试剂a是_______ ,装置D中盛装KOH溶液的仪器名称是_______ 。
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是_______ ,保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是_______ 。
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E的作用是吸收尾气,防止污染环境。写出吸收氨气转化为无污染气体的离子方程式是_______ 。
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经_______ (填操作名称)、最后对所得溶液进行减压蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到硫氰酸钾晶体。
(5)晶体中KSCN含量的测定:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应为SCN- + Ag+ = AgSCN↓(白色)]
①指示剂a为_______ 。
②晶体中KSCN的质量分数为_______ %。

已知:①NH3不溶于CCl4和CS2 ,CS2不溶于水且密度比水大;
②D中三颈烧瓶内盛放CS2、水和催化剂,发生反应
 ,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。
,该反应比较缓慢且NH4SCN在高于170℃时易分解,NH4HS在高于25℃时即分解生成NH3和H2S。③KSCN的溶解度随温度变化较大。
回答下列问题:
(1)试剂a是
(2)制备KSCN溶液:将D中反应混合液加热至105℃,打开K1通入氨气。
①反应一段时间后,关闭K1,此时装置C中观察到的现象是
②打开K2,缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
(3)装置E的作用是吸收尾气,防止污染环境。写出吸收氨气转化为无污染气体的离子方程式是
(4)制备硫氰酸钾晶体:先滤去三颈烧瓶中的固体催化剂,再经
(5)晶体中KSCN含量的测定:称取10.0g样品,配成1000mL溶液。量取20.00mL溶液于锥形瓶中,加入适量稀硝酸,再加入几滴a作指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液18.00mL。[已知:滴定时发生的反应为SCN- + Ag+ = AgSCN↓(白色)]
①指示剂a为
②晶体中KSCN的质量分数为
您最近一年使用:0次
名校
7 . 纯碱在生产、生活中有广泛应用。例如可用足量的纯碱溶液吸收含氯气的尾气,生成三种盐(反应1);工业上从海水中提取溴的流程中也用到了纯碱溶液,其主要原理如下:反应2: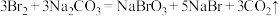 。下列说法正确的是
。下列说法正确的是
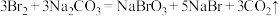 。下列说法正确的是
。下列说法正确的是| A.反应2中氧化产物与还原产物的质量之比为1∶5 |
| B.标准状况下,22.4L溴单质中含有2mol溴原子 |
| C.反应1中生成的三种盐是NaClO,NaClO3和NaHCO3 |
| D.反应2中的Br2与反应1中的Cl2表现出了相似的化学性质 |
您最近一年使用:0次
名校
解题方法
8 . 物质集合M中含有常见物质Na2O2、NaHCO3、Al、SO2、Fe、NH3、Na、F2。这些物质按照以下方法进行分类后如图所示,请按照要求回答问题。
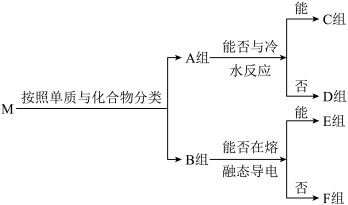
(1)B组物质中属于非电解质的物质为____ ,其中能作制冷剂的物质的电子式为____ 。
(2)C组物质中能与水反应生成还原性气体的化学方程式为____ 。
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:____ 。
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:____ 。
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为____ ;反应中氧化剂与还原剂的物质的量之比为____ 。

(1)B组物质中属于非电解质的物质为
(2)C组物质中能与水反应生成还原性气体的化学方程式为
(3)D组物质中其中一种物质可以制备出另外一种物质,请写出一种该反应在工业上的应用:
(4)请写出F组中的酸性氧化物与酸性KMnO4溶液反应的离子方程式:
(5)在密闭容器中,将E组中的两种物质加热反应,若混合物中金属原子与氧原子的物质的量之比为1:2,混合加热充分反应后,排出气体,剩余固体的成分为
您最近一年使用:0次
2022-09-23更新
|
601次组卷
|
2卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
名校
解题方法
9 . 物质之间的转化关系如图,部分生成物省略。A是由四种元素组成的化合物。C、D是由元素X、Y、Z中两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用。
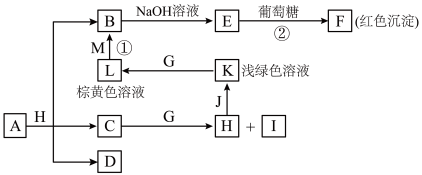
请回答下列问题:
(1)C的电子式____ 。
(2)写出反应①的离子反应方程式____ ,反应②中体现葡萄糖的____ 性。
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。____
(4)写出A的化学式____ 。
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式____ 。
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式____ ,N的一种同素异形体的名称为____ 。

请回答下列问题:
(1)C的电子式
(2)写出反应①的离子反应方程式
(3)比较Y与Z的原子半径大小_____>_____(填写元素符号)。
(4)写出A的化学式
(5)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体;请写出该反应的化学方程式
(6)研究表明:气体D在480℃、800大气压条件下可被活泼金属钠还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出该反应的化学方程式
您最近一年使用:0次
2022-09-20更新
|
344次组卷
|
5卷引用:宁夏固原市第一中学2023届高三上学期第二次月考化学试题
名校
10 . 氧化还原反应在工业生产、环保及科研中有广泛的应用。氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50 ℃时反应可生成它。CuH具有的性质有:不稳定,易分解,在氯气中能燃烧;与稀盐酸反应能生成气体,Cu+在酸性条件下发生的反应是2Cu+=Cu2++Cu。
(1)写出CuH在氯气中燃烧的化学反应方程式:_______ 。
(2)CuH溶解在稀盐酸中反应的离子化学方程式是_______ 。
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_______ 。
(1)写出CuH在氯气中燃烧的化学反应方程式:
(2)CuH溶解在稀盐酸中反应的离子化学方程式是
(3)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
您最近一年使用:0次



