名校
1 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。
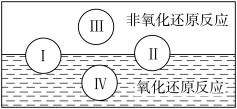
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________ ,其中水为________ 剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___ CuO+____ NH4Cl 
____ Cu+____ CuCl2+____ N2↑+____ H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______ (填元素名称),氧化剂是________ (填化学式)。
③反应中若产生0.2mol的气体,则有________ mol的电子转移。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:

①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是
③反应中若产生0.2mol的气体,则有
您最近一年使用:0次
2019-11-14更新
|
140次组卷
|
2卷引用:宁夏银川一中2019-2020学年高一上学期期中考试化学试题
名校
2 . 氯酸是一种强酸,浓度超过 40%时会发生分解,反应可表示为 aHClO3=bO2↑+ cCl2↑+ dHClO4 + eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
| A.若化学计量数 a = 8,b = 3,则该反应转移电子为 20e- |
| B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:4Cl2+I2 + 6H2O=12H++8Cl-+2IO3- |
| C.氧化产物是高氯酸和氯气 |
| D.由反应可确定:氧化性:HClO4>HClO3 |
您最近一年使用:0次
2019-11-05更新
|
212次组卷
|
4卷引用:山西省吕梁市2020届高三10月模拟化学试题
山西省吕梁市2020届高三10月模拟化学试题2020届高三化学二轮冲刺新题专练——氯及其化合物宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题(已下线)专题39 氯的氧化物、含氧酸及含氧酸盐-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
名校
3 . 在硫酸溶液中,NaClO3和Na2SO3能按粒子个数之比1:2完全反应,生成一种棕黄色气体 X,同时Na2SO3被氧化为Na2SO4,则X为( )
| A.Cl2 | B.Cl2O7 | C.ClO2 | D.Cl2O |
您最近一年使用:0次
2019-10-30更新
|
417次组卷
|
9卷引用:2016-2017学年宁夏吴忠中学高二上学期开学考试化学试卷
2016-2017学年宁夏吴忠中学高二上学期开学考试化学试卷【全国百强校】河北省辛集中学2018-2019学年高一上学期期中考试化学试题山东省淄博市第七中学2019-2020学年高一上学期第一次月考化学试题河南省漯河市实验高中2019-2020学年高一上学期期中考试化学试题江西省上高县第二中学2019-2020学年高一上学期第三次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高一上学期第三次素质检测化学试题江西省高安中学2019-2020学年高一上学期期末考试化学(A卷)试题江西省高安中学2019-2020学年高一上学期期末考试化学(B卷)试题山东省临沂市沂水县第一中学2022-2023学年高一上学期阶段性检测 化学试题
名校
4 . V2O5是钒的重要化合物,工业上多由各种类型的钒矿石提取。根据描述写方程式。
(1)用氯化焙烧法处理钒铅矿。具体为将食盐和钒铅矿(主要含V2O5)在空气中焙烧,产生黄绿色气体,并生成NaVO3。写出化学方程式___________ ;
(2)V2O5具有微弱的碱性,溶于强酸,当pH=1时生成淡黄色的VO2+___________ ;酸性介质中VO2+是一种较强的氧化剂,可以被草酸(H2C2O4)还原为VO2+_____________ ,I-能将VO2+还原为V3+____________ (写出对应离子方程式);
(3)V2O5也是一种强氧化剂,溶于盐酸被还原为VOCl2,并放出氯气。写出对应化学方程式___________ 。
(1)用氯化焙烧法处理钒铅矿。具体为将食盐和钒铅矿(主要含V2O5)在空气中焙烧,产生黄绿色气体,并生成NaVO3。写出化学方程式
(2)V2O5具有微弱的碱性,溶于强酸,当pH=1时生成淡黄色的VO2+
(3)V2O5也是一种强氧化剂,溶于盐酸被还原为VOCl2,并放出氯气。写出对应化学方程式
您最近一年使用:0次
名校
5 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为___ ,还原产物为___ 。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是___ 。
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
__ NaClO+__ NH3·H2O→___ N2H4+___ NaCl+___ H2O
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为____ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_____ 。
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为____ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为
②若有0.8mol还原剂被氧化,则转移电子的物质的量是
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
2019-10-20更新
|
404次组卷
|
6卷引用:云南省鲁甸县一中2019-2020学年高一10月月考化学试题
名校
6 . 工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
已知生成氢氧化物沉淀的pH:
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_____________ ;盐酸溶解MnCO3的离子方程式为___________ ;
(2)向溶液1中加入双氧水,反应的离子方程式是______________________________ ;
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为_______________ ;
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- +____ =______ + ____ + ____ 。
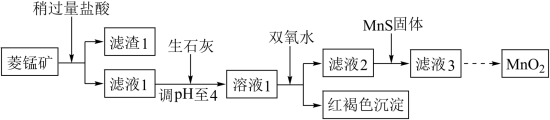
已知生成氢氧化物沉淀的pH:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是
(2)向溶液1中加入双氧水,反应的离子方程式是
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式为
(4)将MnCl2转化为MnO2的一种方法是氧化法,其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式:5Mn2+ + 2ClO3- +
您最近一年使用:0次
7 . 目前合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用氧化气化法提纯,其反应式为: C+ K2Cr2O7+ H2SO4═ CO2↑+ Cr2(SO4)3+ K2SO4+ H2O
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)__________
(2)H2SO4在上述反应中表现出来的性质是_____ (填选项编号)。
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)上述反应中若产生0.2mol CO2,则转移电子的物质的量是_____ mol。
(4)上述反应中氧化剂与还原剂的物质的量比为:_____ 。
(1)配平上述化学反应方程式(请将配平的计量数依次填入上式)
(2)H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
(3)上述反应中若产生0.2mol CO2,则转移电子的物质的量是
(4)上述反应中氧化剂与还原剂的物质的量比为:
您最近一年使用:0次
名校
8 . 根据下列实验现象或要求写离子方程式(描述现象的,需要写出所有涉及的离子方程式。非特殊说明,书写离子方程式)
| 实验现象 | 离子方程式 |
| 1.向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | |
| 2.制备氢氧化铁胶体的化学方程式 | |
| 3.二氧化硫使酸性高锰酸钾溶液褪色 | |
| 4.Fe3O4溶于稀硝酸 | |
| 5.氯化亚铁溶液通入少量氯气,变为黄色溶液,加入过量碘化钾溶液,溶液颜色加深,继续加入NaOH溶液,出现白色沉淀,且颜色不断加深至红褐色。 | |
| 6.澄清石灰水中通入CO2出现白色沉淀,继续通入二氧化碳,沉淀溶解,加热后又出现白色沉淀。 | |
| 7.三氯化铝溶液中加逐滴加入NaOH溶液,先出现白色沉淀,然后溶解,再通入CO2至刚开始出现沉淀。 | |
| 8.NH4Al(SO4)2溶液与Ba(OH)2溶液物质的量1∶2混合 | |
| 9.FeI2与Cl2物质的量1∶2反应 | |
| 10.Ba(OH)2中加入硫酸铝溶液,至沉淀质量不再改变。再加入过量NaHCO3溶液,又出白色沉淀。 | |
| 11.生产硫化钠大多采用无水芒硝(Na2SO4)—碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式 | |
| 12.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),写出该反应的化学方程式 | |
| 13.湿法制备高铁酸钾(K2FeO4)的过程为,在氢氧化铁固体中加入KClO和KOH的混合液。写出该过程的离子方程式并配平。 |
您最近一年使用:0次
2019-09-07更新
|
250次组卷
|
3卷引用:宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题
宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题(已下线)第二节 离子反应(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)9.2.1反应的合理选择(课后)-2019苏教版必修2课前课中课后
名校
9 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
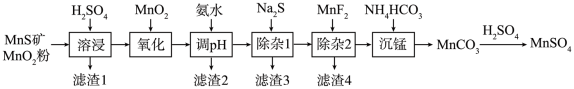
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
您最近一年使用:0次
2019-09-07更新
|
364次组卷
|
7卷引用:宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题
名校
10 . 三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应过程可表示为:

下列说法正确的是( )

下列说法正确的是( )
| A.反应中NO2是还原剂 |
| B.C3N3(OH)3与HNCO为同一物质 |
| C.HNCO与NO2反应的化学计量数之比为3:4 |
| D.反应过程中,每1 mol NO2参加反应,转移电子4 mol |
您最近一年使用:0次



