名校
解题方法
1 . 双碱法脱硫过程如图所示,下列说法不正确的是


| A.双碱法脱硫过程中,NaOH可以循环利用 |
| B.过程II中,1molO2可氧化2molNa2SO3 |
| C.双碱法脱硫过程中,Na2SO3起催化作用 |
D.总反应为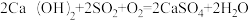 |
您最近一年使用:0次
2024-01-09更新
|
172次组卷
|
2卷引用:广东省东莞市东莞中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
2 . 氯化钠是一种非常重要钠盐。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。
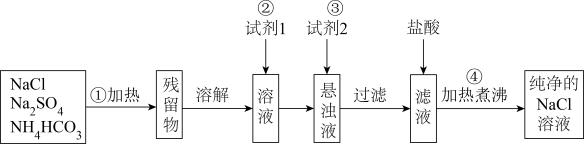
已知:操作①中发生的化学反应方程式为: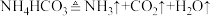
(1)试剂1最好为____________________ (填化学式)。
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:________________________________________ 。
(3)如何检验产品中的溶质为NaCl:______________________________ 。
II. 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
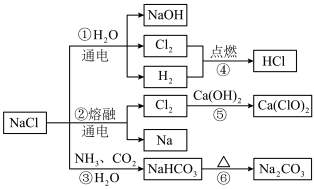
(4)图所列转化反应中属于氧化还原反应的有__________ (填图中序号)。
电解氯化钠溶液发生反应的离子方程式为______________________________ 。
(5)用单线桥分析电解熔融氯化钠时电子转移情况:______________________________ 。

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:______________________________ 。
I.实验室里需要纯净的氯化钠溶液,但现在只有混有硫酸钠、碳酸氢铵的氯化钠固体。某学生设计了如图方案,请回答下列问题。

已知:操作①中发生的化学反应方程式为:
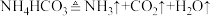
(1)试剂1最好为
(2)加入试剂2的目的除去过量的试剂1中引进的杂质离子,写出加入试剂2发生反应的离子方程式:
(3)如何检验产品中的溶质为NaCl:
II.
 是一种化工原料,如图所示可以制备一系列物质
是一种化工原料,如图所示可以制备一系列物质
(4)图所列转化反应中属于氧化还原反应的有
电解氯化钠溶液发生反应的离子方程式为
(5)用单线桥分析电解熔融氯化钠时电子转移情况:

(6)反应③是侯氏制碱法的原理,反应⑥的化学方程式为:
您最近一年使用:0次
名校
3 . 钠和铁都是重要的金属元素,被广泛应用于冶金、建筑等领域,有着重要的工业利用价值。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是钠及其化合物 的“价−类”二维图。
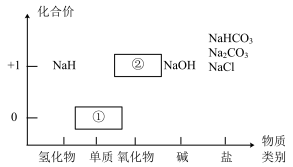
请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式________ 。
(2)银白色固体①应保存在______ 中;①可直接转化为淡黄色固体②,写出该反应的化学方程式_______ 。
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为__________ 。
②由氢元素价态可知,NaH常用作_______ (填“氧化剂”或“还原剂”)。
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平________ 。
(5)该反应中______ 元素被氧化,还原产物是________ 。
I.物质类别和核心元素的价态是学习元素及其化合物性质的两个重要视角。下图是

请回答下列问题:
(1)写出NaHCO3在水中电离的离子方程式
(2)银白色固体①应保存在
(3)氢化钠(NaH)是一种储氢材料,室温下能结合CO2制氢:4NaH+3CO2=2Na2CO3+C+2H2。
①该反应中氧化产物和还原产物的物质的量之比为
②由氢元素价态可知,NaH常用作
II.绿矾(七水合硫酸亚铁,FeSO4·7H2O)能够用于处理工业废水中具有强氧化性的离子重铬酸根(Cr2O72−),反应原理为: Fe2++ Cr2O72−+ H+ = Fe3++ Cr3++ H2O
(4)填写空格,完成该反应方程式的配平
(5)该反应中
您最近一年使用:0次
名校
4 . 某实验小组以废催化剂(含 、
、 、
、 及少量的
及少量的 )为原料,回收锌和铜,设计实验流程如图:
)为原料,回收锌和铜,设计实验流程如图:
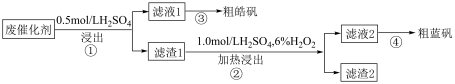
已知: 不溶于硫酸
不溶于硫酸
(1)在步骤①中,为提高浸出效率,可以采取的操作有___________ (写出一种即可)。
(2)粗皓矾的化学式为___________ 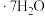 ,处理步骤①的污染气体可以用氢氧化钠溶液,反应的离子方程式为:
,处理步骤①的污染气体可以用氢氧化钠溶液,反应的离子方程式为:___________ 。
(3)在“滤液1”中,为检验是否含有 ,可以采用的试剂是
,可以采用的试剂是___________ (填化学式),若没有观察到___________ ,则不存在 。
。
(4)蓝矾主要成分为: ,步骤②中生成
,步骤②中生成 的离子方程式为(已知该反应没有生成气体,滤渣2中不含S元素):
的离子方程式为(已知该反应没有生成气体,滤渣2中不含S元素):___________ 。
(5)该组同学欲用 的浓硫酸和蒸馏水配制
的浓硫酸和蒸馏水配制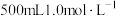 的稀硫酸。
的稀硫酸。
①首先用量筒量取___________ mL(保留1位小数)浓硫酸注入盛有一定量蒸馏水的烧杯中。
②除量筒、烧杯以外,整个溶液配制过程还需要使用的仪器有___________ 。
③配制过程中,下列操作会导致所配稀硫酸物质的量浓度偏小的是___________ 。(填字母)
A.容量瓶中原有少量蒸馏水
B.溶液注入容量瓶前没有冷却至室温
C.定容时仰视刻度线
D.颠倒摇匀后发现液面低于刻度线,但没加水
 、
、 、
、 及少量的
及少量的 )为原料,回收锌和铜,设计实验流程如图:
)为原料,回收锌和铜,设计实验流程如图:
已知:
 不溶于硫酸
不溶于硫酸(1)在步骤①中,为提高浸出效率,可以采取的操作有
(2)粗皓矾的化学式为
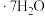 ,处理步骤①的污染气体可以用氢氧化钠溶液,反应的离子方程式为:
,处理步骤①的污染气体可以用氢氧化钠溶液,反应的离子方程式为:(3)在“滤液1”中,为检验是否含有
 ,可以采用的试剂是
,可以采用的试剂是 。
。(4)蓝矾主要成分为:
 ,步骤②中生成
,步骤②中生成 的离子方程式为(已知该反应没有生成气体,滤渣2中不含S元素):
的离子方程式为(已知该反应没有生成气体,滤渣2中不含S元素):(5)该组同学欲用
 的浓硫酸和蒸馏水配制
的浓硫酸和蒸馏水配制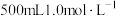 的稀硫酸。
的稀硫酸。①首先用量筒量取
②除量筒、烧杯以外,整个溶液配制过程还需要使用的仪器有
③配制过程中,下列操作会导致所配稀硫酸物质的量浓度偏小的是
A.容量瓶中原有少量蒸馏水
B.溶液注入容量瓶前没有冷却至室温
C.定容时仰视刻度线
D.颠倒摇匀后发现液面低于刻度线,但没加水
您最近一年使用:0次
5 . Ⅰ.某化学兴趣小组的同学学了金属的电化学腐蚀,对教材叙述[钢铁在酸性环境中发生析氢腐蚀;在酸性很弱或呈中性,溶有 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
(1)用图1所示装置进行实验:打开a________ (填仪器名称)的活塞,加入1mL溶液,测得压强随时间变化曲线如图2。
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是___________ ,提出改进措施___________ 。改进后,再次实验,证明甲、乙的猜想均正确,请在图2绘制出改进后的曲线___________ 。
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是___________ 。
(4)对于图3中 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为___________ 。
综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
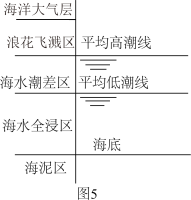
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因___________ 。 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应___________ (离子方程式)。___________ (任写一点即可)。
 的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。
的环境中发生吸氧腐蚀;钢铁等金属的腐蚀主要为吸氧腐蚀]产生疑问,决定用数字化实验模拟探究钢铁在酸性环境下的腐蚀情况。(1)用图1所示装置进行实验:打开a
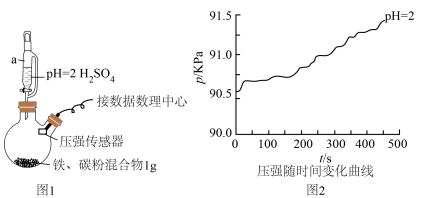
(2)同学乙认为甲的结论不科学,锥形瓶内压强变大还可能是
(3)同学丙认为甲、乙的实验不具代表性,建议用不同浓度的酸进行实验。在改进后的装置中分别用
 、
、 的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是
的硫酸实验,测定压强随时间变化情况,结果如图3.同学丙得出:酸性较弱时,铁会发生吸氧腐蚀,其依据是(4)对于图3中
 时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中
时,铁是否发生了腐蚀?同学们意见不统一,经讨论,他们把压强传感器换成氧气传感器,得出不同pH时装置中 浓度随时间的变化曲线如图4。
浓度随时间的变化曲线如图4。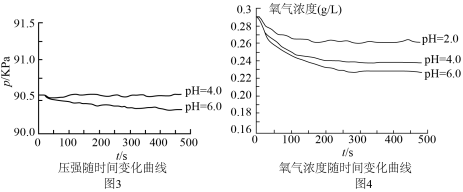
 时,压强几乎不随时间改变是因为
时,压强几乎不随时间改变是因为综上,小组同学得出结论:教材表述科学严谨。
Ⅱ.拓展研究:
(5)侯保荣院士专门研究海洋钢架结构桥海洋大气层梁腐蚀,他发现腐蚀最严重的是浪花飞溅区浪花飞溅区(海洋环境分区如图5),请你解释原因
 浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的
浓度很小的海底也有厌氧微生物(如硫酸盐还原菌SRB)对海洋钢制部件的腐蚀,其原理如图6,已知溶液中的 完全转化为FeS,请写出该铁合金腐蚀的总反应
完全转化为FeS,请写出该铁合金腐蚀的总反应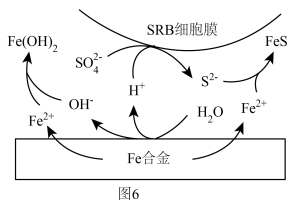
您最近一年使用:0次
2024-01-05更新
|
958次组卷
|
3卷引用:2024届广东东莞中学、广州二中、惠州一中、深圳实验、珠海一中、中山纪念中学六校高三上学期第三次联考化学
名校
6 . 根据氧化还原反应的相关知识,回答下列问题:
(1)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。如图:
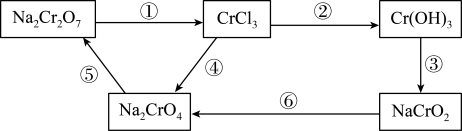
①需要加入氧化剂的反应是___________ (填编号,下同)。
②已知Na2Cr2O7在常温下,能与浓盐酸发生如下反应,请配平以下反应:__________ ,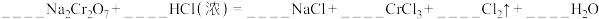 ,反应中:氧化剂是
,反应中:氧化剂是___________ ,氧化产物是___________ ;生成35.5gCl2时,被氧化的还原剂量为___________ g;浓盐酸体现出___________ 性。
(2)NaH可在野外作生氢剂,反应原理为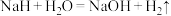 ,反应中氧化产物和还原产物的质量比为
,反应中氧化产物和还原产物的质量比为___________ 。
(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子,则反应的化学方程式为___________ 。
(1)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。如图:

①需要加入氧化剂的反应是
②已知Na2Cr2O7在常温下,能与浓盐酸发生如下反应,请配平以下反应:
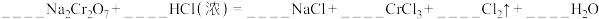 ,反应中:氧化剂是
,反应中:氧化剂是(2)NaH可在野外作生氢剂,反应原理为
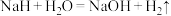 ,反应中氧化产物和还原产物的质量比为
,反应中氧化产物和还原产物的质量比为(3)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子,则反应的化学方程式为
您最近一年使用:0次
名校
解题方法
7 . 一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3、FeO及SiO2等)为原料制备无机高分子絮凝剂——聚合碱式氯化铝铁的流程如图:
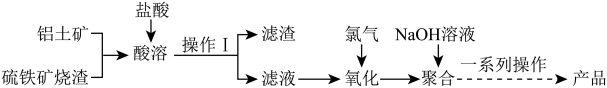
(资料:SiO2为难溶于盐酸的固体)
(1)“滤液”中含有的金属阳离子为_______ 。
(2)通入氯气的目的是_______ ;写出反应的离子方程式:_______ 。
(3)硫铁矿的主要成分为FeS2,高温煅烧可得烧渣(主要成分为Fe2O3),写出硫铁矿煅烧的化学方程式:_______ 。
(4)实验中需要用到240 mL 1mol•L-1盐酸。
①现用浓度为11.8 mol•L-1的浓盐酸来配制,需要量取浓盐酸的体积为_______ mL(保留一位小数),实验中除了量筒、烧杯、玻璃棒、250mL容量瓶之外,还需要的玻璃仪器有_______ 。
②配制时,其正确的操作顺序是_______ (用字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.定容
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
③若出现如下情况,对所配溶液的浓度将有何影响?加蒸馏水时不慎超过了刻度线:_______ (填“偏低”、“偏高”或“无影响”,下同);定容时俯视:_______ 。

(资料:SiO2为难溶于盐酸的固体)
(1)“滤液”中含有的金属阳离子为
(2)通入氯气的目的是
(3)硫铁矿的主要成分为FeS2,高温煅烧可得烧渣(主要成分为Fe2O3),写出硫铁矿煅烧的化学方程式:
(4)实验中需要用到240 mL 1mol•L-1盐酸。
①现用浓度为11.8 mol•L-1的浓盐酸来配制,需要量取浓盐酸的体积为
②配制时,其正确的操作顺序是
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶中,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.定容
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
③若出现如下情况,对所配溶液的浓度将有何影响?加蒸馏水时不慎超过了刻度线:
您最近一年使用:0次
名校
8 . 按要求完成下列题目。
(1)书写对应的化学方程式:
①用氯气制备漂白粉:___________ 。
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:___________ 。
③呼吸面具中过氧化钠与二氧化碳反应:___________ 。
④KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2气体,还生成CO2和KHSO4等物质。写出该反应的化学方程式___________ 。
(2)书写对应的离子方程式:
⑤制作印刷电路板时氯化铁溶液腐蚀铜:___________ 。
⑥用高锰酸钾酸性溶液检验溶液中的亚铁离子(还原产物为Mn2+):___________ 。
⑦在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为___________ 。
(1)书写对应的化学方程式:
①用氯气制备漂白粉:
②固体管道疏通剂(主要成分有氢氧化钠和铝粉)的疏通原理:
③呼吸面具中过氧化钠与二氧化碳反应:
④KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2气体,还生成CO2和KHSO4等物质。写出该反应的化学方程式
(2)书写对应的离子方程式:
⑤制作印刷电路板时氯化铁溶液腐蚀铜:
⑥用高锰酸钾酸性溶液检验溶液中的亚铁离子(还原产物为Mn2+):
⑦在酸性条件下,向含铬废水中加入FeSO4,可将
 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为
您最近一年使用:0次
名校
9 . 完成下列问题。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为 )与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为_________ 。某同学拟用该原理按如下装置制备并收集纯净的氯气,在虚线框内选用的发生装置_________ (填“甲”“乙”或“丙”)。
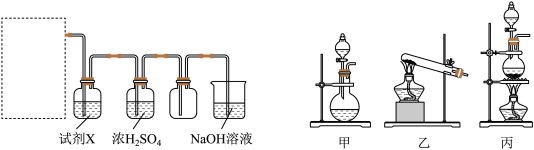
试剂X是________ 。可用NaOH溶液吸收尾气,反应的离子方程式为_______ 。
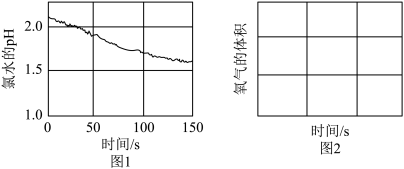
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是___________ (请用化学方程式说明),请在图2中画出氧气的体积随时间变化的趋势图___________ 。
(3)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠( )溶液可制备新的绿色消毒剂二氧化氯(
)溶液可制备新的绿色消毒剂二氧化氯( ),反应中还可得到氯化钠。该反应的化学方程式为
),反应中还可得到氯化钠。该反应的化学方程式为__________ 。
(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为: 。分析
。分析 中Fe元素的化合价推测该微粒具有的性质
中Fe元素的化合价推测该微粒具有的性质__________ 。
(1)18世纪70年代,瑞典化学家舍勒将软锰矿(主要成分为
 )与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
)与浓盐酸混合加热,产生了一种黄绿色有刺激性气味的气体。该反应的化学方程式为
试剂X是
(2)通过大量实验证明,氯气与水反应生成次氯酸,次氯酸能杀菌消毒。可利用数字化实验探究次氯酸的化学性质,用强光照射氯水,得到氯水的pH随时间变化如图1所示,氯水的pH下降的原因是

(3)使用氯气消毒易产生危害人体健康的有机氯化物。用氯气和亚氯酸钠(
 )溶液可制备新的绿色消毒剂二氧化氯(
)溶液可制备新的绿色消毒剂二氧化氯( ),反应中还可得到氯化钠。该反应的化学方程式为
),反应中还可得到氯化钠。该反应的化学方程式为(4)随着科技的进步,科学家们又发现一种新型绿色消毒剂高铁酸钠。工业上制备高铁酸钠的一种方法的离子方程式为:
 。分析
。分析 中Fe元素的化合价推测该微粒具有的性质
中Fe元素的化合价推测该微粒具有的性质
您最近一年使用:0次
解题方法
10 . 铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。湿法炼锌产生的铜镉渣用于生产金属镉的工艺流程如图:
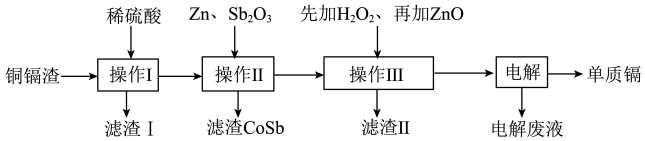
表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 )
)
(1)酸浸铜镉渣时,加快反应速率的措施有_______ (写一条)。滤渣Ⅰ的主要成分是_______ (填化学式)。
(2)操作III中先加入适量 ,发生反应的离子方程式
,发生反应的离子方程式_______ ;再加入ZnO调节反应液的pH,pH范围为_______ ;选择_______ (填“铁氰化钾”或“硫氰化钾”)试剂,能证明添加的 已过量。
已过量。
(3)常用沉淀转化法处理含 废水,写出碳酸钙处理
废水,写出碳酸钙处理 的离子方程式
的离子方程式______ ;若反应达到平衡后溶液中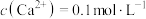 ,溶液中
,溶液中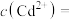
______  。[已知25℃,
。[已知25℃,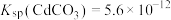 ,
,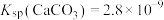 ]
]

表中列出了相关金属离子生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1
 )
)(1)酸浸铜镉渣时,加快反应速率的措施有
| 氢氧化物 |  |  | 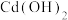 |  |
| 开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.0 |
| 沉淀完全的pH | 3.3 | 9.9 | 9.5 | 11.1 |
(2)操作III中先加入适量
 ,发生反应的离子方程式
,发生反应的离子方程式 已过量。
已过量。(3)常用沉淀转化法处理含
 废水,写出碳酸钙处理
废水,写出碳酸钙处理 的离子方程式
的离子方程式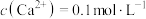 ,溶液中
,溶液中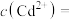
 。[已知25℃,
。[已知25℃,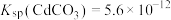 ,
,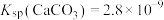 ]
]
您最近一年使用:0次



