名校
解题方法
1 . 84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒。某兴趣小组对84 消毒液的组成、性质与使用进行探究。所用试剂:84消毒液(含 )、医用酒精(乙醇体积分数为70~75%)
)、医用酒精(乙醇体积分数为70~75%)
Ⅰ.探究84消毒液的成分
(1)实测该84消毒液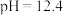 ,能使
,能使 试纸先变
试纸先变___________ 色后褪色,因此其成分中,除了 、
、 ,还含有少量
,还含有少量___________ (填化学式)。
(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是(用化学方程式表示)___________ 。
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是___________ 。巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长该反应的化学方程式为
促进藻类快速生长该反应的化学方程式为___________ 。
Ⅲ.84消毒液能否与医用酒精混用实验装置如图所示
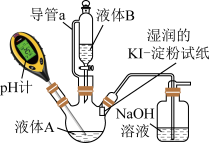
已知: 是常见的还原剂;单质碘(
是常见的还原剂;单质碘( )遇淀粉变蓝。
)遇淀粉变蓝。
(4)判断实验②中生成了 的依据是
的依据是___________ 。
(5)图中 溶液的作用是
溶液的作用是___________ 。
(6)实验过程中混合溶液的 逐渐增大至13.1,预测酒精与
逐渐增大至13.1,预测酒精与 反应还可能生成
反应还可能生成 ,但得补充以下实验③,才能说明反应中有
,但得补充以下实验③,才能说明反应中有 生成。填写表中空白完成实验设计。
生成。填写表中空白完成实验设计。
结论:医用酒精可与84消毒液发生反应,二者不可混用。
 )、医用酒精(乙醇体积分数为70~75%)
)、医用酒精(乙醇体积分数为70~75%)Ⅰ.探究84消毒液的成分
(1)实测该84消毒液
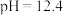 ,能使
,能使 试纸先变
试纸先变 、
、 ,还含有少量
,还含有少量(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是(用化学方程式表示)
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是
 与
与 反应产生
反应产生 促进藻类快速生长该反应的化学方程式为
促进藻类快速生长该反应的化学方程式为Ⅲ.84消毒液能否与医用酒精混用实验装置如图所示

已知:
 是常见的还原剂;单质碘(
是常见的还原剂;单质碘( )遇淀粉变蓝。
)遇淀粉变蓝。| 序号 | 液体A | 液体B | 现象 |
| ① |  ( ( )的84消毒液 )的84消毒液 |  蒸馏水 蒸馏水 | 溶液中无明显现象;溶液 变为12.0;淀粉- 变为12.0;淀粉- 试纸在 试纸在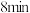 时变蓝, 时变蓝, 时蓝色完全褪去 时蓝色完全褪去 |
| ② |  ( (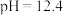 )的84消毒液 )的84消毒液 |  医用酒精 医用酒精 | 产生气泡,颜色无明显变化;溶液 升高到13.1,淀粉- 升高到13.1,淀粉- 试纸在 试纸在 时变蓝, 时变蓝,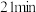 时蓝色完全褪去 时蓝色完全褪去 |
(4)判断实验②中生成了
 的依据是
的依据是(5)图中
 溶液的作用是
溶液的作用是(6)实验过程中混合溶液的
 逐渐增大至13.1,预测酒精与
逐渐增大至13.1,预测酒精与 反应还可能生成
反应还可能生成 ,但得补充以下实验③,才能说明反应中有
,但得补充以下实验③,才能说明反应中有 生成。填写表中空白完成实验设计。
生成。填写表中空白完成实验设计。| 序号 | 液体A | 液体B | 现象 |
| ③ |  ( (  溶液 溶液 |  医用酒精 医用酒精 | 溶液 升高到12.6 升高到12.6 |
您最近一年使用:0次
名校
解题方法
2 . 硝酸厂烟气中的大量NO经还原法可转化为无害物质。常温下,将NO与 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是
 的混合气体通入
的混合气体通入 与
与 的混合溶液中,其转化过程如图所示。下列说法错误的是
的混合溶液中,其转化过程如图所示。下列说法错误的是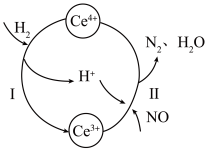
A.该转化过程的实质为NO被 还原 还原 |
| B.反应I中氧化剂与还原剂的物质的量之比为1∶2 |
C.反应II的离子反应方程式为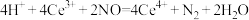 |
D.反应过程中混合溶液内 和 和 的总数不变 的总数不变 |
您最近一年使用:0次
2023-11-29更新
|
698次组卷
|
5卷引用:广东省深圳市南头中学2023-2024学年高一上学期期末调研考试(模拟)化学试题
名校
3 . 回答下列问题:
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:_______ 。
(2)在一定条件下, 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被_______ (填“氧化”或“还原”), 中R的化合价是
中R的化合价是_______ 价。
(3)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。
①该反应中的氧化剂是_______ (填化学式,下同)
②该反应中,发生还原反应的过程是:_______ →_______ 。
(4) ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目_______ 。
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和
 反应的化学方程式:
反应的化学方程式:(2)在一定条件下,
 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被 中R的化合价是
中R的化合价是(3)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。①该反应中的氧化剂是
②该反应中,发生还原反应的过程是:
(4)
 ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目
您最近一年使用:0次
名校
解题方法
4 . 某同学类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
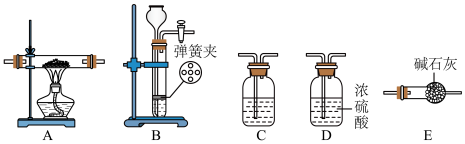
依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置___________ (填装置下方对应字母),反应的化学方程式为___________ 。
(2)装置 C所装的试剂是___________ ,发生的反应为(用离子方程式表示)___________ 。
(3)为达到实验目的,选择上图中的装置,其连接顺序为:按二氧化碳的发生装置→___________ 。(按气流方向,填写装置的大写字母)。
(4)操作中通空气和加热的先后顺序为___________ 。
(5)该同学在制取 的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
(6)若反应过程中 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为 ;②生成的固体物质为
;②生成的固体物质为 和C的混合物③生成的固体物质为
和C的混合物③生成的固体物质为 和
和 的混合物;④生成的固体物质为
的混合物;④生成的固体物质为 和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是___________ ;则钠与 反应的化学方程式为
反应的化学方程式为___________ 。
(7)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知, 溶液可以吸收
溶液可以吸收 ,同时得到黑色的
,同时得到黑色的 和一种酸。于是他在装置后加装一个盛
和一种酸。于是他在装置后加装一个盛 溶液的吸收装置,该装置中发生反应的化学方程式为
溶液的吸收装置,该装置中发生反应的化学方程式为___________ 。

依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置
(2)装置 C所装的试剂是
(3)为达到实验目的,选择上图中的装置,其连接顺序为:按二氧化碳的发生装置→
(4)操作中通空气和加热的先后顺序为
(5)该同学在制取
 的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。| A.稀硝酸 | B. 溶液 溶液 |
| C.煤油 | D. (无色有机溶剂,与水互不相溶,密度比水大) (无色有机溶剂,与水互不相溶,密度比水大) |
(6)若反应过程中
 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为 ;②生成的固体物质为
;②生成的固体物质为 和C的混合物③生成的固体物质为
和C的混合物③生成的固体物质为 和
和 的混合物;④生成的固体物质为
的混合物;④生成的固体物质为 和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是 反应的化学方程式为
反应的化学方程式为(7)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,
 溶液可以吸收
溶液可以吸收 ,同时得到黑色的
,同时得到黑色的 和一种酸。于是他在装置后加装一个盛
和一种酸。于是他在装置后加装一个盛 溶液的吸收装置,该装置中发生反应的化学方程式为
溶液的吸收装置,该装置中发生反应的化学方程式为
您最近一年使用:0次
2023-11-28更新
|
133次组卷
|
2卷引用:广东省广州市第二中学教育集团联考2023-2024学年高一上学期11月期中考试化学试题
名校
5 . 一实验小组利用酸性 和
和 (草酸)反应研究影响反应速率的因素,设计实验方案如表。请回答相关问题:
(草酸)反应研究影响反应速率的因素,设计实验方案如表。请回答相关问题:
(1)该反应的还原剂为_____ 。
(2)实验时,分别量取 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定_____ 来判断反应的快慢。
(3)上表中
_____ ,实验①和实验②是探究_____ 对化学反应速率的影响,实验②和实验③是探究_____ 对化学反应速率的影响。
(4)若实验①在2min末产生了2.24mL(标准状况) ,则在0~2min内,
,则在0~2min内,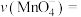
_____  。(假设混合溶液体积为5mL,忽略溶液体积变化)
。(假设混合溶液体积为5mL,忽略溶液体积变化)
(5)实验①和实验②起初反应均很慢,过了一会儿速率突然增大,原因可能是_____ 。
 和
和 (草酸)反应研究影响反应速率的因素,设计实验方案如表。请回答相关问题:
(草酸)反应研究影响反应速率的因素,设计实验方案如表。请回答相关问题:| 编号 | 温度/℃ |  溶液 溶液 | 酸性 溶液 溶液 | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | ||
| ① | 25 | 0.10 | 2.0 | 0.010 | 3.0 |
| ② | 25 | 0.20 |  | 0.010 | 3.0 |
| ③ | 50 | 0.20 | 2.0 | 0.010 | 3.0 |
(2)实验时,分别量取
 溶液和酸性
溶液和酸性 溶液,迅速混合并开始计时,通过测定
溶液,迅速混合并开始计时,通过测定(3)上表中

(4)若实验①在2min末产生了2.24mL(标准状况)
 ,则在0~2min内,
,则在0~2min内,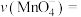
 。(假设混合溶液体积为5mL,忽略溶液体积变化)
。(假设混合溶液体积为5mL,忽略溶液体积变化)(5)实验①和实验②起初反应均很慢,过了一会儿速率突然增大,原因可能是
您最近一年使用:0次
名校
6 . 研究大气中含硫化合物(主要是 和
和 )的转化具有重要意义。
)的转化具有重要意义。
(1)工业上采用高温热分解 的方法制取
的方法制取 ,在膜反应器中分离
,在膜反应器中分离 ,发生的反应为
,发生的反应为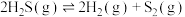

已知:①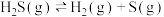
 ;②
;②

则
_____ (用含 、
、 的式子表示)。
的式子表示)。
(2)土壤中的微生物可将大气中的 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
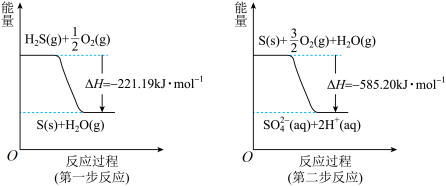
则

_____ 。1mol 全部被氧化为
全部被氧化为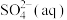 的热化学方程式为
的热化学方程式为_____ 。
(3)将 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收S,其物质转化如图所示。
的混合溶液中反应回收S,其物质转化如图所示。
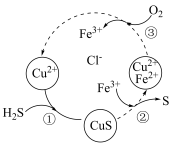
①该循环过程中 的作用是
的作用是_____ ,图示总反应的化学方程式为_____ 。
②已知反应③生成1mol 时放出akJ热量,则反应③中转移
时放出akJ热量,则反应③中转移 个电子时,放出
个电子时,放出_____ kJ热量。(用含a的式子表示)
 和
和 )的转化具有重要意义。
)的转化具有重要意义。(1)工业上采用高温热分解
 的方法制取
的方法制取 ,在膜反应器中分离
,在膜反应器中分离 ,发生的反应为
,发生的反应为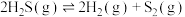

已知:①
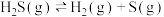
 ;②
;②

则

 、
、 的式子表示)。
的式子表示)。(2)土壤中的微生物可将大气中的
 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
则


 全部被氧化为
全部被氧化为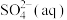 的热化学方程式为
的热化学方程式为(3)将
 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收S,其物质转化如图所示。
的混合溶液中反应回收S,其物质转化如图所示。
①该循环过程中
 的作用是
的作用是②已知反应③生成1mol
 时放出akJ热量,则反应③中转移
时放出akJ热量,则反应③中转移 个电子时,放出
个电子时,放出
您最近一年使用:0次
2023-11-23更新
|
105次组卷
|
2卷引用:广东省广州市六校联考2023-2024学年高二上学期11月期中化学试题
解题方法
7 . 工厂烟气中含有的 ,直接排放会污染空气。
,直接排放会污染空气。
(1)从元素价态、物质类别的角度,预测并验证 的部分化学性质。
的部分化学性质。
①从硫元素的价态角度分析,预测 既有氧化性又有还原性。将
既有氧化性又有还原性。将 通入酸性高锰酸钾溶液中,紫色褪去,生成了
通入酸性高锰酸钾溶液中,紫色褪去,生成了 ,反应中体现了
,反应中体现了 的
的___________ 性。 还能与
还能与 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为___________ ,该反应中,作氧化剂的是___________ (填化学式)。
②从物质类别角度分析, 属于酸性氧化物,类似
属于酸性氧化物,类似 ,
, 和过量
和过量 溶液反应的离子方程式为
溶液反应的离子方程式为___________ 。
(2)工业上燃煤时常在煤炭中加入石灰石,从源头上减少 排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应
排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应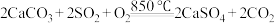 。
。
①通入的气体中氧气的浓度偏低时,产生的CO与 反应生成CaO等三种氧化物,该反应的化学方程式为
反应生成CaO等三种氧化物,该反应的化学方程式为___________ ,被氧化的元素为___________ (填元素符号)。
②从物质类别角度分析,上述涉及的物质中,既属于电解质又属于盐的是___________ 。
 ,直接排放会污染空气。
,直接排放会污染空气。(1)从元素价态、物质类别的角度,预测并验证
 的部分化学性质。
的部分化学性质。①从硫元素的价态角度分析,预测
 既有氧化性又有还原性。将
既有氧化性又有还原性。将 通入酸性高锰酸钾溶液中,紫色褪去,生成了
通入酸性高锰酸钾溶液中,紫色褪去,生成了 ,反应中体现了
,反应中体现了 的
的 还能与
还能与 反应,生成硫单质和水,反应的化学方程式为
反应,生成硫单质和水,反应的化学方程式为②从物质类别角度分析,
 属于酸性氧化物,类似
属于酸性氧化物,类似 ,
, 和过量
和过量 溶液反应的离子方程式为
溶液反应的离子方程式为(2)工业上燃煤时常在煤炭中加入石灰石,从源头上减少
 排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应
排放。在煤炭中加入一定量石灰石,850℃在氧气的作用下,发生反应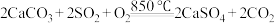 。
。①通入的气体中氧气的浓度偏低时,产生的CO与
 反应生成CaO等三种氧化物,该反应的化学方程式为
反应生成CaO等三种氧化物,该反应的化学方程式为②从物质类别角度分析,上述涉及的物质中,既属于电解质又属于盐的是
您最近一年使用:0次
2023-11-23更新
|
315次组卷
|
4卷引用:广东省茂名市七迳中学2023-2024学年高一上学期期中考试化学试卷
广东省茂名市七迳中学2023-2024学年高一上学期期中考试化学试卷广东省湛江市2023-2024学年高一上学期11月期中考试化学试题辽宁省葫芦岛市协作校2023-2024学年高一上学期第二次考试化学试题(已下线)第01讲 硫及其化合物-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)
名校
解题方法
8 . 按要求完成下列填空:
(1)碳酸钡在水中的电离方程式:___________ 。
(2)硫酸氢钠在熔融状态的电离方程式:___________ 。
(3)盐酸和小苏打反应的离子方程式:___________ 。
(4)向澄清石灰水中通入过量CO2反应的离子方程式:___________ 。
(5)铜绿Cu2(OH)2CO3溶于硫酸溶液的离子方程式:___________ 。
(6)配平方程式:___________ 。
_______K2CrO4+______HCl(浓)=_______KCl+______CrCl3+_______Cl2↑+________
(7)锌矿(主要成分ZnS),浸出过程原理如图所示,ZnS浸出总反应的离子方程式为_______ 。
(1)碳酸钡在水中的电离方程式:
(2)硫酸氢钠在熔融状态的电离方程式:
(3)盐酸和小苏打反应的离子方程式:
(4)向澄清石灰水中通入过量CO2反应的离子方程式:
(5)铜绿Cu2(OH)2CO3溶于硫酸溶液的离子方程式:
(6)配平方程式:
_______K2CrO4+______HCl(浓)=_______KCl+______CrCl3+_______Cl2↑+________
(7)锌矿(主要成分ZnS),浸出过程原理如图所示,ZnS浸出总反应的离子方程式为

您最近一年使用:0次
名校
解题方法
9 . 亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂。以氯酸钠等为原料制备亚氯酸钠的工艺流程如图:

已知:亚氯酸钠受热易分解。
(1)“反应1”中氧化剂与还原剂的个数比为___________ 。
(2)“反应2”的化学方程式为___________ 。
(3)从“母液”中可回收的主要物质是___________ (填化学式)。
(4)氧化吸收法是常见的消除氮氧化物尾气的方法:
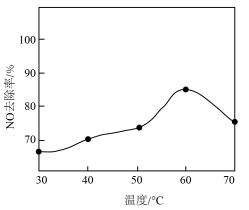
①酸性条件下,NaClO2吸收剂可有效氧化NO。其他条件一定时,温度对NO去除率的影响如图,温度高于60℃后,NO去除率下降,其原因可能是___________ 。
②酸性条件下,NaClO溶液可以氧化N2O,生成Cl-和 。其他条件一定时,N2O转化为
。其他条件一定时,N2O转化为 的转化率随NaClO溶液初始pH的变化如图所示:
的转化率随NaClO溶液初始pH的变化如图所示:
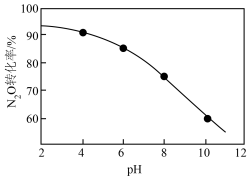
NaClO溶液的初始pH越小,N2O转化率越高,其原因可能是___________ 。

已知:亚氯酸钠受热易分解。
(1)“反应1”中氧化剂与还原剂的个数比为
(2)“反应2”的化学方程式为
(3)从“母液”中可回收的主要物质是
(4)氧化吸收法是常见的消除氮氧化物尾气的方法:
①酸性条件下,NaClO2吸收剂可有效氧化NO。其他条件一定时,温度对NO去除率的影响如图,温度高于60℃后,NO去除率下降,其原因可能是

②酸性条件下,NaClO溶液可以氧化N2O,生成Cl-和
 。其他条件一定时,N2O转化为
。其他条件一定时,N2O转化为 的转化率随NaClO溶液初始pH的变化如图所示:
的转化率随NaClO溶液初始pH的变化如图所示:
NaClO溶液的初始pH越小,N2O转化率越高,其原因可能是
您最近一年使用:0次
名校
10 . I.高铁酸钠 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)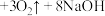 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠 属于
属于___________ (“酸”、“碱”、“盐”或“氧化物”,其中铁的化合价为___________ 价。
(2)将上述反应的化学方程式改写成离子方程式:___________ 。
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。用
。用单线桥 标出上述方程式的电子转移方向和数目___________ 。
(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是___________ 。
②某同学按要求制备了 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。
现象1:先出现沉淀,原因是___________ 。
现象2:随后沉淀溶解,此反应的离子方程式是___________ 。
II、亚硝酸钠 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。
(5) 表现的性质是___________(填字母)
表现的性质是___________(填字母)
(6)利用氧化还原反应化合价升降总数相等配平该方程式:___________ 。
 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)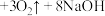 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:(1)高铁酸钠
 属于
属于(2)将上述反应的化学方程式改写成离子方程式:
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
 。用
。用(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是
②某同学按要求制备了
 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。现象1:先出现沉淀,原因是
现象2:随后沉淀溶解,此反应的离子方程式是
II、亚硝酸钠
 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。(5)
 表现的性质是___________(填字母)
表现的性质是___________(填字母)| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
您最近一年使用:0次



