1 . 某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【查阅资料】i. 在酸性条件下发生反应:
在酸性条件下发生反应: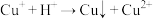 (未配平);
(未配平);
ii.氧化性: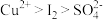 ;
;
iii.部分含铜物质的性质如下表:
【实验准备】用亚硫酸钠固体配制 溶液:
溶液:
(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、___________ (填仪器名称),检验亚硫酸钠溶液在空气中是否变质所需的试剂为___________ 。
【合理预测】
(2)上表“预测1”中的实验现象为_______ 。“预测2”中反应的离子方程式为________ 。
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到___________ 的实验现象,可推出橙黄色沉淀中一定含有+1价的铜元素。
③
该实验现象___________ (填“能”或“不能”)证明橙黄色沉淀中含有 和
和 。
。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。【查阅资料】i.
 在酸性条件下发生反应:
在酸性条件下发生反应: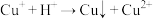 (未配平);
(未配平);ii.氧化性:
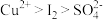 ;
;iii.部分含铜物质的性质如下表:
| 物质 | 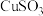 | 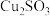 |  | 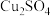 |
| 难溶于水的固体 | 可溶于水的固体 | |||
| 颜色 | 绿色 | 红色 | 白色 | 灰色 |
 溶液:
溶液:(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、
【合理预测】
| 实验现象(不需要填写溶液颜色变化) | 反应类型 | |
| 预测1 | ___________ | 复分解反应 |
| 预测2 | 生成红色沉淀 | 氧化还原反应 |
| 预测3 | 生成白色沉淀 |
(2)上表“预测1”中的实验现象为
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
| 白色沉淀 | 橙黄色沉淀 |
 | 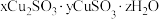 |
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中
 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到
③

该实验现象
 和
和 。
。
您最近一年使用:0次
2 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒 是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为
是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为___________ 。工业上用浓 焙烧
焙烧 的方法提取硒元素,其中
的方法提取硒元素,其中 元素转化为
元素转化为 ,且有
,且有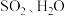 和
和 (固体)生成,该反应的化学方程式为
(固体)生成,该反应的化学方程式为___________ 。
(2)下列说法正确的是___________。
(3)短周期元素d、、f、g、h、x都可能存在于某些食品添加剂中,下表列出了该六种元素在周期表中的位置。请回答下列问题。
①由x、h、d三种元素组成原子数为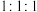 的化合物的电子式为
的化合物的电子式为___________ 。
②g的原子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
(1)硒
 是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为
是一种生命元素,有抗癌、抗衰老等重要功能。硒元素在周期表中的位置为 焙烧
焙烧 的方法提取硒元素,其中
的方法提取硒元素,其中 元素转化为
元素转化为 ,且有
,且有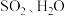 和
和 (固体)生成,该反应的化学方程式为
(固体)生成,该反应的化学方程式为(2)下列说法正确的是___________。
A.热稳定性: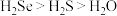 | B.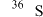 与 与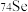 的中子数之和为60 的中子数之和为60 |
C.酸性: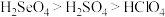 | D.还原性: |
| 周期 | 族 | |||||||
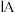 | 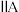 | 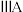 | 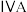 | 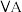 | 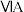 | 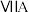 | 0 | |
| 1 | x | |||||||
| 2 | d | |||||||
| 3 | e | f | g | h | ||||
 的化合物的电子式为
的化合物的电子式为②g的原子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 碳酸锰MnCO3是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O >MnO
>MnO >
>
可能用到的数据如下:
根据要求回答下列问题:
(1)基态锰原子的价层电子排布式为_____ ,
(2)在实验室进行步骤A操作时,可能用到的主要仪器为_____ 。
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是_____ 。
(4)步骤G发生的离子方程式为___ ,若Mn2+恰好沉淀完全时测得溶液中CO 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=_____ (mol/L)2。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为_____ 。请写出对应的离子方程式_____ 。

已知:①还原焙烧的主反应为2MnO2+C=2MnO+CO2↑
②氧化能力S2O
 >MnO
>MnO >
>
可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)基态锰原子的价层电子排布式为
(2)在实验室进行步骤A操作时,可能用到的主要仪器为
A.坩埚 B.蒸发皿 C.烧杯
(3)步骤E中调节3.7<pH<8.3,其目的是
(4)步骤G发生的离子方程式为
 的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=
的浓度为2.2×10-6mol•L-1,则Ksp(MnCO3)=(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,S2O
 中存在过氧键(-O-O-),请问S2O
中存在过氧键(-O-O-),请问S2O 中S的化合价为
中S的化合价为
您最近一年使用:0次
23-24高二上·广东深圳·期末
名校
解题方法
4 . 镍及其化合物在工业上有广泛用途,以某地红土镍矿(主要成分NiO、MgO、Al2O3、SiO2和FeO)为原料,采用酸溶法制取 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
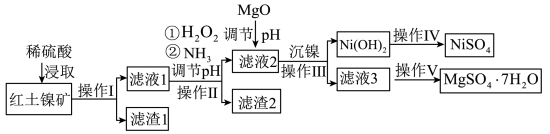
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
回答下列问题:
(1)“滤液1”中加入H2O2的作用是___________ (用离子反应方程式表示)。
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是___________ 。
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中 的浓度为
的浓度为___________ mol/L。
(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为___________ 。
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为___________ ;
②样品中镍元素的质量分数为___________ %(保留3位有效数字);
③以下操作,会使测定结果偏低的有___________ 。
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
 和MgSO4·7H2O,工业流程如图所示:
和MgSO4·7H2O,工业流程如图所示:
已知:①常温下,NiSO4易溶于水,Ni(OH)2和NiOOH不溶于水。
②在上述流程中,某些金属离子开始沉淀和沉淀完全时的pH如下:
| 沉淀物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀时的pH | 7.1 | 7.6 | 2.7 | 3.4 | 9.2 |
| 沉淀完全(c<10-5mol/L)时的pH | 9.0 | 9.6 | 3.2 | 4.7 | 11.1 |
(1)“滤液1”中加入H2O2的作用是
(2)操作II为达到实验目的,由表中的数据判断通入NH3调节溶液pH的范围是
(3)Ksp[Ni(OH)2]=1.0×10-15,“沉镍”中pH调为8.5,则滤液中
 的浓度为
的浓度为(4)工业上使用Ni(OH)2在碱性溶液中电解,在电解池的阳极可制得电极材料NiOOH,该电极反应方程式为
(5)用滴定法测定NiSO4产品中镍元素含量。取5.90g样品,酸溶后配成100mL溶液,取20.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.100mol∙L-1的Na2H2Y标准液滴定,重复操作2~3次,消耗Na2H2Y标准液平均值为12.00mL。
已知:i.Ni2++H2Y2-=[NiY]2-+2H+;
ii.紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
①滴定终点的颜色变化为
②样品中镍元素的质量分数为
③以下操作,会使测定结果偏低的有
A.滴定终点读数时,俯视滴定管刻度
B.盛装Na2H2Y标准液的滴定管未润洗
C.滴定前,发现装有滴定管尖嘴处有一个气泡,滴定后,气泡消失
D.滴定终点读数后,发现尖嘴处悬挂了一滴溶液
您最近一年使用:0次
名校
解题方法
5 . 运动会上的发令枪所用“火药”的主要成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式(未配平): ,则下列有关叙述错误的是
,则下列有关叙述错误的是
 ,则下列有关叙述错误的是
,则下列有关叙述错误的是A.该反应属于氧化还原反应,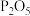 为氧化反应的产物 为氧化反应的产物 |
| B.该反应中n(氧化剂):n(还原剂)=6:5 |
| C.该反应中消耗2molP时,转移10mol电子 |
D.白烟是由于剧烈反应生成的白色固体小颗粒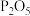 和KCl化合价 和KCl化合价 |
您最近一年使用:0次
名校
解题方法
6 .  是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
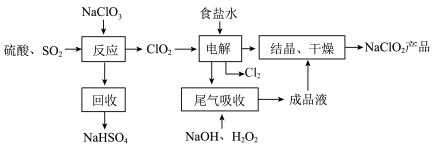
回答下列问题:
(1) 中
中 的化合价为
的化合价为___________ 。
(2)写出“反应”步骤中生成 的化学方程式
的化学方程式___________ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 ,要加入的试剂为
,要加入的试剂为___________ ,“电解”中还原产物是___________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为___________ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)写出“反应”步骤中生成
 的化学方程式
的化学方程式(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去
 ,要加入的试剂为
,要加入的试剂为(4)“尾气吸收”是吸收“电解”过程排出的少量
 。此吸收反应中氧化剂与还原剂的物质的量之比为
。此吸收反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
7 . 某小组在探究 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。
资料:i.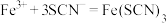 (红色),
(红色), 中
中 元素的化合价为
元素的化合价为 价
价
ii. 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了 的
的___________ 性,补全 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:___________ 。

(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是___________ 。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
分析上述三个实验,下列叙述不正确的是___________(填字母)。
(4)验证 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:___________ 。
 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。| 实验Ⅰ | 现象 |
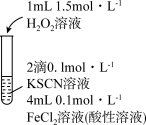 | 溶液变红,片刻红色褪去,有气体生成(经检验为 )。 )。 |
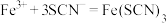 (红色),
(红色), 中
中 元素的化合价为
元素的化合价为 价
价ii.
 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀(1)实验Ⅰ体现了
 的
的 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
| 实验Ⅲ | 现象 |
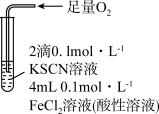 | 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和 溶液 溶液 | 无白色沉淀产生。 |
A.实验Ⅲ中发生了氧化还原反应: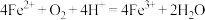 |
B.通过实验Ⅲ推出实验Ⅰ中氧化 的只有 的只有 |
C. 在该实验条件下不能使红色溶液褪色 在该实验条件下不能使红色溶液褪色 |
D.实验Ⅰ中红色褪去与 的氧化性有关 的氧化性有关 |
(4)验证
 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:
您最近一年使用:0次
名校
解题方法
8 . 某废旧金属材料中主要含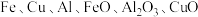 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收 、
、 、绿矾等。
、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去___________ 。
(2)“碱浸”时发生反应的化学方程式为___________ 。
(3)操作I、II中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是___________ 。
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为___________ 。
(5)①滤液II中可能含有因氧气的作用而产生少量杂质离子,该反应的离子方程式为___________ 。
②设计实验检验滤液II中是否含有上述杂质离子采用的试剂为___________ 溶液。
(6)若要定量测定所得绿矾纯度,可通过如下方法:称取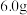 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性溶液,
的酸性溶液, 恰好完全反应时,消耗酸性
恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为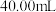 ,则
,则 的纯度为
的纯度为___________ 。(结果保留三位有效数字)已知: (未配平)
(未配平)
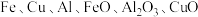 (其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收
(其余成分与酸碱都不反应)和可燃性有机物,为节约和充分利用资源,通过如下工艺流程回收 、
、 、绿矾等。
、绿矾等。
(1)“焙烧”的目的主要是将金属单质转化为氧化物,并除去
(2)“碱浸”时发生反应的化学方程式为
(3)操作I、II中使用的仪器除烧杯、玻璃棒外还需要的玻璃仪器是
(4)第一次酸浸完全后“加入过量试剂a”后发生的化学反应中有一个属于化合反应,其离子方程式为
(5)①滤液II中可能含有因氧气的作用而产生少量杂质离子,该反应的离子方程式为
②设计实验检验滤液II中是否含有上述杂质离子采用的试剂为
(6)若要定量测定所得绿矾纯度,可通过如下方法:称取
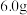 样品用稀硫酸溶解,滴加
样品用稀硫酸溶解,滴加 的酸性溶液,
的酸性溶液, 恰好完全反应时,消耗酸性
恰好完全反应时,消耗酸性 溶液的体积为
溶液的体积为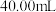 ,则
,则 的纯度为
的纯度为 (未配平)
(未配平)
您最近一年使用:0次
9 . 回答下列问题:
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①_______ ;②_______ ;③_______ 。
(2)HCO 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:_______ 。
(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
(4)等质量的O2和O3所含氧原子个数之比_______ 。
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为_______ 。
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有_______ 个C原子。
(7)请配平下面方程式:_______ 。
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:_______ 。
(1)下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO ②HCl、H2O、H2SO4、HNO3 ③NaOH、Na2CO3、KOH、Cu(OH)2
三种物质依次是(填化学式):①
(2)HCO
 与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO
与H+、OH-在溶液都不能大量共存,试用离子方程式说明HCO 与OH-在溶液不能大量共存的原因:
与OH-在溶液不能大量共存的原因:(3)离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO
 的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。
的摩尔电导率分别为0.60、1.98、0.45。据此可判断,向饱和的澄清石灰水中通入过量的CO2,溶液导电能力随CO2通入量的变化趋势正确的是_______。A.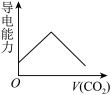 | B.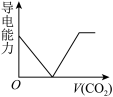 | C. | D.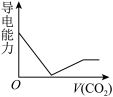 |
(4)等质量的O2和O3所含氧原子个数之比
(5)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为
(6)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体含有
(7)请配平下面方程式:
_______KMnO4 +_______HCl —_______KCl +_______MnCl2 +_______Cl2↑ + _______H2O
(8)用双线桥法表示反应8NH3+3Cl2=6NH4Cl+N2的电子转:
您最近一年使用:0次
名校
解题方法
10 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
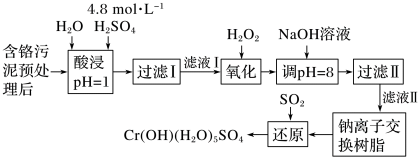
已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有_______ 、_______ 。(答出两点)
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为_______ 。
(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:_______ 。

已知硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O
 ,则此反应中氧化剂和还原剂物质的量之比为
,则此反应中氧化剂和还原剂物质的量之比为(3)上述流程中,加入NaOH溶液后,溶液呈碱性,Cr2O
 转化为CrO
转化为CrO ,写出上述流程中用SO2进行还原时发生反应的离子方程式:
,写出上述流程中用SO2进行还原时发生反应的离子方程式:
您最近一年使用:0次



