名校
解题方法
1 . 一种利用废旧镀锌铁皮制备磁性Fe3O4纳米粒子的工艺流程如图所示,已知锌与铝化学性质相似。下列有关说法不正确的是
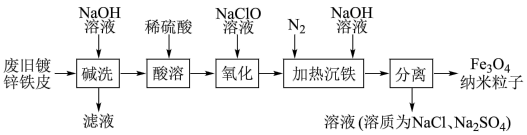

| A.用激光笔照射“加热沉铁”后所得分散系,产生丁达尔效应 |
| B.“氧化”时发生反应的离子方程式为2Fe2++ClO-+2H+=2Fe2++Cl-+H2O |
| C.“氧化”后的溶液中金属阳离子主要有Fe2+、Fe3+、Na+ |
| D.“碱洗”是为了去除废旧镀锌铁皮表面的油污 |
您最近一年使用:0次
名校
2 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
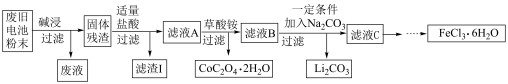
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
266次组卷
|
3卷引用:广东省茂名市七校2023-2024学年高一上学期12月联考化学试题
3 . 饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:
(1)上述反应中,被氧化的元素是___________ ,还原产物是___________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:___________ 。

(3)反应中每生成1个 ,转移
,转移___________ 个电子。
(4)请配平下列离子方程式:___________ 。
___________ ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: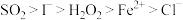 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: 。请回答下列问题:
。请回答下列问题:(1)上述反应中,被氧化的元素是
(2)用“双线桥法”表示反应中电子转移的方向和数目:

(3)反应中每生成1个
 ,转移
,转移(4)请配平下列离子方程式:
___________
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
(5)已知
 、
、 、
、 、
、 、
、 均有还原性,它们在酸性溶液中还原性的强弱顺序为:
均有还原性,它们在酸性溶液中还原性的强弱顺序为: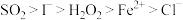 ,则下列反应不能发生的是:___________。
,则下列反应不能发生的是:___________。A.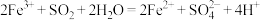 |
B. |
C.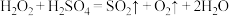 |
D. |
您最近一年使用:0次
名校
4 . 物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。图为钠及其化合物的“价-类”二维图,请回答下列问题:
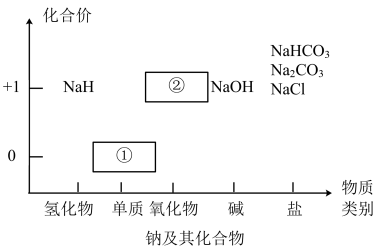
(1)物质①与水反应的离子方程式为___________ ,所以通常将其保存在___________ 中。
(2)写出淡黄色固体②与二氧化碳反应的化学方程式,并用双线桥表示其电子转移方向和数目:___________ 。
(3)从核心元素价态的视角看,NaH中H元素的化合价为___________ ;已知NaH的化学性质与钠单质相似,请写出NaH和水反应的化学方程式___________ 。
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
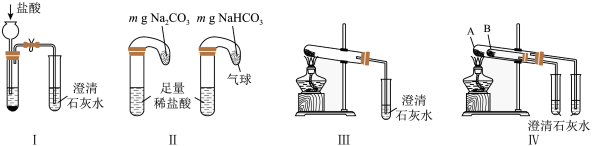
①只根据图I、Ⅱ所示实验,能够达到鉴别目的的是___________ (填装置序号)。
②图Ⅲ、Ⅳ中___________ 能更好说明二者的稳定性(填装置序号)。Ⅳ中A处盛放的物质为:(写化学式)___________ 。

(1)物质①与水反应的离子方程式为
(2)写出淡黄色固体②与二氧化碳反应的化学方程式,并用双线桥表示其电子转移方向和数目:
(3)从核心元素价态的视角看,NaH中H元素的化合价为
(4)纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。

①只根据图I、Ⅱ所示实验,能够达到鉴别目的的是
②图Ⅲ、Ⅳ中
您最近一年使用:0次
5 . 废旧锂离子电池的回收利用意义重大,其正极废料的主要成分是 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:
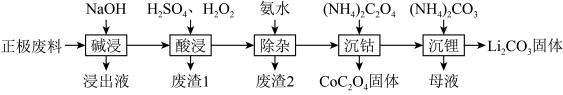
(1)“碱浸”步骤中铝溶解的离子方程式为________ ,“废渣1”的主要成分是_______ 。
(2)已知Li在化合物中显 价,
价, 中Co的化合价为
中Co的化合价为_____ ,“酸浸”步骤中 固体溶解的化学方程式为
固体溶解的化学方程式为_______ ,反应中 的作用为
的作用为_______ 。
(3)“酸浸”后的溶液中含有少量 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是______ 。
(4)沉钴过程发生的反应属于______ (填反应类型)。
(5)“母液”中的溶质成分是_______ ,生成 固体的离子方程式为
固体的离子方程式为________ 。
 、铝、炭黑及其他微量杂质,回收利用的流程如下:
、铝、炭黑及其他微量杂质,回收利用的流程如下:
(1)“碱浸”步骤中铝溶解的离子方程式为
(2)已知Li在化合物中显
 价,
价, 中Co的化合价为
中Co的化合价为 固体溶解的化学方程式为
固体溶解的化学方程式为 的作用为
的作用为(3)“酸浸”后的溶液中含有少量
 、
、 、
、 ,滤渣2的主要成分是
,滤渣2的主要成分是(4)沉钴过程发生的反应属于
(5)“母液”中的溶质成分是
 固体的离子方程式为
固体的离子方程式为
您最近一年使用:0次
名校
解题方法
6 .  具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测
具有还原性,某同学根据氧化还原反应的知识推测 与
与 能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
实验探究:
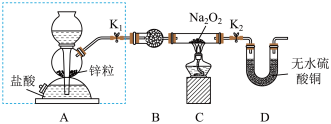
步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开 、
、 ,在产生的氢气流经装有
,在产生的氢气流经装有 的硬质玻璃管的过程中,未观察到明显现象。
的硬质玻璃管的过程中,未观察到明显现象。
步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)写出A装置中发生的反应的离子方程式___________ 。
(2)B装置中所盛放的试剂是___________ ,其作用是___________ 。
(3)步骤3中的必要操作为打开 、
、 ,___________(请按正确的顺序填入下列步骤的字母)。
,___________(请按正确的顺序填入下列步骤的字母)。
(4)由上述实验可推出 与H2反应的化学方程式为
与H2反应的化学方程式为___________ 。
(5)将过氧化钠粉末投入到 溶液中,有关现象说法正确的是___________。
溶液中,有关现象说法正确的是___________。
(6)向酸性 溶液中加入
溶液中加入 粉末。观察到溶液褪色,发生如下反应:
粉末。观察到溶液褪色,发生如下反应:
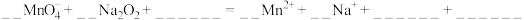
补全方程式并配平___________ ,该反应说明 粉末具有
粉末具有___________ (填“氧化性”、 “还原性”或“漂白性”)。
 具有强氧化性,
具有强氧化性, 具有还原性,某同学根据氧化还原反应的知识推测
具有还原性,某同学根据氧化还原反应的知识推测 与
与 能发生反应。为了验证此推测结果,该同学设计并进行如下实验。
能发生反应。为了验证此推测结果,该同学设计并进行如下实验。实验探究:

步骤1:按如图所示的装置组装仪器(图中夹持仪器已省略)并检查装置的气密性,然后装入药品。
步骤2:打开
 、
、 ,在产生的氢气流经装有
,在产生的氢气流经装有 的硬质玻璃管的过程中,未观察到明显现象。
的硬质玻璃管的过程中,未观察到明显现象。步骤3:进行必要的实验操作,淡黄色的粉末慢慢变成白色固体,无水硫酸铜未变蓝色。
(1)写出A装置中发生的反应的离子方程式
(2)B装置中所盛放的试剂是
(3)步骤3中的必要操作为打开
 、
、 ,___________(请按正确的顺序填入下列步骤的字母)。
,___________(请按正确的顺序填入下列步骤的字母)。A.加热至 逐渐熔化,反应一段时间 逐渐熔化,反应一段时间 | B.用小试管收集气体并检验其纯度 |
C.关闭 | D.停止加热,充分冷却 |
(4)由上述实验可推出
 与H2反应的化学方程式为
与H2反应的化学方程式为(5)将过氧化钠粉末投入到
 溶液中,有关现象说法正确的是___________。
溶液中,有关现象说法正确的是___________。| A.生成红褐色沉淀 | B.没有气体产生 | C.生成白色沉淀 | D.有无色气体产生 |
(6)向酸性
 溶液中加入
溶液中加入 粉末。观察到溶液褪色,发生如下反应:
粉末。观察到溶液褪色,发生如下反应: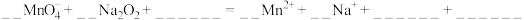
补全方程式并配平
 粉末具有
粉末具有
您最近一年使用:0次
名校
解题方法
7 . 某同学欲探究 的氧化还原性:
的氧化还原性:
资料: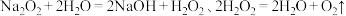
制备 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。
检验 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。
I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为___________ 。
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:
(2)猜想1. 有氧化性,能被还原为
有氧化性,能被还原为
猜想2. 有
有___________ 性,能与 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
iii是ii和i的对照实验。
①X是___________ 。
②a是___________ 、b是___________ 。
③取i中棕褐色固体,实验证明是 。
。
综上所述, 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
 的氧化还原性:
的氧化还原性:资料:
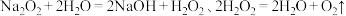
制备
 :将
:将 溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀
溶于冰水中,产生少量气泡,得溶液A。将溶液A分为两份,向其中一份中加入过量稀 ,得溶液B。
,得溶液B。检验
 :向溶液A、B中分别滴加适量
:向溶液A、B中分别滴加适量 溶液。
溶液。I.B中产生气泡,滴入的溶液紫色褪去。
(1)反应的离子方程式为
Ⅱ.A中滴入的溶液紫色褪去,有棕褐色固体生成,产生大量气泡。推测固体可能含
 ,对其产生的原因提出猜想:
,对其产生的原因提出猜想:(2)猜想1.
 有氧化性,能被还原为
有氧化性,能被还原为
猜想2.
 有
有 反应产生
反应产生
猜想3……
(3)探究猜想2的合理性,并分析Ⅰ中没有产生棕褐色固体的原因,设计实验如下:
| 序号 | 实验 | 试剂 | 现象 |
| i |  | a | 生成棕褐色固体,产生大量气泡 |
| ii | b | 有少量气泡 | |
| iii |  溶液 溶液 | 有少量气泡 |
①X是
②a是
③取i中棕褐色固体,实验证明是
 。
。综上所述,
 体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
体现氧化性还是还原性与反应的对象和溶液的酸碱性有关。
您最近一年使用:0次
名校
解题方法
8 . 已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3(加热和夹持装置略去)。
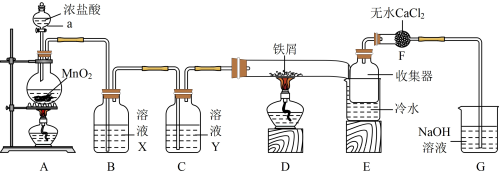
回答下列问题:
(1)装置A发生反应的化学方程式为___________ ,该反应氧化剂还原剂个数比___________ ,电子转移的总数为___________ 。
(2)装置D发生反应的化学方程式为___________ 。
(3)实验结束时,应先熄灭___________ (填“A”或“D”)处酒精灯;E中冷水的作用是___________ 。
(4)装置F的作用是___________ ;装置G发生反应的离子方程式___________ 。

回答下列问题:
(1)装置A发生反应的化学方程式为
(2)装置D发生反应的化学方程式为
(3)实验结束时,应先熄灭
(4)装置F的作用是
您最近一年使用:0次
9 . 部分元素的单质及其化合物(或其溶液)的转化关系如图。已知A是生活中使用广泛的金属单质,常温下B是无色无味的液体,E是胃酸的主要成分。
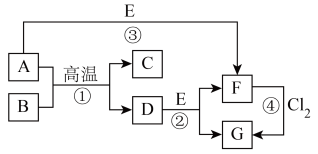
请回答下列问题。
(1)写出下列物质的化学式:E_______ ;G_______ 。
(2)反应①的化学方程式为_______ ;写出C在生产、生活中的一种用途:_______ 。
(3)反应②的离子方程式为_______ 。
(4)F溶液常温下呈浅绿色,该溶液中金属阳离子为_______ (填离子符号),下列实验操作及现象能证明溶液中含有该金属阳离子的是_______ (填标号),反应④中氧化剂和还原剂的物质的量之比为_______ 。
a.取样,加入铜粉,无明显现象
b.取样,滴加 溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色

请回答下列问题。
(1)写出下列物质的化学式:E
(2)反应①的化学方程式为
(3)反应②的离子方程式为
(4)F溶液常温下呈浅绿色,该溶液中金属阳离子为
a.取样,加入铜粉,无明显现象
b.取样,滴加
 溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
溶液,产生白色沉淀,白色沉淀迅速变成灰绿色,最终变成红褐色
您最近一年使用:0次
名校
解题方法
10 . 过氧化氢是重要的化工产品,广泛应用于绿色化学合成,医疗消毒等领域。
(1) 的
的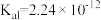 ,
, 的酸性
的酸性___________  (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是___________ 。
(2)早期制备方法:
①II为可逆反应,促进该反应正向进行的措施是___________ 。(写一条)
②Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3) 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。
①电解 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为___________ 。
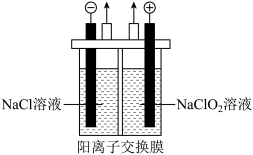
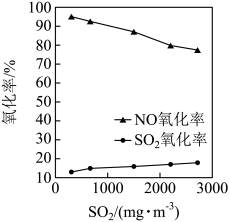
②保持其他条件不变,调节烟气中 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是________ 。
(4)甲醇( )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
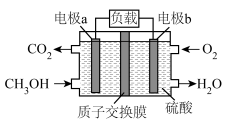
①a电极是电池的___________ (填“正”或“负”)极。
②b电极的电极反应式为___________ 。
(5)现有25℃时等浓度的5种溶液:A. ;B.
;B. ;C.
;C. ;D.
;D.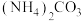 ;E.
;E. ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填字母)。
(1)
 的
的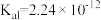 ,
, 的酸性
的酸性 (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是(2)早期制备方法:

①II为可逆反应,促进该反应正向进行的措施是
②Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是(3)
 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。①电解
 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
②保持其他条件不变,调节烟气中
 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是
(4)甲醇(
 )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
①a电极是电池的
②b电极的电极反应式为
(5)现有25℃时等浓度的5种溶液:A.
 ;B.
;B. ;C.
;C. ;D.
;D.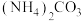 ;E.
;E. ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
您最近一年使用:0次



