1 . 下列有关工业制硫酸的说法正确的是
A.一般以硫磺或黄铁矿(主要成分: )为原料 )为原料 |
B.鼓入足量的空气,原料可直接转化为 |
C.用水吸收 ,可提高吸收效率 ,可提高吸收效率 |
D.含 的废气经回收可用于制备硫酸 的废气经回收可用于制备硫酸 |
您最近一年使用:0次
2024-04-15更新
|
283次组卷
|
3卷引用:选择题1-5
2 . Fe3S4固体是一种重要的磁性材料,以它为原料实现如下化合物的转化: 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。
请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为___________ ,无色酸性溶液F中的含硫阴离子有___________ 。
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式___________ 。
(3)下列说法正确的是___________。
(4)写出F→G反应的化学方程式___________ 。请设计实验方案确定溶液G中的阴离子___________ 。

 的形式存在,溶液呈亮黄色。
的形式存在,溶液呈亮黄色。请回答:
(1)依据B→C→D的现象,判断Cl-、SCN-、CN-与Fe3+的配位能力由强到弱依次为
(2)Fe3S4能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标准状况下的密度为1.518g∙L-1),写出该反应的离子方程式
(3)下列说法正确的是___________。
| A.固体A中可能含有FeO | B.无色气体E能完全溶于水 |
| C.溶液C呈酸性,是由于Fe3+水解 | D.溶液B可溶解铜 |
(4)写出F→G反应的化学方程式
您最近一年使用:0次
解题方法
3 . 根据材料的组成、结构和性能可决定其行为,下列推测不合理 的是
| 材料 | 组成、结构和性能 | 行为 | |
| A | 二氧化硫 | 强还原性 | 漂白剂、消毒剂 |
| B | 本尼迪特试剂 | 柠檬酸钠、碳酸钠、硫酸铜 | 医疗上的尿糖检验 |
| C | 烷烃 | 较高温度下会发生分解 | 制备炭和氢气 |
| D | 氯化镁、硫酸钙 | 能使蛋白质聚沉 | 制作宁溪豆腐 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列实验装置正确且能达到实验目的的是
| A | B | C | D |
|
|
|
|
| 测定H2O2分解的化学反应速率 | 用标准酸溶液测定未知浓度的碱溶液 | 混合乙醇和浓硫酸 | 检验氯化铵受热分解产物 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-24更新
|
221次组卷
|
3卷引用:选择题6-10
5 . 黄铜矿的主要成份为 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。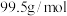 。请回答:
。请回答:
(1)尾气中 经过充分综合利用可以得到石膏,请写出石膏的化学式:
经过充分综合利用可以得到石膏,请写出石膏的化学式:___________ 。
(2)煅烧含硫量高的矿物得到高浓度的 ,干燥的
,干燥的 气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。
气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。
①写出物质A分子的结构式:___________ 。
②一定压强下,化合物A的沸点低于硫酸的原因是___________ 。
(3)生成沉淀D的离子反应方程式___________ 。
(4)请设计实验检验溶液C中的阳离子___________ 。
 ,现有如下转化关系制备有关物质。
,现有如下转化关系制备有关物质。
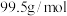 。请回答:
。请回答:(1)尾气中
 经过充分综合利用可以得到石膏,请写出石膏的化学式:
经过充分综合利用可以得到石膏,请写出石膏的化学式:(2)煅烧含硫量高的矿物得到高浓度的
 ,干燥的
,干燥的 气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。
气体与氯气在活性炭催化下可生成一种用于有机合成的常见物质A,该物质水解时发生非氧化还原反应得到两种强酸。①写出物质A分子的结构式:
②一定压强下,化合物A的沸点低于硫酸的原因是
(3)生成沉淀D的离子反应方程式
(4)请设计实验检验溶液C中的阳离子
您最近一年使用:0次
解题方法
6 . 探究硫元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 将硫黄与浓KOH溶液共热,待固体消失后,加入足量稀硫酸 | 溶液变浑浊 | 说明硫黄与碱反应生成硫化物和硫酸盐 |
| B | 测定均为离子化合物的 和 和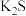 的熔点 的熔点 |  的熔点更高 的熔点更高 | 说明 中离子键强于 中离子键强于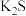 |
| C | 向溶有 的 的 溶液中加入 溶液中加入 溶液 溶液 | 产生白色沉淀 | 说明 可将 可将 氧化 氧化 |
| D | 将某固体溶于水,取上层清液,先滴加足量稀盐酸再滴加氯化钡溶液 | 滴加稀盐酸无明显现象,滴加氯化钡后产生白色沉淀 | 说明该固体中含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
7 . 已知A、B、C、D、E是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素,B的价电子层中有3个未成对电子,C的最外层电子数是其内层电子数的3倍,D与C同族,E元素原子最外层只有一个电子,其余轨道全部充满。下列说法正确的是。
| A.氢化物的稳定性:B<C |
| B.元素电负性:C>B>D>A |
| C.A、B、C三种元素形成的化合物一定显酸性 |
| D.D和E的单质混合加热生成ED |
您最近一年使用:0次
8 . 下列反应的离子方程式正确的是
A.碘化亚铁溶液与等物质的量的氯气: |
B.向次氯酸钙溶液通入足量二氧化碳: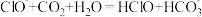 |
C.铜与稀硝酸: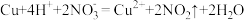 |
D.向硫化钠溶液通入足量二氧化硫: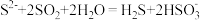 |
您最近一年使用:0次
2023-06-21更新
|
12261次组卷
|
22卷引用:2023年高考浙江卷化学真题(6月)变式题(选择题6-10)
(已下线)2023年高考浙江卷化学真题(6月)变式题(选择题6-10)2023年高考浙江卷化学真题(6月)(已下线)专题04 离子反应(已下线)专题04 离子反应(已下线)第2讲 离子反应和离子方程式(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 离子方程式与离子共存-2023年高考化学真题题源解密(新高考专用)(已下线)专题12 水溶液中的离子反应与平衡-2023年高考化学真题题源解密(全国通用)(已下线)选择题1-5吉林省长春外国语学校2023-2024学年高三上学期开学考试化学试题河南省南阳市第一中学校2023-2024学年高三上学期开学考试化学试题安徽省淮南第二中学2024届高三上学期第四次段考化学试题福建省福州第四中学2023-2024学年高三上学期期中考试化学试题山东省烟台市莱州市第一中学2023-2024学年高一上学期1月月考化学试题北京市中国人民大学附属中学2023-2024学年高三下学期开学考试化学试题(已下线)5.2.3硝酸和酸雨的防治课后作业提高篇江西省宜春市百树学校2023-2024学年高三上学期暑期阶段测试化学试卷天津市耀华中学2023-2024学年高三下学期开学验收考化学试卷四川省内江市第六中学2023-2024学年高三下学期入学考试理综试题-高中化学四川省眉山市仁寿第一中学校(北校区)2023-2024学年高一下学期3月月考化学试题北京市第二中学2023-2024学年高三下学期三模化学试题北京市第二中学2023-2024学年高三下学期模拟测试化学试题
名校
解题方法
9 . 氧化亚铜(Cu2O)是一种难溶于水和乙醇的砖红色固体,在酸性溶液中歧化为二价铜和铜单质。某小组制备Cu2O并测定其纯度,回答下列问题:
I.制备Cu2O
将新制Na2SO3溶液和CuSO4溶液按一定量混合,加热至90°C并不断搅拌。反应结束后,经过滤、洗涤、干燥得到Cu2O粉末。制备装置如图所示:
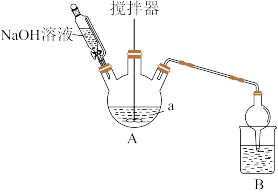
(1)仪器a的名称是_______ ;反应适宜采用的加热方式为_______ 。
(2)制备Cu2O时,原料理论配比为n(Na2SO3):n(CuSO4)=3:2,该反应的化学方程式为_______ ; B装置的作用是吸收反应产生的酸性气体,防止污染环境,B中选用的试剂可能是_______ (填名称)。
(3)反应中需不断滴加NaOH溶液,原因是_______ 。
(4)过滤后,将滤渣依次用蒸馏水、无水乙醇洗涤数次,判断沉淀是否洗净的实验操作是_______ 。
Ⅱ.测定Cu2O纯度
称取m g样品置于烧杯中,加入足量FeCl3溶液,完全溶解后,加入4滴邻菲罗啉指示剂,然后用c mol·L-1硫酸高铈[Ce(SO4)2]溶液进行滴定至终点,共消耗Ce(SO4)2溶液VmL。(已知:Ce4++Fe2+ =Ce3++Fe3+)
(5)加入FeCl3溶液时发生反应的离子方程式为_______ 。
(6)该样品中Cu2O的纯度为_______ %。
I.制备Cu2O
将新制Na2SO3溶液和CuSO4溶液按一定量混合,加热至90°C并不断搅拌。反应结束后,经过滤、洗涤、干燥得到Cu2O粉末。制备装置如图所示:

(1)仪器a的名称是
(2)制备Cu2O时,原料理论配比为n(Na2SO3):n(CuSO4)=3:2,该反应的化学方程式为
(3)反应中需不断滴加NaOH溶液,原因是
(4)过滤后,将滤渣依次用蒸馏水、无水乙醇洗涤数次,判断沉淀是否洗净的实验操作是
Ⅱ.测定Cu2O纯度
称取m g样品置于烧杯中,加入足量FeCl3溶液,完全溶解后,加入4滴邻菲罗啉指示剂,然后用c mol·L-1硫酸高铈[Ce(SO4)2]溶液进行滴定至终点,共消耗Ce(SO4)2溶液VmL。(已知:Ce4++Fe2+ =Ce3++Fe3+)
(5)加入FeCl3溶液时发生反应的离子方程式为
(6)该样品中Cu2O的纯度为
您最近一年使用:0次
名校
解题方法
10 . 连二硫酸锰(MnS2O6,其中Mn为+2价)是一种常用的果蔬保鲜剂,易溶于水,室温下其水溶液在pH为2.8~3.5时最稳定。回答下列问题:
[探究一]制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。
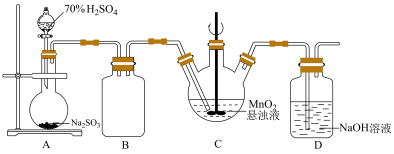
(1)装置A中装有70%H2SO4的仪器名称为_______ ,装置B的作用是_______ 。
(2)装置C中的反应温度需要控制在0°C左右,控制温度的方法是_______ ,实验时需要向C中通入稍过量的SO2,目的是_______ 。
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为_______ ,判断反应完成的现象是_______ ,待反应结束后经除杂、减压蒸发浓缩、结晶可得产品MnS2O6·nH2O。
[探究二]测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol·L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)若多次滴定平均消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为_______ 。
(5)下列操作会使得测定结果偏大的是_______。
[探究一]制备连二硫酸锰(MnS2O6)
某化学小组利用MnO2悬浊液吸收SO2气体制取连二硫酸锰的装置(部分夹持、加热仪器已省略)如图所示。

(1)装置A中装有70%H2SO4的仪器名称为
(2)装置C中的反应温度需要控制在0°C左右,控制温度的方法是
(3)装置C中反应生成等物质的量的MnS2O6和MnSO4,则反应的化学方程式为
[探究二]测定产品中Mn的质量分数
称取ag产品充分加热使其分解为MnSO4,然后加水溶解,用cmol·L-1的KMnO4溶液进行滴定(Mn元素均转化为MnO2)。
(4)若多次滴定平均消耗KMnO4溶液的体积为VmL,则产品中Mn的质量分数为
(5)下列操作会使得测定结果偏大的是_______。
| A.滴定前锥形瓶用蒸馏水洗后未用待测MnSO4溶液润洗 |
| B.滴定前滴定管中尖嘴处有气泡,滴定后气泡消失 |
| C.滴定前平视读数,滴定结束俯视读数 |
| D.对连二硫酸锰产品进行加热操作时加热不充分 |
您最近一年使用:0次
2023-05-25更新
|
466次组卷
|
4卷引用:2019年高考浙江卷化学试题变式题(实验题)
(已下线)2019年高考浙江卷化学试题变式题(实验题)(已下线)物质含量的测定四川省凉山彝族自治州2023届高三下学期第三次诊断性检测理综化学试题四川省宜宾市第四中学校2023-2024学年高三上学期开学理综化学试题







