1 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式___________ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的 气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是___________ (用文字表述,任写一条合理途径)。
(3)某同学将足量的 通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
(4)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为___________ 。
②如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液___________ 、过滤洗涤、干燥等步骤。

(5)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油 (
(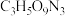 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为___________ ;
②实验室制备硝化甘油的化学方程式为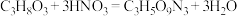 ,用足量浓硝酸、浓硫酸和
,用足量浓硝酸、浓硫酸和 mL
mL  g/cm
g/cm 甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为___________ 。

③反应得到16g硝化甘油,则产率为___________ (保留整数)。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的
 气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是(3)某同学将足量的
 通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。
通入一支装有氯化钡溶液的试管,未见沉淀生成。若向该试管中加入足量___________(填序号),能产生白色沉淀。| A.硝酸钾溶液 | B.稀盐酸 | C.氨水 | D.硫化钠溶液 |
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(5)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(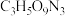 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸)。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
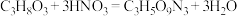 ,用足量浓硝酸、浓硫酸和
,用足量浓硝酸、浓硫酸和 mL
mL  g/cm
g/cm 甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。该装置中仪器a名称为
③反应得到16g硝化甘油,则产率为
您最近一年使用:0次
名校
解题方法
2 . (Ⅰ)非金属元素在生活、生产中扮演着非常重要的角色。请根据题意填空。
(1)木棍放在浓硫酸中变黑,体现了浓硫酸的_______ (填“脱水性”或“氧化性”)。
(2)已知玻璃中的成分有 ,实验室盛放碱溶液的试剂瓶应使用
,实验室盛放碱溶液的试剂瓶应使用_______ (填“玻璃塞”或“橡胶塞”)的试剂瓶。
(3) 可与水反应,请写出该反应的离子方程式:
可与水反应,请写出该反应的离子方程式:__________________ 。
(Ⅱ)化学与人类生活、生产密切相关。请根据题意填空。
(4)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应: 。在此反应中,氧化剂为
。在此反应中,氧化剂为_______________ (填化学式),当该反应转移3mol电子时,产生气体的体积为________________ L(标准状况下)。
(5)湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、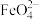 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
(1)木棍放在浓硫酸中变黑,体现了浓硫酸的
(2)已知玻璃中的成分有
 ,实验室盛放碱溶液的试剂瓶应使用
,实验室盛放碱溶液的试剂瓶应使用(3)
 可与水反应,请写出该反应的离子方程式:
可与水反应,请写出该反应的离子方程式:(Ⅱ)化学与人类生活、生产密切相关。请根据题意填空。
(4)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应:
 。在此反应中,氧化剂为
。在此反应中,氧化剂为(5)湿法制备高铁酸钾(
 )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、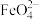 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
您最近一年使用:0次
2023-05-08更新
|
246次组卷
|
2卷引用:广西柳州地区民族高级中学2022-2023学年高一下学期期中考试化学试题
解题方法
3 . 人体吸入 会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
(1) 具有氧化性,
具有氧化性, 与
与 反应会生成淡黄色沉淀,写出反应的化学方程式:
反应会生成淡黄色沉淀,写出反应的化学方程式:_______ 。
(2) 可以使品红溶液褪色,说明二氧化硫具有
可以使品红溶液褪色,说明二氧化硫具有_______ 性。
(3)石灰石——石膏法。该工艺原理利用石灰石加水制成的浆液( )作为吸收剂,吸收二氧化硫,并生成
)作为吸收剂,吸收二氧化硫,并生成 。再向其中通入烟气氧化生成
。再向其中通入烟气氧化生成 ,写出该工艺中生成
,写出该工艺中生成 的化学方程式:
的化学方程式:_______ 。
(4)近年来,有人提出了一种利用电解饱和氯化钠溶液循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:
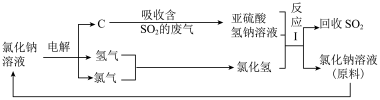
①此种方法中,可以循环利用的物质是_______ (填化学式)。
②写出电解饱和氯化钠溶液的化学方程式:_______ 。
③写出反应I的离子方程式:_______ 。
 会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:
会破坏某些酶的活性,使人体的代谢发生紊乱。为了减少危害,人们进行了许多探索和研究,并且在实际应用中取得了一定的成果。回答下列问题:(1)
 具有氧化性,
具有氧化性, 与
与 反应会生成淡黄色沉淀,写出反应的化学方程式:
反应会生成淡黄色沉淀,写出反应的化学方程式:(2)
 可以使品红溶液褪色,说明二氧化硫具有
可以使品红溶液褪色,说明二氧化硫具有(3)石灰石——石膏法。该工艺原理利用石灰石加水制成的浆液(
 )作为吸收剂,吸收二氧化硫,并生成
)作为吸收剂,吸收二氧化硫,并生成 。再向其中通入烟气氧化生成
。再向其中通入烟气氧化生成 ,写出该工艺中生成
,写出该工艺中生成 的化学方程式:
的化学方程式:(4)近年来,有人提出了一种利用电解饱和氯化钠溶液循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法的流程如下:

①此种方法中,可以循环利用的物质是
②写出电解饱和氯化钠溶液的化学方程式:
③写出反应I的离子方程式:
您最近一年使用:0次
名校
解题方法
4 . 认识含硫物质的性质及转化规律,能帮助我们更好地认识自然和保护环境。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
随着时间的推移,pH逐渐变小的原因是_______ (用化学方程式表示)。
(2)从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:_______ 。
(3)从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式_______ 。另外,其还原性可使酸性高锰酸钾溶液褪色,写出对应的离子方程式_______ 。
(4)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量氯水,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是_______ 。
②空气样品中SO2的体积分数为_______ 。
(1)酸雨的形成原因。将SO2气体通入蒸馏水中,取出部分溶液并用pH计测定其pH,每隔10min读数一次,所得数据如下:
| 时间(min) | 0 | 10 | 20 | 30 | 40 |
| pH | 4.95 | 4.94 | 4.86 | 4.85 | 4.85 |
(2)从物质分类角度看,SO2属于酸性氧化物。工业上常用熟石灰将SO2转化为亚硫酸盐,写出所得亚硫酸盐的化学式:
(3)从元素价态看,SO2中S元素为+4价,既具有氧化性,又具有还原性。用生物质热解气(主要成分为CO、CH4、H2)可将SO2在高温下还原成单质硫。写出CO还原SO2反应的化学方程式
(4)获取空气质量信息。某化学小组为了测定空气中SO2的体积分数,做了如下实验:取标准状况下的空气20.00L(含N2、O2、CO2、SO2),缓慢通过足量氯水,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为4.66g。
①检验沉淀是否洗涤干净的方法是
②空气样品中SO2的体积分数为
您最近一年使用:0次
名校
解题方法
5 . 碳、氮、硫的化合物常会导致一些环境问题,科研工作者正在研究用化学方法来消除这些物质对环境的影响。
(1)空气质量预报主要是有关对空气形成污染的颗粒物及污染气体的报告。下列成分中不属于空气质量预报内容的是_______ (填标号)。
a. b.
b. c.
c. d.可吸入颗粒物
d.可吸入颗粒物
(2)酸雨防治是全球性的难题,酸雨形成的示意图如图

①取一份雨水样品,在常温下测定其不同时刻的pH如下表所示。
该雨水样品属于酸雨的依据是_______ ;若该雨水为硫酸型酸雨,则其放置过程中pH发生变化的主要原因是_______ (用化学方程式表示)。
②随着汽车的广泛使用,其尾气排放也成为酸雨形成的重要原因。对汽车尾气处理的一种方法如图所示。当参与反应的NO与 的物质的量之比为2:1时,该过程中总反应的化学方程式为
的物质的量之比为2:1时,该过程中总反应的化学方程式为_______ 。

(3)用 也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为_______ ;当处理4.48L空气(折算成标准状况下,其中NO的体积分数为2%)时,转移电子的物质的量为_______ mol。
(1)空气质量预报主要是有关对空气形成污染的颗粒物及污染气体的报告。下列成分中不属于空气质量预报内容的是
a.
 b.
b. c.
c. d.可吸入颗粒物
d.可吸入颗粒物(2)酸雨防治是全球性的难题,酸雨形成的示意图如图

①取一份雨水样品,在常温下测定其不同时刻的pH如下表所示。
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
②随着汽车的广泛使用,其尾气排放也成为酸雨形成的重要原因。对汽车尾气处理的一种方法如图所示。当参与反应的NO与
 的物质的量之比为2:1时,该过程中总反应的化学方程式为
的物质的量之比为2:1时,该过程中总反应的化学方程式为
(3)用
 也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
您最近一年使用:0次
2022-07-21更新
|
77次组卷
|
4卷引用:广西玉林市2020-2021学年高一上学期期末质量监测化学试题
广西玉林市2020-2021学年高一上学期期末质量监测化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练辽宁省协作校2020-2021学年高一下学期第一次考试化学试题黑龙江省哈尔滨工业大学附属中学2021-2022学年高二下学期期末考试化学试题
名校
解题方法
6 . Ⅰ.回答下列问题:
(1)抗击新冠肺炎过程中有专家建议适当摄入蛋白质和维生素以增强免疫能力。精面粉、鲜鸡蛋、精炼植物油、柠檬汁中,富含蛋白质的是_______ ,富含维生素的是_______ 。
(2)为了改善食物的色、香,味,以及防止食物变质,经常在食物中加入调味剂、防腐剂等食品添加剂。食盐、醋、味精、亚硝酸钠中不属于调味剂的是_______ ,如果违反规定,将一些不能作为食品添加剂的物质当作食品添加剂,或者超量使用食品添加剂,对人体的健康_______ (填“有害”或“无害”)。
(3)目前我国加工碘盐是在食盐中添加KIO3,其化学名称为_______ 。
Ⅱ.改善生态环境、建设美丽家园是全人类共同的呼声。
(4)酸雨是指pH_______ 5.6(填“>”或“<”)的降水;_______ (填“SO2”或“N2”)是形成酸雨的主要气体之一。
(5)水是生命之源,净化水中的细小悬浮颗粒时,常加入_______ (填“食盐”或“明矾”)使其聚集成较大颗粒沉淀而与水分离。
(6)汽车尾气中的CO和NO在催化剂作用下发生反应生成CO2和N2,该反应的化学方程式为_______ 。
(7)“垃圾分类”成为时代新风尚,下列属于可回收标志的是_______ 。(填字母序号)

(1)抗击新冠肺炎过程中有专家建议适当摄入蛋白质和维生素以增强免疫能力。精面粉、鲜鸡蛋、精炼植物油、柠檬汁中,富含蛋白质的是
(2)为了改善食物的色、香,味,以及防止食物变质,经常在食物中加入调味剂、防腐剂等食品添加剂。食盐、醋、味精、亚硝酸钠中不属于调味剂的是
(3)目前我国加工碘盐是在食盐中添加KIO3,其化学名称为
Ⅱ.改善生态环境、建设美丽家园是全人类共同的呼声。
(4)酸雨是指pH
(5)水是生命之源,净化水中的细小悬浮颗粒时,常加入
(6)汽车尾气中的CO和NO在催化剂作用下发生反应生成CO2和N2,该反应的化学方程式为
(7)“垃圾分类”成为时代新风尚,下列属于可回收标志的是

您最近一年使用:0次
解题方法
7 . 某工厂使用的煤中硫的质量分数为0.64%,该工厂每天燃烧这种煤100 t,试计算:
(1)如果煤中的硫全部转化为 ,该厂每天产生
,该厂每天产生 的质量及这些
的质量及这些 在标准状况下的体积
在标准状况下的体积_______________ ;
(2)如果把产生的 全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量
全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量__________________ 。
(1)如果煤中的硫全部转化为
 ,该厂每天产生
,该厂每天产生 的质量及这些
的质量及这些 在标准状况下的体积
在标准状况下的体积(2)如果把产生的
 全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量
全部用来生产硫酸,理论上每年(按365天计)可得到98%的浓硫酸的质量
您最近一年使用:0次
2021-12-02更新
|
941次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高一下学期2月考试化学试题
8 . 综合利用海水可以制备工业溴、纯碱等物质,其流程示意图如下:

(1)请写出海水淡化的两种方法:___________ 、___________ 。
(2)提取溴的过程经过2次用 使“
使“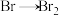 ”,其目的是
”,其目的是___________ ,所发生的离子反应方程式为___________ 。
(3)用 水溶液吸收
水溶液吸收 ,使之转化成
,使之转化成 ,有关反应方程式为
,有关反应方程式为___________ ;从氧化还原角度分析,下列3种物质也能用于吸收 的是
的是___________ (填正确选项序号)。
① ②
② 溶液 ③
溶液 ③ 溶液
溶液
(4)X溶液中的主要阳离子是 和
和___________ (填离子符号)。
(5)在饱和 溶液中先通
溶液中先通 后通
后通 的目的是
的目的是___________ 。
(6)产品纯碱中含有少量碳酸氢钠。若煅烧前固体碳酸氢钠的质量为 ,煅烧后所得纯碱产品的质量为
,煅烧后所得纯碱产品的质量为 。则产品中纯碱的质量分数为
。则产品中纯碱的质量分数为___________ (用含相关字母的代数式表示)。

(1)请写出海水淡化的两种方法:
(2)提取溴的过程经过2次用
 使“
使“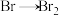 ”,其目的是
”,其目的是(3)用
 水溶液吸收
水溶液吸收 ,使之转化成
,使之转化成 ,有关反应方程式为
,有关反应方程式为 的是
的是①
 ②
② 溶液 ③
溶液 ③ 溶液
溶液(4)X溶液中的主要阳离子是
 和
和(5)在饱和
 溶液中先通
溶液中先通 后通
后通 的目的是
的目的是(6)产品纯碱中含有少量碳酸氢钠。若煅烧前固体碳酸氢钠的质量为
 ,煅烧后所得纯碱产品的质量为
,煅烧后所得纯碱产品的质量为 。则产品中纯碱的质量分数为
。则产品中纯碱的质量分数为
您最近一年使用:0次
名校
9 . 化学与人类生活密切相关。回答下列问题:
(1)食品和药品关系人的生存和健康。
①多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C具有的性质是___ (填字母,下同)。
a.还原性 b.常温下不溶于水 c.溶液显碱性
②纤维素被称为“第七营养素”。食物中含有的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排除有害物质。在对有机物的分类中,纤维素属于___ 。
a.蛋白质 b.脂肪 c.多糖
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①在原子反应堆中广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点___ (选填“高”或“低”)。
②炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会出现红褐色锈斑。我们将这种腐蚀方式称为__ 。
(3)防治环境污染,改善生态环境已成为全球共识。下列物质中,进入大气会形成酸雨的是___ (填序号字母)。
a.碳氧化物 b.硫氧化物 c.氮氧化物
(1)食品和药品关系人的生存和健康。
①多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C具有的性质是
a.还原性 b.常温下不溶于水 c.溶液显碱性
②纤维素被称为“第七营养素”。食物中含有的纤维素虽然不能为人体提供能量,但能促进肠道蠕动、吸附排除有害物质。在对有机物的分类中,纤维素属于
a.蛋白质 b.脂肪 c.多糖
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善我们的生活。
①在原子反应堆中广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其各成分金属的熔点
②炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会出现红褐色锈斑。我们将这种腐蚀方式称为
(3)防治环境污染,改善生态环境已成为全球共识。下列物质中,进入大气会形成酸雨的是
a.碳氧化物 b.硫氧化物 c.氮氧化物
您最近一年使用:0次
2021-06-30更新
|
90次组卷
|
2卷引用:广西岑溪市2020-2021学年高一下学期期末考试化学(文)试题
10 . 化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
(1)在盛放浓硫酸的试剂瓶的标签上印有如图所示警示标志,说明浓硫酸是一种_______ 。

(2)下列有关实验操作和安全事故处理错误的有_______ 。

a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底部由下往上夹住距管口约 处,手持试管夹长柄进行加热
处,手持试管夹长柄进行加热
c.把用氯酸钾制氧气后的残渣倒入垃圾桶
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用如图所示装置吸收氨气
(1)在盛放浓硫酸的试剂瓶的标签上印有如图所示警示标志,说明浓硫酸是一种

(2)下列有关实验操作和安全事故处理错误的有

a.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的瓶中,残破的温度计插入装有硫粉的广口瓶中
b.用试管夹从试管底部由下往上夹住距管口约
 处,手持试管夹长柄进行加热
处,手持试管夹长柄进行加热c.把用氯酸钾制氧气后的残渣倒入垃圾桶
d.给盛有液体的烧瓶加热时,需加碎瓷片或沸石
e.配制硫酸溶液时,在量筒中加入一定体积的水,再边搅拌边慢慢加入浓硫酸
f.用如图所示装置吸收氨气
您最近一年使用:0次



