名校
解题方法
1 . 浓硫酸能使蔗糖、纸屑、棉花等有机物炭化。在浓硫酸使蔗糖炭化实验中,产生了许多气体使炭体积膨胀。且闻到有刺激性气味,某同学猜测气体中可能含有SO2和CO2等,为此,该同学设计了如下实验装置检验气体的成分。
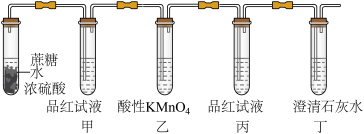
实验时,在试管中先加入适量的蔗糖(C12H22O11),再滴入少量的水,混匀,最后加入一定量的浓硫酸,迅速塞好橡皮塞,振荡试管,将产生的气体通过甲、乙、丙、丁四个洗气瓶。
(1)滴加少量水的目的是为了使反应温度迅速升高,以利于反应进行,写出该试管中产生气体的化学方程式_______ 。该实验中体现的浓硫酸的特性是_______ 。
(2)装置乙中的酸性KMnO4溶液的作用是_______ ,不能用饱和NaHCO3溶液代替酸性KMnO4溶液的理由是_______ 。
(3)产物中含有CO2的实验现象是:_______ ;对应的离子方程式:_______ 。

实验时,在试管中先加入适量的蔗糖(C12H22O11),再滴入少量的水,混匀,最后加入一定量的浓硫酸,迅速塞好橡皮塞,振荡试管,将产生的气体通过甲、乙、丙、丁四个洗气瓶。
(1)滴加少量水的目的是为了使反应温度迅速升高,以利于反应进行,写出该试管中产生气体的化学方程式
(2)装置乙中的酸性KMnO4溶液的作用是
(3)产物中含有CO2的实验现象是:
您最近一年使用:0次
2022-12-21更新
|
170次组卷
|
2卷引用:广西贺州市钟山县钟山中学2020-2021学年高一下学期第二次月考理科化学试题
解题方法
2 . 碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
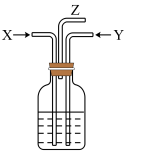

| A.洗气瓶中产生的沉淀是硫酸钡 |
| B.洗气瓶中产生的沉淀是碳酸钡 |
| C.在Z导管出来的气体中没有二氧化碳 |
| D.在Z导管口处无明显现象 |
您最近一年使用:0次
3 . 硫酸亚铁(FeSO4)工业上常用废铁屑和稀硫酸制备。实验室通过如图装置模拟其制备过程。请回答下列问题:
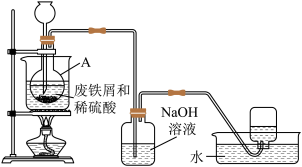
(1)进行实验之前需检查整套装置的_______ 。装置甲中仪器A的名称是_______ 。
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生Fe3+等副产物,因此,采用水浴加热,并使用过量的 将可能产生的Fe3+还原成Fe2+。
将可能产生的Fe3+还原成Fe2+。 还原Fe3+的离子方程式为
还原Fe3+的离子方程式为_______ 。
(3)废铁屑中含有硫化物杂质,故反应中会生成少量的H2S气体。因此,装置乙中NaOH溶液的主要作用是_______ 。

(1)进行实验之前需检查整套装置的
(2)常温下废铁屑和稀硫酸反应较慢,而直接加热时温度过高又可能产生Fe3+等副产物,因此,采用水浴加热,并使用过量的
 将可能产生的Fe3+还原成Fe2+。
将可能产生的Fe3+还原成Fe2+。 还原Fe3+的离子方程式为
还原Fe3+的离子方程式为(3)废铁屑中含有硫化物杂质,故反应中会生成少量的H2S气体。因此,装置乙中NaOH溶液的主要作用是
您最近一年使用:0次
解题方法
4 . 工业上制取硫酸,回收尾气中的废气常选用的试剂是
| A.氨水 | B.NaOH | C.H2SO3 | D.H2SO4 |
您最近一年使用:0次
解题方法
5 . 下列人类行为,会导致环境污染的是
| A.植树造林 | B.循环使用塑料袋 | C.驾驶新能源汽车出行 | D.焚烧麦秆 |
您最近一年使用:0次
解题方法
6 . NaHCO3干法脱硫具有无腐蚀、无废水等特点,常用于除去工业烟气中少量的SO2,为探究不同温度下烟气的脱硫效果,设计如图装置(省略夹持装置)进行模拟实验。

回答下列问题。
(1)实验开始前,先检查装置的_______ 。II中添加的SiO2使NaHCO3分散,从而_______ (填“增大”或“减小”)反应物接触面,提高脱硫效果。
(2)通入由SO2、N2组成的模拟烟气,待气流稳定后,点燃II处酒精灯,缓慢升温。当II中脱硫温度低于270℃时,反应为2NaHCO3 + SO2 Na2SO3 + 2CO2 + H2O;高于270℃时,NaHCO3完全分解为Na2CO3,由于NaHCO3的碱性比Na2CO3的
Na2SO3 + 2CO2 + H2O;高于270℃时,NaHCO3完全分解为Na2CO3,由于NaHCO3的碱性比Na2CO3的_______ (填“强”或“弱”),因而其脱硫效果更好,Na2CO3脱硫反应的方程式为_______ 。
(3)装置IV的作用是吸收体系中的残余SO2,可选用的试剂有_______(填标号)。
(4)保持II中反应温度为300℃不变,待气流完全稳定时,从SO2检测器读数并进行换算,得出I和III中SO2的浓度依次为c1、c2,用c1、c2表示的脱硫率计算式为_______ 。

回答下列问题。
(1)实验开始前,先检查装置的
(2)通入由SO2、N2组成的模拟烟气,待气流稳定后,点燃II处酒精灯,缓慢升温。当II中脱硫温度低于270℃时,反应为2NaHCO3 + SO2
 Na2SO3 + 2CO2 + H2O;高于270℃时,NaHCO3完全分解为Na2CO3,由于NaHCO3的碱性比Na2CO3的
Na2SO3 + 2CO2 + H2O;高于270℃时,NaHCO3完全分解为Na2CO3,由于NaHCO3的碱性比Na2CO3的(3)装置IV的作用是吸收体系中的残余SO2,可选用的试剂有_______(填标号)。
| A.NaOH溶液 | B.浓硫酸 | C.酸性KMnO4溶液 | D.盐酸 |
您最近一年使用:0次
7 . 下列离子方程式中,属于水解反应的是
A.CH3COOH+H2O CH3COO-+H3O+ CH3COO-+H3O+ | B.SO2+H2O  +H+ +H+ |
C. +OH- +OH-  +H2O +H2O | D. +H2O +H2O NH3·H2O+H+ NH3·H2O+H+ |
您最近一年使用:0次
2022-09-19更新
|
101次组卷
|
2卷引用:广西梧州市藤县第六中学2021-2022学年高二上学期期中考试化学试题
解题方法
8 . 氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:

已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)= 2×10-7,2Cu+= Cu+Cu2+的平衡常数K1= 1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有_______ (填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98% H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______ 。“酸浸”时硫酸不宜过多的原因是_______ 。
(3)加热“蒸氨”在减压条件下进行的原因是_______ 。
(4)X 可以充分利用流程中的产物,若X 是SO2时,通入CuCl2溶液中反应的离子方程式是_______ ;若X 是Cu时,反应Cu+Cu2++2Cl-= 2CuCl 的平衡常数K2=_______ 。
(5)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式_______ 。

已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)= 2×10-7,2Cu+= Cu+Cu2+的平衡常数K1= 1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有
(2)“酸浸”所需H2SO4是用等体积的98% H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有
(3)加热“蒸氨”在减压条件下进行的原因是
(4)X 可以充分利用流程中的产物,若X 是SO2时,通入CuCl2溶液中反应的离子方程式是
(5)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式
您最近一年使用:0次
名校
解题方法
9 . 碳、氮、硫的化合物常会导致一些环境问题,科研工作者正在研究用化学方法来消除这些物质对环境的影响。
(1)空气质量预报主要是有关对空气形成污染的颗粒物及污染气体的报告。下列成分中不属于空气质量预报内容的是_______ (填标号)。
a. b.
b. c.
c. d.可吸入颗粒物
d.可吸入颗粒物
(2)酸雨防治是全球性的难题,酸雨形成的示意图如图

①取一份雨水样品,在常温下测定其不同时刻的pH如下表所示。
该雨水样品属于酸雨的依据是_______ ;若该雨水为硫酸型酸雨,则其放置过程中pH发生变化的主要原因是_______ (用化学方程式表示)。
②随着汽车的广泛使用,其尾气排放也成为酸雨形成的重要原因。对汽车尾气处理的一种方法如图所示。当参与反应的NO与 的物质的量之比为2:1时,该过程中总反应的化学方程式为
的物质的量之比为2:1时,该过程中总反应的化学方程式为_______ 。

(3)用 也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为_______ ;当处理4.48L空气(折算成标准状况下,其中NO的体积分数为2%)时,转移电子的物质的量为_______ mol。
(1)空气质量预报主要是有关对空气形成污染的颗粒物及污染气体的报告。下列成分中不属于空气质量预报内容的是
a.
 b.
b. c.
c. d.可吸入颗粒物
d.可吸入颗粒物(2)酸雨防治是全球性的难题,酸雨形成的示意图如图

①取一份雨水样品,在常温下测定其不同时刻的pH如下表所示。
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
②随着汽车的广泛使用,其尾气排放也成为酸雨形成的重要原因。对汽车尾气处理的一种方法如图所示。当参与反应的NO与
 的物质的量之比为2:1时,该过程中总反应的化学方程式为
的物质的量之比为2:1时,该过程中总反应的化学方程式为
(3)用
 也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
也可除去汽车尾气中的氮氧化物(NO),生成两种参与大气循环的无毒物质,则发生反应的化学方程式为
您最近一年使用:0次
2022-07-21更新
|
76次组卷
|
4卷引用:广西玉林市2020-2021学年高一上学期期末质量监测化学试题
广西玉林市2020-2021学年高一上学期期末质量监测化学试题(已下线)专题06 非金属及其化合物-备战2021届高考化学二轮复习题型专练辽宁省协作校2020-2021学年高一下学期第一次考试化学试题黑龙江省哈尔滨工业大学附属中学2021-2022学年高二下学期期末考试化学试题
10 . 某无色透明溶液可能含有Na+、Fe3+、Ca2+、SO 、CO
、CO 、Cl-、NO
、Cl-、NO 中几种,现进行如下实验:
中几种,现进行如下实验:
①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀盐酸,有部分沉淀溶解。
③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:
(1)该溶液中肯定没有_______ ,可能有_______ ,肯定有_______ (填离子符号)。
(2)写出步骤②的离子方程式_______ 。
 、CO
、CO 、Cl-、NO
、Cl-、NO 中几种,现进行如下实验:
中几种,现进行如下实验:①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀盐酸,有部分沉淀溶解。
③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
试判断:
(1)该溶液中肯定没有
(2)写出步骤②的离子方程式
您最近一年使用:0次



