名校
1 . 某课外活动小组用如下图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
(1)装置F中发生反应的离子方程式是________ 。
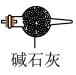
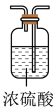
(2)装置A中的烧瓶内固体可选用______(选填以下选项的代号)。
(3)虚线框内应添加必要的除杂装置,请从下图备选装置中选择,并将编号填入下列横线上,B:______ 、D:_____ 、E:____ 。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为________ ;装置C内出现浓厚的白烟并在容器内壁凝结,现欲设计一个实验方案鉴定该固体含 ,请完成下列实验操作:取少量固体于试管中,加适量蒸馏水,振荡使之完全溶解,
,请完成下列实验操作:取少量固体于试管中,加适量蒸馏水,振荡使之完全溶解,_______ 。
(5)若从装置C中G处逸出的尾气中含有 和少量
和少量 ,为防止其污染环境,可将尾气通过盛有
,为防止其污染环境,可将尾气通过盛有_____ 溶液的洗气瓶。

(1)装置F中发生反应的离子方程式是
(2)装置A中的烧瓶内固体可选用______(选填以下选项的代号)。
| A.碱石灰 | B.浓硫酸 | C.生石灰 | D.五氧化二磷 |
(3)虚线框内应添加必要的除杂装置,请从下图备选装置中选择,并将编号填入下列横线上,B:
| 备选装置 | ||
|
|
|
| Ⅰ | Ⅱ | Ⅲ |
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为
 ,请完成下列实验操作:取少量固体于试管中,加适量蒸馏水,振荡使之完全溶解,
,请完成下列实验操作:取少量固体于试管中,加适量蒸馏水,振荡使之完全溶解,(5)若从装置C中G处逸出的尾气中含有
 和少量
和少量 ,为防止其污染环境,可将尾气通过盛有
,为防止其污染环境,可将尾气通过盛有
您最近一年使用:0次
名校
2 . A、B、C、D、E为原子序数依次增大的五种短周期主族元素,A的核外电子总数与其周期序数相同;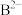 和
和 具有相同的电子构型;D、E为同周期元素,D的核外电子总数是其最外层电子数的3倍,E元素原子最外层有一个未成对电子。回答下列问题:
具有相同的电子构型;D、E为同周期元素,D的核外电子总数是其最外层电子数的3倍,E元素原子最外层有一个未成对电子。回答下列问题:
(1)酸性: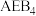
________ (填“>”“<”或“=”)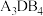 ,原因为
,原因为________ 。
(2)A和B可以形成一种含 的物质,该物质为
的物质,该物质为________ (填化学式),也可以形成一种含 的阳离子,该阳离子的电子式为
的阳离子,该阳离子的电子式为________ 。
(3)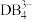 的空间结构为
的空间结构为________ 。
(4)实验室制取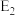 时,常用CBA溶液来吸收多余的
时,常用CBA溶液来吸收多余的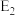 ,实验室制
,实验室制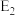 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(5)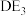 遇水可发生剧烈反应,生成大量酸性气体和D(显+3价)的含氧酸,则
遇水可发生剧烈反应,生成大量酸性气体和D(显+3价)的含氧酸,则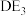 与水发生反应的化学方程式为
与水发生反应的化学方程式为________ 。
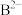 和
和 具有相同的电子构型;D、E为同周期元素,D的核外电子总数是其最外层电子数的3倍,E元素原子最外层有一个未成对电子。回答下列问题:
具有相同的电子构型;D、E为同周期元素,D的核外电子总数是其最外层电子数的3倍,E元素原子最外层有一个未成对电子。回答下列问题:(1)酸性:
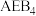
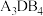 ,原因为
,原因为(2)A和B可以形成一种含
 的物质,该物质为
的物质,该物质为 的阳离子,该阳离子的电子式为
的阳离子,该阳离子的电子式为(3)
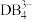 的空间结构为
的空间结构为(4)实验室制取
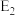 时,常用CBA溶液来吸收多余的
时,常用CBA溶液来吸收多余的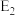 ,实验室制
,实验室制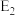 发生反应的化学方程式为
发生反应的化学方程式为(5)
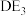 遇水可发生剧烈反应,生成大量酸性气体和D(显+3价)的含氧酸,则
遇水可发生剧烈反应,生成大量酸性气体和D(显+3价)的含氧酸,则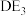 与水发生反应的化学方程式为
与水发生反应的化学方程式为
您最近一年使用:0次
2024-06-01更新
|
23次组卷
|
2卷引用:广东省部分学校2023-2024学年高二下学期期中联考化学试题
名校
解题方法
3 .  是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:_______ 。
(2)仪器 的名称为
的名称为_______ 。
(3)实验前,应先检查装置的气密性,检查的方法为_______ 。
(4)装置Ⅰ中发生反应的化学方程式为_______ 。
(5)用电子式表示 的形成过程:
的形成过程:_______ 。
(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ. 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。
① 属于
属于_______ (填“离子”或“共价”)化合物。
②该小组乙同学认为猜想ⅰ错误,判断的理由为_______ 。
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为_______ (用离子方程式表示)。
 是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题:
是重要的化工原料,某校化学实验兴趣小组同学利用如图所示装置(夹持装置已略去)进行氨气的制备实验。回答下列问题: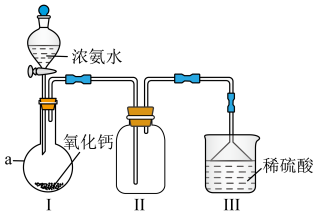
(2)仪器
 的名称为
的名称为(3)实验前,应先检查装置的气密性,检查的方法为
(4)装置Ⅰ中发生反应的化学方程式为
(5)用电子式表示
 的形成过程:
的形成过程:(6)实验结束后,该兴趣小组甲同学对装置Ⅲ烧杯中所含物质的主要成分(不考虑溶剂)提出猜想:
ⅰ.
 和
和 ;ⅱ.
;ⅱ. 和
和 ;ⅲ.
;ⅲ. 。
。①
 属于
属于②该小组乙同学认为猜想ⅰ错误,判断的理由为
③乙同学认为分别向猜想ⅱ和ⅲ的溶液中滴加紫色石蕊溶液,可通过观察实验现象来区分ⅱⅲ.该兴趣小组丙同学认为不可以,原因为
您最近一年使用:0次
2024-05-24更新
|
60次组卷
|
2卷引用:广东省部分学校2023-2024学年高二下学期期中联考化学试题
名校
4 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4___________ 。
(2)装置长颈漏斗的作用___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________ 。
Ⅰ.实验室制备N2H4

(2)装置长颈漏斗的作用
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
名校
5 .  .在生活中亚硝酸钠(
.在生活中亚硝酸钠( )应用十分广泛,它是一种白色固体,外观与
)应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: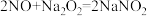 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
(1)盛放浓硝酸的仪器名称为___________ ;仪器按气流方向连接顺序为b→g→___________ (装置可重复使用)。
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质___________ (填化学式);反应结束后打开止水夹a,继续通入过量氮气,其目的是___________ 。
(3)盛水的洗气瓶中发生的反应的化方程式为___________ ;为了提高产率,可在该洗气瓶中加入铜片,请用化学反应方程式解释加入铜片的作用___________ 。
 .利用氨气与次氯酸钠反应制备
.利用氨气与次氯酸钠反应制备 ,其制备装置如图所示。
,其制备装置如图所示。
(4)仪器b的优点为___________ ,仪器a的作用是___________ 。
(5)上述装置的缺点是___________ ,可能导致的结果及原因是___________ 。
 .在生活中亚硝酸钠(
.在生活中亚硝酸钠( )应用十分广泛,它是一种白色固体,外观与
)应用十分广泛,它是一种白色固体,外观与 极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知:
极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长,还可用于治疗氰化物中毒等。某化学兴趣小组查阅资料得知: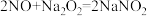 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
 能被高锰酸钾氧化,但不能被浓硫酸氧化。
能被高锰酸钾氧化,但不能被浓硫酸氧化。②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
(1)盛放浓硝酸的仪器名称为
(2)反应开始前打开止水夹a,通入过量氮气排除装置中的空气,若不排除装置中的空气,可能导致产物中混有杂质
(3)盛水的洗气瓶中发生的反应的化方程式为
 .利用氨气与次氯酸钠反应制备
.利用氨气与次氯酸钠反应制备 ,其制备装置如图所示。
,其制备装置如图所示。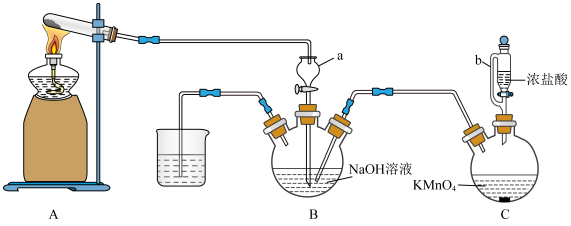
(4)仪器b的优点为
(5)上述装置的缺点是
您最近一年使用:0次
名校
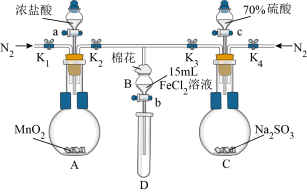
6 . 为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹K1~K4,再通入一段时间N2,然后拆卸,洗涤,整理仪器。
(1)A中反应的离子方程式为___________ 。
(2)步骤Ⅲ中溶液变黄的离子方程式是___________ ,能说明氧化性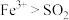 的离子方程式是
的离子方程式是___________ 。
(3)棉花中浸润的溶液是___________ 。
(4)过程Ⅶ的目的是___________ 。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性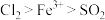 的是
的是___________ (填“甲”、“乙”、“丙”)。
(6)将B中的 溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有
溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为___________ ,该过程的离子方程式为:___________ 。
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
Ⅶ.实验结束后,打开弹簧夹K1~K4,再通入一段时间N2,然后拆卸,洗涤,整理仪器。
(1)A中反应的离子方程式为
(2)步骤Ⅲ中溶液变黄的离子方程式是
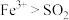 的离子方程式是
的离子方程式是(3)棉花中浸润的溶液是
(4)过程Ⅶ的目的是
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性
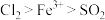 的是
的是| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 既有Fe3+又有Fe2+ | 有SO |
| 乙 | 有Fe3+无Fe2+ | 有Fe2+ |
| 丙 | 有Fe3+无Fe2+ | 有SO |
(6)将B中的
 溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有
溶液换成100ml FeBr2溶液并向其中通入2.24LCl2(标准状况下),若溶液中有 的
的 被氧化成单质
被氧化成单质 ,则原
,则原 溶液中
溶液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
7 . 高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH 溶液,不溶于乙醇;具有强氧化性,在0℃~ 5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.湿法制备K2FeO4 (夹持装置略)_______ mL浓溶液,若所配制的稀溶液浓度偏大,则可能的原因是 _______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水
B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容
D.定容时,仰视液面
(2)A中发生反应的化学方程式是_______ 。
(3)下列试剂中,装置B的X溶液可以选用的是_______ (填字母)。
(4)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是_______ 。
Ⅱ.干法制备高铁酸钾分两步进行
(5)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化剂和还原剂的物质的量之比为_______ ,第二步反应为:Na2FeO4+2KCl=K2FeO4+2NaCl。
(6)实验室用100mL2.00mo/LFeSO4溶液发生上述反应,产品经干燥后得到纯品35.0g,则K2FeO4的产率为_______ (保留一位小数)。
【查阅资料】K2FeO4为紫色固体,易溶于水,微溶于KOH 溶液,不溶于乙醇;具有强氧化性,在0℃~ 5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
I.湿法制备K2FeO4 (夹持装置略)
A.配制前,容量瓶中有少量蒸馏水
B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容
D.定容时,仰视液面
(2)A中发生反应的化学方程式是
(3)下列试剂中,装置B的X溶液可以选用的是_______ (填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(4)C中得到紫色固体和溶液,生成K2FeO4的化学方程式是
Ⅱ.干法制备高铁酸钾分两步进行
(5)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化剂和还原剂的物质的量之比为
(6)实验室用100mL2.00mo/LFeSO4溶液发生上述反应,产品经干燥后得到纯品35.0g,则K2FeO4的产率为
您最近一年使用:0次
8 . 某化学兴趣小组利用以下各装置连接成一整套装置,探究氯气与氨气之间的反应。其中D为纯净干燥的氯气与纯净干燥氨气反应的装置。
(1)连接好装置后,必需进行的一步实验操作是_______ 。
(2)装置C的作用是_______ ,橡胶管 k 的作用是 _______ 。
(3)装置F的试管内装有NH4Cl和Ca(OH)2,其发生反应的化学方程式_______ 。
(4)装置D内出现浓厚的白烟并在容器内壁凝结,另一产物是空气的主要成分之一,写出反应的化学方程式_______ ,在标准状况下生成2.24L 气体产物时反应转移的电子数目为_______ ( 用NA示阿伏加德罗常数的值) 。
(5)Cl2从D装置右边较短的g导管导入,目的是_______ 。

(1)连接好装置后,必需进行的一步实验操作是
(2)装置C的作用是
(3)装置F的试管内装有NH4Cl和Ca(OH)2,其发生反应的化学方程式
(4)装置D内出现浓厚的白烟并在容器内壁凝结,另一产物是空气的主要成分之一,写出反应的化学方程式
(5)Cl2从D装置右边较短的g导管导入,目的是
您最近一年使用:0次
9 . 拟用如图装置设计实验来探究纯净、干燥的氯气与氨气的反应。___________ 。
(2)如图中的装置连接顺序为A→___________ (用大写字母表示)。若按照正确顺序连接实验装置后,整套实验装置存在的主要缺点___________ 。
(3)写出F装置中的反应的一种工业用途:___________ 。
(4)在工业上利用反应N2+3H2 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是___________ (填字母)。
A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)

(2)如图中的装置连接顺序为A→
(3)写出F装置中的反应的一种工业用途:
(4)在工业上利用反应N2+3H2
 2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是
2NH3制备氨气。现在实验室模拟该反应探究影响反应速率的因素,在四个相同的容器中,在不同的温度下(其他条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是A.v(NH3)=0.1mol/(L·min) B.v(H2)=0.6mol/(L·min) C.v(N2)=0.3mol/(L·min)
您最近一年使用:0次
名校
解题方法
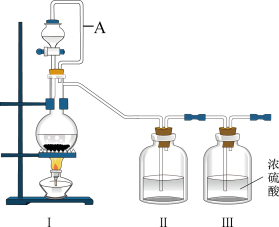
10 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和
_______ 。写出该装置制备氯气的离子方程式:_______ 。
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:________ 。
②装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为______ 。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和

(2)乙组同学利用甲组制得的NO和
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示: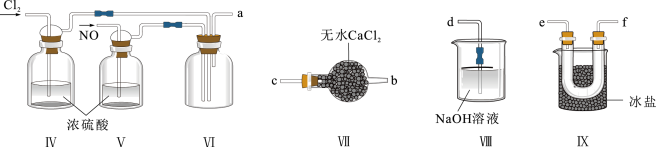
②装置连接顺序为a→
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L
 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次