解题方法
1 . 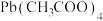 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为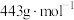 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有:
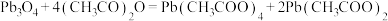
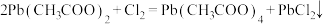
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为_______ 。
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是_______ 。
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为_______ (填仪器接口的小写字母),干燥管中碱石灰的作用是_______ ,步骤Ⅲ中,现象1为_______ 。 ,实验结束理论上可生成
,实验结束理论上可生成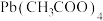 质量为
质量为_______ 。
(5)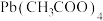 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是_______ ,实验前后,干燥管I质量增加 ,则样品的纯度为
,则样品的纯度为_______ 。
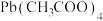 (四乙酸铅,摩尔质量为
(四乙酸铅,摩尔质量为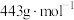 )是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由
)是有机合成中常用的氧化剂,为无色晶体,易溶于热的冰醋酸,在冷溶液中溶解度较小,遇水易分解。通常由 与
与 在乙酸中反应制得,涉及的反应有:
在乙酸中反应制得,涉及的反应有: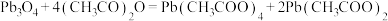
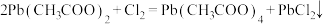
制备过程如下:
步骤I.如图在三颈烧瓶中加入冰醋酸和醋酸酐,混合均匀,加热至65℃,搅拌下分多次加入
 ,维持温度65℃,搅拌至固体完全溶解,充分反应。
,维持温度65℃,搅拌至固体完全溶解,充分反应。
步骤Ⅲ.过滤得到的母液再倒入三颈烧瓶中,加热到
 ℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。
℃,搅拌下通入干燥氯气,观察到现象1时,停止通氯气,趁热过滤,滤液冷却结晶,抽滤,真空干燥,得四乙酸铅粗品。步骤Ⅳ.取步骤Ⅱ和Ⅲ的粗品用冰醋酸重结晶,得纯净四乙酸铅晶体。
回答以下问题:
(1)步骤I采用的加热方式为
(2)步骤Ⅱ中,抽滤时,用纸板或陶瓷片进行覆盖的原因是
(3)步骤Ⅲ中,需要的仪器如下图所示,按气流从左到右的方向,仪器的连接顺序为

 ,实验结束理论上可生成
,实验结束理论上可生成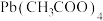 质量为
质量为(5)
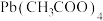 的纯度测定。组装仪器如图,取
的纯度测定。组装仪器如图,取 样品,溶于氯仿,放入三颈烧瓶,通
样品,溶于氯仿,放入三颈烧瓶,通 一段时间后,连接干燥管,向三颈烧瓶中滴入足量
一段时间后,连接干燥管,向三颈烧瓶中滴入足量 ,充分反应,再次通
,充分反应,再次通 一段时间,目的是
一段时间,目的是 ,则样品的纯度为
,则样品的纯度为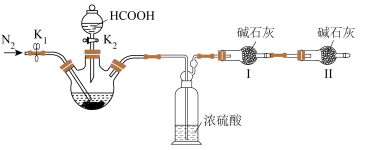
您最近一年使用:0次
解题方法
2 . 某化学小组为了证明二氧化硫和氯水的漂白性,设计了如图所示的实装置:
(1)用来制取氯气的装置是___________ (填字母序号)。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再将B、D两个试管分别加热,___________ (填“B”或“D”)试管中无明显现象。
(3)装置C的主要作用是______________________ 。
(4)该小组同学将两种气体混合后通入品红溶液中,发现漂白效果并不像预期的一样增强。查阅资料得知:两种气体混合,再与水反应可生成两种常见的酸,因而漂白作用减弱,该反应的化学方程式是_________________________ 。

(1)用来制取氯气的装置是
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再将B、D两个试管分别加热,
(3)装置C的主要作用是
(4)该小组同学将两种气体混合后通入品红溶液中,发现漂白效果并不像预期的一样增强。查阅资料得知:两种气体混合,再与水反应可生成两种常见的酸,因而漂白作用减弱,该反应的化学方程式是
您最近一年使用:0次
名校
3 . 铋酸钠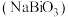 是一种浅黄色不溶于冷水的固体。它常用作分析试剂、氧化剂。实验室利用氯气在碱性溶液中氧化
是一种浅黄色不溶于冷水的固体。它常用作分析试剂、氧化剂。实验室利用氯气在碱性溶液中氧化 ,制备
,制备 的装置如图所示(夹持装置省略)。
的装置如图所示(夹持装置省略)。
Ⅰ.组装仪器,检查装置气密性,装入药品。
Ⅱ._____________,装置C中有白色固体生成,一段时间后关闭活塞c。
Ⅲ.开启磁力搅拌器,打开活塞b,充分反应一段时间,关闭活塞b。
Ⅳ.打开活塞a,通入 一段时间,取下装置C中的三颈烧瓶,将混合液过滤、洗涤、干燥得到产品。
一段时间,取下装置C中的三颈烧瓶,将混合液过滤、洗涤、干燥得到产品。
回答下列问题:
(1)盛浓盐酸的仪器名称为_____________ 。
(2)将步骤Ⅱ操作补充完整:_____________ 。
(3)步骤ⅢC中反应的离子方程式为_____________ 。
(4)步骤Ⅳ中“通入 一段时间”的目的是
一段时间”的目的是_____________ 。
(5) 测定溶液中
测定溶液中 含量。
含量。
在试管中加入 和
和 的混合液,然后加入一定量的
的混合液,然后加入一定量的 ,充分反应分离出剩余的
,充分反应分离出剩余的 ,向所得滤液中加入足量
,向所得滤液中加入足量 溶液,充分反应后转移至锥形瓶中,加入淀粉溶液,用
溶液,充分反应后转移至锥形瓶中,加入淀粉溶液,用 溶液滴定生成的
溶液滴定生成的 ,至终点时消耗溶液
,至终点时消耗溶液 。(已知:
。(已知: 、
、 、
、 ,以上反应均未配平)
,以上反应均未配平)
①滴定终点的现象为_____________ 。
②混合液中 的含量为
的含量为_____________  (用含
(用含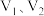 、c的代数式表示);在滴定过程中,下列实验操作会使测定结果偏低的是
、c的代数式表示);在滴定过程中,下列实验操作会使测定结果偏低的是_____________ (填标号)。
a.滴定过程中,锥形瓶内有液体溅出 b.滴定前平视读数,滴定终点时仰视读数
c.锥形瓶用蒸馏水洗涤后未干燥 d.滴定前滴定管尖嘴内无气泡,达到终点有气泡
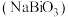 是一种浅黄色不溶于冷水的固体。它常用作分析试剂、氧化剂。实验室利用氯气在碱性溶液中氧化
是一种浅黄色不溶于冷水的固体。它常用作分析试剂、氧化剂。实验室利用氯气在碱性溶液中氧化 ,制备
,制备 的装置如图所示(夹持装置省略)。
的装置如图所示(夹持装置省略)。
Ⅰ.组装仪器,检查装置气密性,装入药品。
Ⅱ._____________,装置C中有白色固体生成,一段时间后关闭活塞c。
Ⅲ.开启磁力搅拌器,打开活塞b,充分反应一段时间,关闭活塞b。
Ⅳ.打开活塞a,通入
 一段时间,取下装置C中的三颈烧瓶,将混合液过滤、洗涤、干燥得到产品。
一段时间,取下装置C中的三颈烧瓶,将混合液过滤、洗涤、干燥得到产品。回答下列问题:
(1)盛浓盐酸的仪器名称为
(2)将步骤Ⅱ操作补充完整:
(3)步骤ⅢC中反应的离子方程式为
(4)步骤Ⅳ中“通入
 一段时间”的目的是
一段时间”的目的是(5)
 测定溶液中
测定溶液中 含量。
含量。在试管中加入
 和
和 的混合液,然后加入一定量的
的混合液,然后加入一定量的 ,充分反应分离出剩余的
,充分反应分离出剩余的 ,向所得滤液中加入足量
,向所得滤液中加入足量 溶液,充分反应后转移至锥形瓶中,加入淀粉溶液,用
溶液,充分反应后转移至锥形瓶中,加入淀粉溶液,用 溶液滴定生成的
溶液滴定生成的 ,至终点时消耗溶液
,至终点时消耗溶液 。(已知:
。(已知: 、
、 、
、 ,以上反应均未配平)
,以上反应均未配平)①滴定终点的现象为
②混合液中
 的含量为
的含量为 (用含
(用含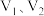 、c的代数式表示);在滴定过程中,下列实验操作会使测定结果偏低的是
、c的代数式表示);在滴定过程中,下列实验操作会使测定结果偏低的是a.滴定过程中,锥形瓶内有液体溅出 b.滴定前平视读数,滴定终点时仰视读数
c.锥形瓶用蒸馏水洗涤后未干燥 d.滴定前滴定管尖嘴内无气泡,达到终点有气泡
您最近一年使用:0次
2024-05-21更新
|
156次组卷
|
2卷引用:2024届山东省高三下学期联合模拟考试模拟预测化学试题
解题方法
4 . 二氯异氰尿酸钠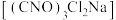 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为______ ,装置D中,盛放 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为______ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到______ 时,关闭 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式______ ,制备过程中要不断通入 ,其目的是
,其目的是______ ,反应完成后需进行的操作为______
③取装置D中溶液,制得产品。操作为______ 、过滤、冷水洗涤、低温干燥得到粗产品
(3)粗产品中 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用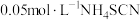 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]
① 的纯度为
的纯度为______ 。
②下列有关上述滴定操作的说法正确的是______ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
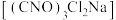 ,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
,具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示: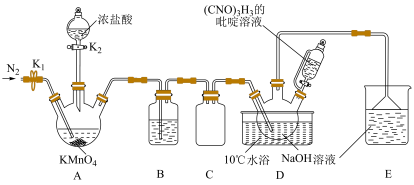
(1)装置B中试剂为
 吡啶溶液的仪器名称为
吡啶溶液的仪器名称为(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭
 ,打开
,打开 ,向A中滴加足量的浓盐酸,当观察到
,向A中滴加足量的浓盐酸,当观察到 ,滴入
,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式 ,其目的是
,其目的是③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml
纯度测定。取1.5g粗产品溶于少量水,加入过量抗坏血酸(维生素C)充分反应,配成100mL溶液,取20.00mL所配制溶液于锥形瓶中,再加入25.00ml 溶液(过量),加入几滴稀
溶液(过量),加入几滴稀 溶液,用
溶液,用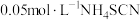 标准溶液滴定至终点,消耗10.00mL标准液。[已知
标准溶液滴定至终点,消耗10.00mL标准液。[已知 (白色)]
(白色)]①
 的纯度为
的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放
 标准溶液的滴定管没有润洗,使测定结果偏大
标准溶液的滴定管没有润洗,使测定结果偏大c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
名校
解题方法
5 . 二氯异氰尿酸钠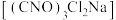 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为___________ 。
(2) 的制备步骤如下:
的制备步骤如下:
①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到___________ 时,滴入 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式___________ 。制备过程中要不断通入Cl2,其目的是___________ ,反应完成后需进行的操作为___________ 。
③取装置D中溶液,制得产品。操作为___________ 、过滤、冷水洗涤、低温干燥得到粗产品。
(3)粗产品中 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量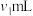
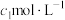 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用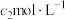 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]
① (摩尔质量为
(摩尔质量为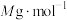 )的纯度为
)的纯度为___________ 。
②下列有关上述滴定操作的说法正确的是___________ 。
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
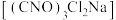 具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和
具有很强的氧化性(遇酸会生成次氯酸),是一种广普高效的杀菌剂,常温下为白色固体、溶于水,难溶于冰水。实验室常用高浓度的NaClO溶液和 (氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(氰尿酸)溶液,在10℃时反应制备二氯异氰尿酸钠,实验装置如图所示:
(1)装置B中试剂为
(2)
 的制备步骤如下:
的制备步骤如下:①检查装置气密性后加入药品。
②关闭K1,打开K2,向A中滴加足量的浓盐酸,关闭K2,当观察到
 的吡啶溶液,写出
的吡啶溶液,写出 和NaClO发生反应的化学方程式
和NaClO发生反应的化学方程式③取装置D中溶液,制得产品。操作为
(3)粗产品中
 纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量
纯度测定。取m g粗产品溶于少量水,加入过量维生素C充分反应,再加入过量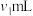
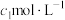 的AgNO3溶液,加入几滴稀
的AgNO3溶液,加入几滴稀 溶液,用
溶液,用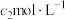 NH4SCN标准溶液滴定至终点,消耗
NH4SCN标准溶液滴定至终点,消耗 标准液。[已知:
标准液。[已知: (白色)]
(白色)]①
 (摩尔质量为
(摩尔质量为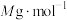 )的纯度为
)的纯度为②下列有关上述滴定操作的说法正确的是
a.接近滴定终点时微微转动活塞,使溶液悬挂在尖嘴上,形成半滴,用锥形瓶内壁将其刮落
b.若盛放NH4SCN标准溶液的滴定管没有润洗,使测定结果偏大
c.锥形瓶洗涤后未干燥即加入所配待测溶液,使测定结果偏小
d.滴定前俯视读数,滴定后仰视读数,使测定结果偏小
您最近一年使用:0次
6 . 空气吹出法工艺,是目前“海水提溴”的最主要方法之一、其工艺流程如下:___________ 。
(2)步骤④利用了SO2的还原性,反应的离子方程式:___________ 。
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为___________ mol。纯碱吸收后再用硫酸酸化,单质溴又从溶液中析出。

(2)步骤④利用了SO2的还原性,反应的离子方程式:
(3)从含溴海水中吹出的溴也可用纯碱吸收,纯碱吸收溴的主要反应是3Na2CO3+3Br2=NaBrO3+5NaBr+3CO2;吸收1 mol Br2时,转移的电子为
您最近一年使用:0次
名校
解题方法
7 . 三氯化硼( )用于制备光导纤维和有机硼化物等,制备原理:
)用于制备光导纤维和有机硼化物等,制备原理: 。某小组据此设计实验制备
。某小组据此设计实验制备 并测定其纯度,装置如下图所示:
并测定其纯度,装置如下图所示: 的熔点为-107.3℃,沸点为12.5℃,极易水解。
的熔点为-107.3℃,沸点为12.5℃,极易水解。
②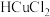 可用于处理尾气CO。
可用于处理尾气CO。
实验(一):制备 。
。
(1)写出制备氯气的离子方程式________________________
(2)装置A中玻璃管a的作用是________________________ ;E装置的作用是____________________ 。
(3)写出 发生水解的化学方程式
发生水解的化学方程式__________________________________ 。
实验(二): 纯度的测定。
纯度的测定。
(4)准确称取wg产品,置于蒸馏水中,完全水解。用硝酸银进行含量测定,反应消耗mg质量分数为b%硝酸银溶液,则产品的纯度为____________ 。(用含字母w、b、m的式子表示)
 )用于制备光导纤维和有机硼化物等,制备原理:
)用于制备光导纤维和有机硼化物等,制备原理: 。某小组据此设计实验制备
。某小组据此设计实验制备 并测定其纯度,装置如下图所示:
并测定其纯度,装置如下图所示:
 的熔点为-107.3℃,沸点为12.5℃,极易水解。
的熔点为-107.3℃,沸点为12.5℃,极易水解。②
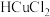 可用于处理尾气CO。
可用于处理尾气CO。实验(一):制备
 。
。(1)写出制备氯气的离子方程式
(2)装置A中玻璃管a的作用是
(3)写出
 发生水解的化学方程式
发生水解的化学方程式实验(二):
 纯度的测定。
纯度的测定。(4)准确称取wg产品,置于蒸馏水中,完全水解。用硝酸银进行含量测定,反应消耗mg质量分数为b%硝酸银溶液,则产品的纯度为
您最近一年使用:0次
8 . 某研究小组为探究元素周期表中元素性质的递变规律,设计了如下实验:
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。___________ ,仪器D的作用是___________ 。
(2)A中加浓盐酸,B中加 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。
①C中加淀粉碘化钾混合溶液,观察到C中溶液有___________ 的现象,即可证明;
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用___________ 溶液吸收尾气;
③ 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:___________ 。以镁为例,发现随着反应时间的进行,化学反应速率是先加快后减慢,分析先加快的主要原因可能是(假设不考虑固体质量的减少对反应速率的影响,填序号)___________ 。
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
请根据以上资料回答下列问题:
①根据资料猜测氯化铝是___________ (填“离子化合物”或“共价化合物”)。
②通过计算确定氯化铝含有配位键的结构式正确的是___________ 。___________ 。
Ⅰ.利用如图装置可验证氯元素和碘元素非金属性的强弱。

(2)A中加浓盐酸,B中加
 (
( 与浓盐酸常温下反应生成氯气)。
与浓盐酸常温下反应生成氯气)。①C中加淀粉碘化钾混合溶液,观察到C中溶液有
②从环境保护的观点考虑,此装置缺少尾气处理装置,可用
③
 与
与 的空间结构相似,其键角大小的关系是
的空间结构相似,其键角大小的关系是
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。Ⅱ.验证同周期元素性质变化规律
(3)将钠、镁、铝各
 分别投入到足量的同浓度的盐酸中,试预测实验结果:
分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈,它的晶体堆积模型如图所示:
与盐酸反应最剧烈,它的晶体堆积模型如图所示:
A.该反应是放热反应
B.该反应是吸热反应
C.温度升高速率加快对化学反应的影响,大于盐酸浓度降低速率减慢的影响
D.温度升高速率加快对化学反应的影响,小于盐酸浓度降低速率减慢的影响
(4)查阅有关氯化铝的一些资料,得到如下一些信息:①将氯化铝加热,在180℃时开始升华;②在
 条件下,氯化铝的熔点为190℃;③在
条件下,氯化铝的熔点为190℃;③在 和
和 时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。
时,它的蒸气密度(换算成标准状况时)是氢气密度的133.5倍;④氯化铝的结构中含有配位键。请根据以上资料回答下列问题:
①根据资料猜测氯化铝是
②通过计算确定氯化铝含有配位键的结构式正确的是
A.  B.
B. C.
C.
您最近一年使用:0次
9 . 二氧化氯常温下为黄绿色气体,在30℃时分解,50℃时发生爆炸性分解,与Cl2的氧化性相近。在生活中被广泛应用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。_______ 。
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是_______ 。
(3)ClO2的释放:在酸性条件下NaClO2发生反应: ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为_______ ,在ClO2释放实验中,打开活塞E,D中发生反应,说明有ClO2释放的实验现象是_______ 。
(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为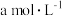 ,如图所示剩余
,如图所示剩余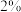 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为_______ 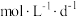 。
。
(2)ClO2的吸收:关闭活塞B,向D中缓慢加入稀盐酸,ClO2在D中被稳定剂完全吸收生成NaClO2,在该反应过程中装置A、D均应控制反应温度低于30C,理由是
(3)ClO2的释放:在酸性条件下NaClO2发生反应:
 ,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为
,完成ClO2的释放,则在该过程中氧化剂和还原剂的物质的量之比为(4)ClO2的应用:己吸收ClO2气体的稳定剂I和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化情况如图所示,若将其用于水果保鲜,稳定剂Ⅱ优于稳定剂I,若稳定剂Ⅱ中ClO2气体的起始浓度为
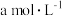 ,如图所示剩余
,如图所示剩余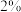 时便失去保鲜作用,则该稳定剂的平均失效速率为
时便失去保鲜作用,则该稳定剂的平均失效速率为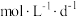 。
。
您最近一年使用:0次
名校
解题方法
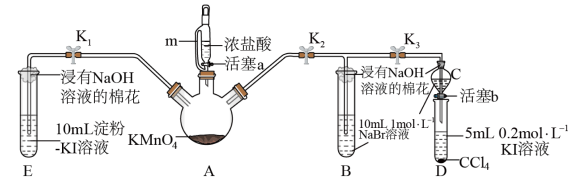
10 . 为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
I.打开 关闭
关闭 ,
, ,打开活塞a,滴加浓盐酸。
,打开活塞a,滴加浓盐酸。
Ⅱ.关闭 ,打开
,打开 ,
, ,当B和C中的溶液都变为黄色时,关闭
,当B和C中的溶液都变为黄色时,关闭 。
。
Ⅲ.B中继续通气体,当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)装置A中m的作用为__________________ 。
(2)能说明氯气的氧化性强于碘的实验现象是___________________ 。
(3)用离子方程式解释过程Ⅱ中溶液变为黄色的原因:_________________ 。
(4)过程V的目的是验证溴的氧化性强于碘,简述其操作过程___________________ 。
(5)过程Ⅲ实验的目的是____________________ 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________________ ,得电子能力逐渐减弱。
I.打开
 关闭
关闭 ,
, ,打开活塞a,滴加浓盐酸。
,打开活塞a,滴加浓盐酸。Ⅱ.关闭
 ,打开
,打开 ,
, ,当B和C中的溶液都变为黄色时,关闭
,当B和C中的溶液都变为黄色时,关闭 。
。Ⅲ.B中继续通气体,当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)装置A中m的作用为
(2)能说明氯气的氧化性强于碘的实验现象是
(3)用离子方程式解释过程Ⅱ中溶液变为黄色的原因:
(4)过程V的目的是验证溴的氧化性强于碘,简述其操作过程
(5)过程Ⅲ实验的目的是
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下
您最近一年使用:0次



