解题方法
1 . 磺酰氯(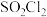 )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的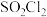 ,装置如图所示(有些夹持装置省略)。
,装置如图所示(有些夹持装置省略)。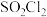 的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
②
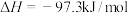
③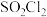 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。
回答下列问题:
(1)装置丙中发生反应的化学方程式为___________ 。
(2)仪器A的名称为___________ ,装置乙中盛放的试剂为___________ ,仪器F中盛放的试剂为___________ ,装置丁中应采取的控制温度的方式为___________ 。
(3)上述仪器的正确连接顺序是___________ 。(填仪器接口字母编号,仪器可重复使用)e→___________→g,h←___________←f
(4)某实验小组利用该装置消耗了标准状况下氯气1120mL( 足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为
足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为___________ (保留3位有效数字)。
(5)某公司开发的Li―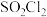 电池,其示意图如图。
电池,其示意图如图。 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为___________ 。
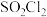 )是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用
)是一种重要的有机合成试剂,也是锂电池正极活性物质。实验室可利用 与
与 在活性炭作用下制取少量的
在活性炭作用下制取少量的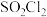 ,装置如图所示(有些夹持装置省略)。
,装置如图所示(有些夹持装置省略)。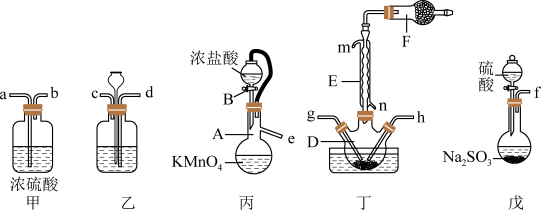
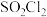 的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。
的熔点为-54.1℃,沸点为69.1℃,常温较稳定。100℃以上易分解。②

③
 遇水发生剧烈反应,并产生大量白雾。
遇水发生剧烈反应,并产生大量白雾。回答下列问题:
(1)装置丙中发生反应的化学方程式为
(2)仪器A的名称为
(3)上述仪器的正确连接顺序是
(4)某实验小组利用该装置消耗了标准状况下氯气1120mL(
 足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为
足量),最后得到纯净的磺酰氯4.0g,则磺酰氯的产率为(5)某公司开发的Li―
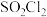 电池,其示意图如图。
电池,其示意图如图。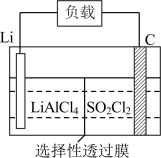
 。则电池工作时,正极的电极反应式为
。则电池工作时,正极的电极反应式为
您最近一年使用:0次
名校
解题方法
2 . 四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
① 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;
② 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。
回答下列问题:
(1)装置A中仪器a的名称是___________ ,用浓盐酸与 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为____________ (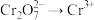 )。
)。
(2)装置的连接顺序为___________ 。
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为_______ (填编号);装置C中冷凝管的作用是____________ ,冷水从_________ 口通入。 、
、 ,此时装置F的作用为
,此时装置F的作用为_________________ 。
(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:_________ 。
(6)装置C中反应结束后,先过滤除去固体_________ (填名称),再经过_________ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下图所示(部分夹持仪器、加热装置已省略)。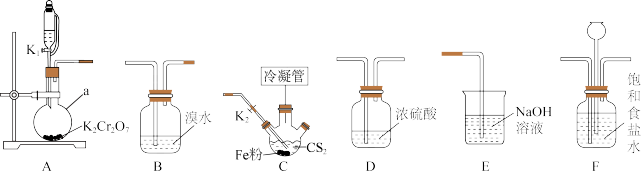
①
 与溴水反应生成硫酸和氢溴酸等,可用溴水吸收
与溴水反应生成硫酸和氢溴酸等,可用溴水吸收 ;
;②
 与
与 在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;
在铁作催化剂的条件下,在装置C中(85~95℃)反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 沸点76.8℃、密度1.6
沸点76.8℃、密度1.6 。
。回答下列问题:
(1)装置A中仪器a的名称是
 反应制取
反应制取 ,发生反应的离子方程式为
,发生反应的离子方程式为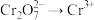 )。
)。(2)装置的连接顺序为
A→_______→________→_______→_____→E。
(3)为使冷凝效果较好,应选用的冷凝管为

 、
、 ,此时装置F的作用为
,此时装置F的作用为(5)反应一段时间后,装置C中出现淡黄色固体,写出装置C中发生反应的化学方程式:
(6)装置C中反应结束后,先过滤除去固体
 。
。
您最近一年使用:0次
7日内更新
|
49次组卷
|
2卷引用:2024届山西省大同市第一中学校高三下学期高考临门一脚(一)理综试卷-高中化学
3 . 已知 是一种黄绿色气体,
是一种黄绿色气体,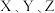 都是有刺激性气味的气体,
都是有刺激性气味的气体, 是人类使用最多的一种金属单质,
是人类使用最多的一种金属单质, 是一种盐,受热易分解.现有以下转化关系,部分产物未标出。
是一种盐,受热易分解.现有以下转化关系,部分产物未标出。
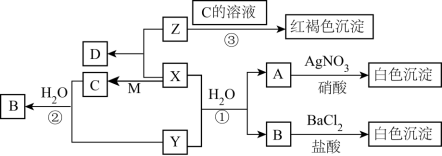
试回答下列问题:
(1)写出下列物质的化学式:X_________________ 、Y_________________ 、D_________________ 。
(2)写出下列反应的离子方程式。
①
_________________ ;
② —红褐色沉淀:
—红褐色沉淀:_________________ 。
(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式:_______________ 。
(4)大苏打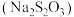 在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途.现欲在实验室制备大苏打,从氧化还原角度分析,合理的是_________________(填字母选项)。
在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途.现欲在实验室制备大苏打,从氧化还原角度分析,合理的是_________________(填字母选项)。
 是一种黄绿色气体,
是一种黄绿色气体,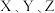 都是有刺激性气味的气体,
都是有刺激性气味的气体, 是人类使用最多的一种金属单质,
是人类使用最多的一种金属单质, 是一种盐,受热易分解.现有以下转化关系,部分产物未标出。
是一种盐,受热易分解.现有以下转化关系,部分产物未标出。
试回答下列问题:
(1)写出下列物质的化学式:X
(2)写出下列反应的离子方程式。
①

②
 —红褐色沉淀:
—红褐色沉淀:(3)Z是合成硝酸的重要原料,请写出其与氧气在催化剂的作用下反应的化学方程式:
(4)大苏打
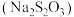 在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途.现欲在实验室制备大苏打,从氧化还原角度分析,合理的是_________________(填字母选项)。
在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途.现欲在实验室制备大苏打,从氧化还原角度分析,合理的是_________________(填字母选项)。A. | B.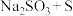 | C. | D.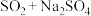 |
您最近一年使用:0次
名校
解题方法
4 . 某小组设计实验探究 和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
回答下列问题:
(1)装置B中试剂是________ (填名称),装置E的作用是____________ 。
(2)装置A中反应的离子方程式为______________ 。
(3)能证明氯的非金属性比硫强的实验现象是___________ 。经检验装置C中最终生成了 ,写出C中浑浊变澄清时反应的化学方程式:
,写出C中浑浊变澄清时反应的化学方程式:____________ 。
(4)根据装置D中现象,有人认为 被氧化了。请你设计实验证明他的观点是否正确:
被氧化了。请你设计实验证明他的观点是否正确:____________ 。
(5)实验完毕后,利用下列装置测定装置A中剩余盐酸的浓度:
将装置A中剩余溶液过滤,取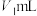 滤液进行实验,最终收集
滤液进行实验,最终收集 的体积为
的体积为 (已折合成标准状况)。
(已折合成标准状况)。
a.读数 b.冷却至室温 c.调平量气管和烧杯的液面
正确操作步骤的顺序为________ (填字母)。
②能与 反应的最低盐酸浓度为
反应的最低盐酸浓度为________  (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
 和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
和浓盐酸反应的最低浓度以及氯气的性质,实验装置如图所示。
回答下列问题:
(1)装置B中试剂是
(2)装置A中反应的离子方程式为
(3)能证明氯的非金属性比硫强的实验现象是
 ,写出C中浑浊变澄清时反应的化学方程式:
,写出C中浑浊变澄清时反应的化学方程式:(4)根据装置D中现象,有人认为
 被氧化了。请你设计实验证明他的观点是否正确:
被氧化了。请你设计实验证明他的观点是否正确:(5)实验完毕后,利用下列装置测定装置A中剩余盐酸的浓度:
将装置A中剩余溶液过滤,取
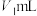 滤液进行实验,最终收集
滤液进行实验,最终收集 的体积为
的体积为 (已折合成标准状况)。
(已折合成标准状况)。
a.读数 b.冷却至室温 c.调平量气管和烧杯的液面
正确操作步骤的顺序为
②能与
 反应的最低盐酸浓度为
反应的最低盐酸浓度为 (用含
(用含 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-04-04更新
|
631次组卷
|
5卷引用:山西省晋中市2024届高三第二次优生测试理综合化学试题-
山西省晋中市2024届高三第二次优生测试理综合化学试题-河南省濮阳市2024届高三下学期第二次模拟考试理科综合化学试题河南省濮阳市2024届高三第一次模拟考试理综-化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)2024届河南省鹤壁市高中高三下学期模拟预测化学试题
名校
5 . 到目前为止,我们学习了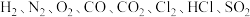 、
、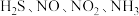 等气体.
等气体.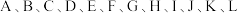 各代表以上气体中一种气体,它们具有如下性质:
各代表以上气体中一种气体,它们具有如下性质:
①A能使湿润的红色石蕊试纸变蓝,A和B相遇时,会产生大量白烟;
②将C和D分别通入品红溶液时,品红溶液都会褪色,但给褪色后的溶液加热时,通入D的溶液会重新变红,通入C的溶液不会重新变红;
③E和F相遇生成红棕色气体K;
④G有臭鸡蛋气味,G在足量F中燃烧生成D和 ;
;
⑤H在C中燃烧时,生成B,同时在集气瓶口会有白雾出现;
⑥D和I都能使澄清石灰水变浑浊;
⑦J在F中燃烧生成I.
⑧在加热及催化剂催化下,J和E反应生成I和L.
(1)实验室收集气体E的方法为_________ ,收集气体K的方法为_________ 。
(2)A的电子式为_________ 。
(3)①中生成白烟的成分为_______ (填名称)。
(4)④中发生反应的化学方程式为_________________ 。
(5)⑤中火焰颜色为________ .白雾成分为_________ (选填“ ”或“盐酸”)。
”或“盐酸”)。
(6)⑧中发生反应的化学方程式为_________________ 。
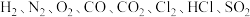 、
、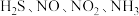 等气体.
等气体.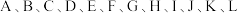 各代表以上气体中一种气体,它们具有如下性质:
各代表以上气体中一种气体,它们具有如下性质:①A能使湿润的红色石蕊试纸变蓝,A和B相遇时,会产生大量白烟;
②将C和D分别通入品红溶液时,品红溶液都会褪色,但给褪色后的溶液加热时,通入D的溶液会重新变红,通入C的溶液不会重新变红;
③E和F相遇生成红棕色气体K;
④G有臭鸡蛋气味,G在足量F中燃烧生成D和
 ;
;⑤H在C中燃烧时,生成B,同时在集气瓶口会有白雾出现;
⑥D和I都能使澄清石灰水变浑浊;
⑦J在F中燃烧生成I.
⑧在加热及催化剂催化下,J和E反应生成I和L.
(1)实验室收集气体E的方法为
(2)A的电子式为
(3)①中生成白烟的成分为
(4)④中发生反应的化学方程式为
(5)⑤中火焰颜色为
 ”或“盐酸”)。
”或“盐酸”)。(6)⑧中发生反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 次氯酸钠是家用消毒剂的有效成分。实验室制备次氯酸钠的装置如图所示。
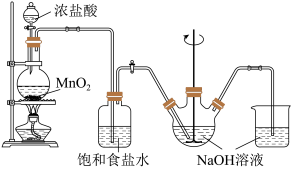
(1)在圆底烧瓶里加入二氧化锰后,通过___________ (填仪器名称)向烧瓶中加入适量的浓盐酸并加热。发生反应的离子方程式为___________ 。
(2)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
 。
。
①用双线桥标出该反应中电子转移的方向和数目___________ 。
②若产生标准状况下4.48L ,则反应过程中被氧化的HCl的物质的量是
,则反应过程中被氧化的HCl的物质的量是___________ mol,转移电子的物质的量为___________ mol。
(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与消毒液(主要成分是NaClO)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:___________ 。

(1)在圆底烧瓶里加入二氧化锰后,通过
(2)实验室还可用高锰酸钾快速地制取氯气,反应的化学方程式如下:
 。
。①用双线桥标出该反应中电子转移的方向和数目
②若产生标准状况下4.48L
 ,则反应过程中被氧化的HCl的物质的量是
,则反应过程中被氧化的HCl的物质的量是(3)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与消毒液(主要成分是NaClO)而发生氯气中毒事件。请从氧化还原反应的角度分析原因:
您最近一年使用:0次
7 . 常用的自来水消毒剂有高铁酸钾 、二氧化氯等.回答下列问题:
、二氧化氯等.回答下列问题:
Ⅰ.制取高铁酸钾.已知:高铁酸钾易溶于水,微溶于浓 溶液,不溶于乙醇;在强碱性溶液中稳定;酸性至弱碱性条件下,与水反应生成氧气。
溶液,不溶于乙醇;在强碱性溶液中稳定;酸性至弱碱性条件下,与水反应生成氧气。
①
②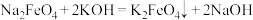
(1)制取 溶液的装置如图所示.装置
溶液的装置如图所示.装置 中反应的化学方程式为
中反应的化学方程式为_____________ 。装置B中盛装的液体是______________ ,玻璃管 的作用是
的作用是_____________ 。
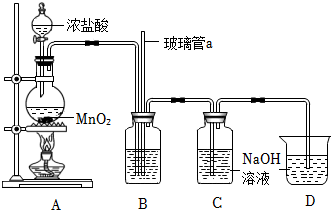
(2)制取高铁酸钾晶体.将装置 中制得的
中制得的 溶液转移到大烧杯中,依次加入一定量的
溶液转移到大烧杯中,依次加入一定量的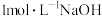 溶液和
溶液和 饱和溶液,搅拌,充分反应,再向反应后的溶液中加入
饱和溶液,搅拌,充分反应,再向反应后的溶液中加入_________________ ,搅拌至_________________ ,静置、过滤,________________ ,干燥。(实验中须使用的试剂: 固体,无水乙醇)
固体,无水乙醇)
Ⅱ.制取二氧化氯,已知:二氧化氯为易溶于水且不与水反应的气体,水溶液是深黄绿色, 时液化成红棕色液体。
时液化成红棕色液体。

(3) 晶体和
晶体和 的乙醇溶液反应制取
的乙醇溶液反应制取 的化学方程式为
的化学方程式为_________________ 。
(4)烧杯中混合液用于吸收产生的 同时生成
同时生成 ,反应的离子方程式为
,反应的离子方程式为_________________ 。
 、二氧化氯等.回答下列问题:
、二氧化氯等.回答下列问题:Ⅰ.制取高铁酸钾.已知:高铁酸钾易溶于水,微溶于浓
 溶液,不溶于乙醇;在强碱性溶液中稳定;酸性至弱碱性条件下,与水反应生成氧气。
溶液,不溶于乙醇;在强碱性溶液中稳定;酸性至弱碱性条件下,与水反应生成氧气。①

②
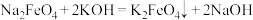
(1)制取
 溶液的装置如图所示.装置
溶液的装置如图所示.装置 中反应的化学方程式为
中反应的化学方程式为 的作用是
的作用是
(2)制取高铁酸钾晶体.将装置
 中制得的
中制得的 溶液转移到大烧杯中,依次加入一定量的
溶液转移到大烧杯中,依次加入一定量的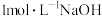 溶液和
溶液和 饱和溶液,搅拌,充分反应,再向反应后的溶液中加入
饱和溶液,搅拌,充分反应,再向反应后的溶液中加入 固体,无水乙醇)
固体,无水乙醇)Ⅱ.制取二氧化氯,已知:二氧化氯为易溶于水且不与水反应的气体,水溶液是深黄绿色,
 时液化成红棕色液体。
时液化成红棕色液体。
(3)
 晶体和
晶体和 的乙醇溶液反应制取
的乙醇溶液反应制取 的化学方程式为
的化学方程式为(4)烧杯中混合液用于吸收产生的
 同时生成
同时生成 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
8 . 某化学学习小组同学用如图装置进行Cl2的制备和性质实验探究。回答下列问题:
(1)若采用图甲所示的装置制备并收集氯气,则氯气中含有的杂质是___________ ;该装置中制取氯气的化学方程式为___________ 。
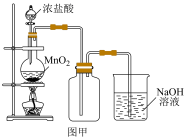
(2)在进行图乙实验中,可以观察到的现象是___________ 。
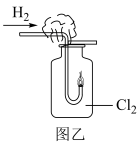
(3)在进行图丙实验时,NaOH溶液的作用是___________ (用离子方程式表示)。对比a和b中的实验现象,能得出的一个结论是___________ 。
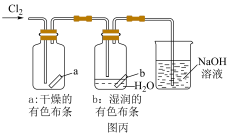
(1)若采用图甲所示的装置制备并收集氯气,则氯气中含有的杂质是

(2)在进行图乙实验中,可以观察到的现象是

(3)在进行图丙实验时,NaOH溶液的作用是

您最近一年使用:0次
9 . 二氧化氯( ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):

已知:实验室可用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:
(1)盛装浓盐酸的仪器名称为_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)装置B中盛放的试剂是_______ 。
(4)向装置D中通入 的目的是
的目的是_______ ,装置D中发生反应的化学方程式为_______ 。
(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为_______ 、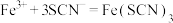 。
。
(6)用 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: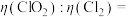
_______ (保留到小数点后两位)。
 ,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠(
,沸点为11.0℃,浓度过高时易爆炸分解)常用作饮用水消毒杀菌剂,实验室常用氯气与亚氯酸钠( )制备
)制备 。制备
。制备 及验证其氧化性的装置如图所示(部分夹持装置已省略):
及验证其氧化性的装置如图所示(部分夹持装置已省略):
已知:实验室可用稳定剂吸收
 ,生成
,生成 ,使用时加酸只释放
,使用时加酸只释放 一种气体;酸性条件下高锰酸钾的还原产物为
一种气体;酸性条件下高锰酸钾的还原产物为 。回答下列问题:
。回答下列问题:(1)盛装浓盐酸的仪器名称为
(2)装置A中发生反应的离子方程式为
(3)装置B中盛放的试剂是
(4)向装置D中通入
 的目的是
的目的是(5)装置G中能观察到溶液显红色,则发生反应的离子方程式为
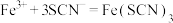 。
。(6)用
 替代
替代 作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率(
作水处理剂时,如果以单位质量的氧化剂所得到的电子数来表示消毒效率( ),那么消毒杀菌剂消毒效率:
),那么消毒杀菌剂消毒效率: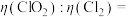
您最近一年使用:0次
10 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。

已知:①饱和食盐水可以除去氯气中混有的氯化氢气体。
②碘的 溶液显紫红色。
溶液显紫红色。
回答下列问题:
(1)写出圆底烧瓶中发生反应的离子方程式:___________ ,e装置的作用为___________ 。
(2)b中盛放的试剂为___________ 。
(3)取少量 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变;2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变;2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。可知该条件下
层显紫红色。可知该条件下 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO。
(4)一定条件下,在一定量的NaOH溶液中通入一定量的氯气,二者恰好完全反应。生成物中除了含有氯离子外,还含有ClO、 两种离子,
两种离子, 、
、 两种离子的物质的量(n)与反应时间(t)的关系如图1所示。则该反应的离子方程式为
两种离子的物质的量(n)与反应时间(t)的关系如图1所示。则该反应的离子方程式为___________ 。

(5)某同学设计实验探究“84”消毒液的漂白性(已知该消毒液中存在反应: )。
)。
I.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL盐酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化关系如图2所示。
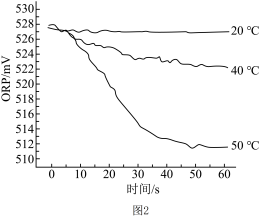
已知:ORP可以表示水溶液中物质的氧化性或还原性强弱。本实验中,ORP值越大,氧化性越强。
①实验I、Ⅱ现象不同的原因是___________ 。
②实验Ⅲ中,随温度的变化ORP值不同的原因可能是___________ 。
③针对不同物品的消毒,需将“84”消毒液稀释到不同的浓度。已知某品牌“84”消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100g,加水稀释成8%的溶液,则需加水的质量为___________ g。
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
已知:①饱和食盐水可以除去氯气中混有的氯化氢气体。
②碘的
 溶液显紫红色。
溶液显紫红色。回答下列问题:
(1)写出圆底烧瓶中发生反应的离子方程式:
(2)b中盛放的试剂为
(3)取少量
 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变;2号试管溶液变为棕色,加入
和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变;2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。可知该条件下
层显紫红色。可知该条件下 的氧化能力
的氧化能力(4)一定条件下,在一定量的NaOH溶液中通入一定量的氯气,二者恰好完全反应。生成物中除了含有氯离子外,还含有ClO、
 两种离子,
两种离子, 、
、 两种离子的物质的量(n)与反应时间(t)的关系如图1所示。则该反应的离子方程式为
两种离子的物质的量(n)与反应时间(t)的关系如图1所示。则该反应的离子方程式为
(5)某同学设计实验探究“84”消毒液的漂白性(已知该消毒液中存在反应:
 )。
)。I.在2mL“84”消毒液中加入2mL水后,放入红色纸片,观察到纸片慢慢褪色。
Ⅱ.在2mL“84”消毒液中加入2mL盐酸后,放入红色纸片,观察到纸片迅速褪色。
Ⅲ.在不同温度时,测得“84”消毒液ORP值随时间的变化关系如图2所示。

已知:ORP可以表示水溶液中物质的氧化性或还原性强弱。本实验中,ORP值越大,氧化性越强。
①实验I、Ⅱ现象不同的原因是
②实验Ⅲ中,随温度的变化ORP值不同的原因可能是
③针对不同物品的消毒,需将“84”消毒液稀释到不同的浓度。已知某品牌“84”消毒液中次氯酸钠的质量分数为12.6%,若取该消毒液100g,加水稀释成8%的溶液,则需加水的质量为
您最近一年使用:0次



