名校
1 . 下列关于 和
和 的认识正确的是
的认识正确的是
 和
和 的认识正确的是
的认识正确的是| A.从鉴别角度,品红溶液或澄清石灰水都能鉴别二者 |
| B.从在水中是否发生电离的角度,二者都属于电解质 |
| C.从价态和类别角度,二者都属于酸性氧化物,都具有氧化性 |
| D.从对环境影响角度,二者都能导致酸雨 |
您最近一年使用:0次
2023-01-04更新
|
495次组卷
|
4卷引用:上海市复旦大学附属中学2021-2022学年高一上学期期末考试化学试题
上海市复旦大学附属中学2021-2022学年高一上学期期末考试化学试题上海市民立中学2022-2023学年高一上学期期末考试化学试题(已下线)专题01 硫及其化合物的性质及转化(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)(已下线)猜想01 硫及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
解题方法
2 . 向吸收液中通入过量的 制备无水
制备无水 的主要流程如下,通入
的主要流程如下,通入 所引起的溶液体积变化和
所引起的溶液体积变化和 挥发可忽略,下列说法
挥发可忽略,下列说法不正确 的是

 制备无水
制备无水 的主要流程如下,通入
的主要流程如下,通入 所引起的溶液体积变化和
所引起的溶液体积变化和 挥发可忽略,下列说法
挥发可忽略,下列说法
A.母液中: |
B.中和后的溶液中: |
C.吸收过程中有 气体产生 气体产生 |
D.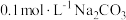 溶液中: 溶液中: |
您最近一年使用:0次
2023-02-15更新
|
614次组卷
|
4卷引用:素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)
(已下线)素养卷08 微型化学工艺流程分析-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)江苏省无锡市2022-2023学年高三上学期期末调研测试化学试题(已下线)江苏省2022年普通高中学业水平选择性考试变式题(选择题11-13)江苏省常州市联盟学校2022-2023学年高二下学期期中学情调研化学试题
名校
解题方法
3 . 某实验小组利用下图装置模拟古法硫酸生产方法并进行SO2性质探究。

已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
完成下列填空:
(1)C装置中覆盖食用油的目的是___________ ;D装置的作用___________ 。B中所得硫酸溶液的质量分数理论值为___________ (保留三位小数)。
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
得到如下pH-t图:
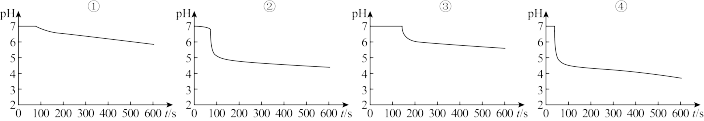
(2)曲线①呈缓慢下降趋势,这是因为___________ 。曲线②出现骤降,表明溶液中生成了___________ (填物质名称)。对比分析上述四组数据,可得出的结论是_________ (任写2条)。
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为_______ 。若该实验数据较实际值偏大,则可能的原因是________ (选填编号)。
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面

已知A中反应的化学方程式:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。完成下列填空:
(1)C装置中覆盖食用油的目的是
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||

(2)曲线①呈缓慢下降趋势,这是因为
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
您最近一年使用:0次
2022-01-15更新
|
1079次组卷
|
3卷引用:上海市浦东新区2022届高三一模化学试题
上海市浦东新区2022届高三一模化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
名校
解题方法
4 . 将SO2分别通入下列五种溶液中:

回答下列问题:
(1)试管①中的实验现象:KMnO4溶液____ ,证明SO2具有___ 性。
(2)试管②中的实验现象:溶液____ ,证明SO2具有____ 性。
(3)试管③中的实验现象:溶液____ ,证明SO2能中和NaOH,写出该反应的离子方程式:____ 。
(4)试管④中能产生____ 沉淀,该沉淀是____ 。
(5)试管⑤中能产生白色沉淀,该沉淀是____ 。

回答下列问题:
(1)试管①中的实验现象:KMnO4溶液
(2)试管②中的实验现象:溶液
(3)试管③中的实验现象:溶液
(4)试管④中能产生
(5)试管⑤中能产生白色沉淀,该沉淀是
您最近一年使用:0次
2022-03-02更新
|
731次组卷
|
3卷引用:课前-5.1.1 硫和二氧化硫-人教2019必修第二册
名校
解题方法
5 . 探究 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
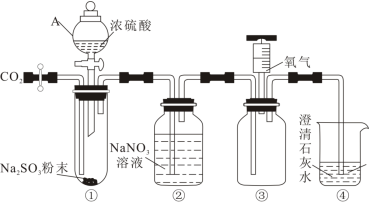
(1)仪器A在使用前应_______ 。装置连接完成后,先检查装置气密性,再加入试剂,通入 ,通入
,通入 的目的是
的目的是_______ ,直至装置④中现象为_______ ,停止通入 。
。
(2)将装置④中盛放 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到_______ ,说明装置②中反应生成了NO,写出装置②中反应的离子方程式_______ 。
(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。
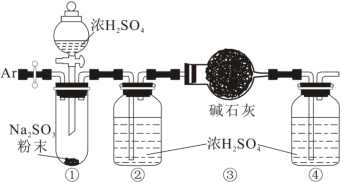
称取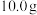 固体,进行如下实验:
固体,进行如下实验:
a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量 )和装置④连接好;
)和装置④连接好;
c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为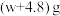 。
。
该样品中亚硫酸钠的纯度为_______ ;若实验中缺少步骤d,会使测定结果_______ (填“偏高”、“偏低”或“无影响”)。
 与
与 溶液反应的实验装置如图所示。回答下列问题。
溶液反应的实验装置如图所示。回答下列问题。
(1)仪器A在使用前应
 ,通入
,通入 的目的是
的目的是 。
。(2)将装置④中盛放
 溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使
溶液的烧杯替换,打开A仪器活塞,向装置①中滴加浓硫酸,使 缓慢通入装置②中,直至装置②中反应完全,停止通入
缓慢通入装置②中,直至装置②中反应完全,停止通入 。将装置③注射器中氧气注入广口瓶,观察到
。将装置③注射器中氧气注入广口瓶,观察到(3)为测定某亚硫酸钠样品的纯度,对上述装置进行如下改进。

称取
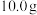 固体,进行如下实验:
固体,进行如下实验:a.通入氩气排净装置①、②中的空气;
b.将盛有碱石灰的干燥管(总质量
 )和装置④连接好;
)和装置④连接好;c.打开分液漏斗活塞,向装置①中滴加浓硫酸;
d.续通入氩气,直至装置④收集到的Ar纯净;
e.拆除装置,称量装置③的总质量为
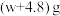 。
。该样品中亚硫酸钠的纯度为
您最近一年使用:0次
2022-01-10更新
|
541次组卷
|
3卷引用:河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题
河南省义马市高级中学2021-2022学年高三上学期11月份联考化学试题(已下线)专题28 性质探究类综合性实验题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)湖南省株洲市攸县第四中学2022-2023学年高三上学期第四次月考化学试题
名校
解题方法
6 . 下列关于 性质的预测中,
性质的预测中,不合理 的是
 性质的预测中,
性质的预测中,A.从 元素价态看, 元素价态看, 具有氧化性 具有氧化性 |
B.从 元素价态看, 元素价态看, 具有还原性,可能被 具有还原性,可能被 氧化 氧化 |
C.从类别角度看, 属于酸性氧化物,能与碱溶液反应生成盐和水 属于酸性氧化物,能与碱溶液反应生成盐和水 |
D.从类别角度看, 属于酸性氧化物,能与水反应生成硫酸 属于酸性氧化物,能与水反应生成硫酸 |
您最近一年使用:0次
2024-02-18更新
|
423次组卷
|
3卷引用:北京市第九中学2023-2024学年高一上学期期中统练化学试题
北京市第九中学2023-2024学年高一上学期期中统练化学试题(已下线)5.1.1硫和二氧化硫课后作业基础篇内蒙古赤峰市元宝山区第一中学、新红旗中学联考2023-2024学年高一下学期4月月考化学试题
名校
解题方法
7 . 下列实验中的颜色变化与氧化还原反应有关的是
| A.向K2Cr2O7酸性溶液中加入乙醇,溶液由橙色变为绿色 |
| B.将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 |
| C.KI溶液滴入AgCl浊液中,沉淀由白色逐渐变为黄色 |
| D.KSCN溶液滴入FeCl3溶液中,溶液由黄色变为红色。 |
您最近一年使用:0次
名校
8 . Na2S2O4(保险粉)是一种强还原剂,锌粉法制备Na2S2O4,涉及部分原理如下:2SO2 +Zn ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
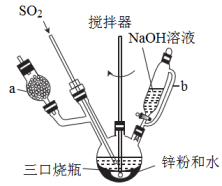
(1)仪器a中盛放的药品是___________ (填名称)。
(2)实验开始前,需要向三口烧瓶中充满N2,目的是___________ 。
(3)制备ZnS2O4时, 三口烧瓶的加热方式是___________ 。
(4)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后,过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤,酒精洗涤及干燥得产品。该步生成产品的化学方程式是___________ 。
(5)加入NaCl固体的作用是___________ , 酒精洗涤的目的是___________ 。
(6)取ag产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用cmol·L-1的K3[Fe(CN)6]标准溶液滴定,至终点时消耗K3[Fe(CN)6]标准溶液V mL。已知: [Fe(CN)6]3-被还原为[Fe(CN)6]4+,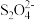 被氧化为
被氧化为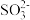 。产品中Na2S2O4的质量分数为
。产品中Na2S2O4的质量分数为___________ (列出计算式)。
 ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
ZnS2O4。制备Na2S2O4的装置(夹持及加热装置已省略)如图所示,回答下列问题:
(1)仪器a中盛放的药品是
(2)实验开始前,需要向三口烧瓶中充满N2,目的是
(3)制备ZnS2O4时, 三口烧瓶的加热方式是
(4)Zn粉消耗完全后,在搅拌下向三口烧瓶中加入NaOH溶液,充分反应后,过滤,向滤液中加入NaCl固体,冷却结晶、过滤、蒸馏水洗涤,酒精洗涤及干燥得产品。该步生成产品的化学方程式是
(5)加入NaCl固体的作用是
(6)取ag产品溶于适量NaOH溶液,加入亚甲基蓝指示剂,用cmol·L-1的K3[Fe(CN)6]标准溶液滴定,至终点时消耗K3[Fe(CN)6]标准溶液V mL。已知: [Fe(CN)6]3-被还原为[Fe(CN)6]4+,
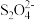 被氧化为
被氧化为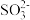 。产品中Na2S2O4的质量分数为
。产品中Na2S2O4的质量分数为
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
9 . 按用量要求书写下列离子方程式:
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如SO2通入NaOH溶液中:
碱过量:___________ ;
碱不足:___________ 。
(2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:
盐酸不足:___________ ;
盐酸过量:___________ 。
(1)可溶性多元弱酸(或其酸酐)与碱溶液反应。如SO2通入NaOH溶液中:
碱过量:
碱不足:
(2)多元弱酸盐与强酸反应。如Na2CO3溶液与稀盐酸:
盐酸不足:
盐酸过量:
您最近一年使用:0次
解题方法
10 . 2022年4月16日,神舟十三号载人飞船返回舱在东风着陆场顺利着陆。飞船的燃料为偏二甲肼(C2H8N2),发射时发生的反应为:C2H8N2+2N2O4 3N2+2CO2+4H2O,下列说法正确的是
3N2+2CO2+4H2O,下列说法正确的是
 3N2+2CO2+4H2O,下列说法正确的是
3N2+2CO2+4H2O,下列说法正确的是| A.偏二甲肼在反应中作还原剂 | B.燃烧时吸收大量的热 |
| C.CO2的大量排放会导致酸雨 | D.N2O4属于酸性氧化物 |
您最近一年使用:0次



