江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏
高三
模拟预测
2022-06-15
675次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏
高三
模拟预测
2022-06-15
675次
整体难度:
容易
考查范围:
认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
解题方法
1. 2022年4月16日,神舟十三号载人飞船返回舱在东风着陆场顺利着陆。飞船的燃料为偏二甲肼(C2H8N2),发射时发生的反应为:C2H8N2+2N2O4 3N2+2CO2+4H2O,下列说法正确的是
3N2+2CO2+4H2O,下列说法正确的是
 3N2+2CO2+4H2O,下列说法正确的是
3N2+2CO2+4H2O,下列说法正确的是| A.偏二甲肼在反应中作还原剂 | B.燃烧时吸收大量的热 |
| C.CO2的大量排放会导致酸雨 | D.N2O4属于酸性氧化物 |
您最近一年使用:0次
单选题
|
容易(0.94)
名校
解题方法
2. 工业上利用MgCl2•6H2O+6SOCl2 MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是
MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是
 MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是
MgCl2+6SO2↑+12HCl↑制备无水MgCl2。下列说法正确的是| A.SO2为非极性分子 | B.MgCl2中既含离子键又含共价键 |
C.H2O的电子式为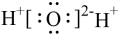 | D.基态O原子的电子排布式为1s22s22p4 |
您最近一年使用:0次
2022-05-27更新
|
563次组卷
|
4卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏省淮安市2022届高三下学期5月模拟测试化学试题江苏省响水中学2022-2023学年高三上学期开学测试化学试题(已下线)易错点15 化学键-备战2023年高考化学考试易错题江苏省宿迁市北大附属宿迁实验学校2022-2023学年高三上学期开学考试化学试题
单选题
|
较易(0.85)
名校
解题方法
3. 下列由废铁屑制取无水Fe2(SO4)3的实验原理与装置不能 达到实验目的的是


| A.用装置甲除去废铁屑表面的油污 | B.用装置乙溶解废铁屑制Fe2(SO4)3 |
| C.用装置丙过滤得到Fe2(SO4)3溶液 | D.用装置丁蒸干溶液获得Fe2(SO4)3 |
【知识点】 亚铁盐溶液蒸干灼烧解读 物质分离、提纯的常见物理方法
您最近一年使用:0次
2022-05-27更新
|
1157次组卷
|
7卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 下列关于氯及其化合物的性质与用途具有对应关系的是
| A.Cl2易液化,可用于生产盐酸 | B.ClO2有强氧化性,可用于自来水消毒 |
| C.CCl4难溶于水,可用作灭火剂 | D.HCl极易溶于水,可用于检验NH3 |
【知识点】 氯气的用途解读 氨与氯化氢反应的实验解读
您最近一年使用:0次
2022-05-27更新
|
986次组卷
|
9卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏省淮安市2022届高三下学期5月模拟测试化学试题浙江省舟山市普陀中学2021-2022学年高一下学期6月月考化学试题(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)湖北省襄阳市第五中学2022届高三年级适应性考试(五)化学试题(已下线)第09讲 氯气的性质-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )(已下线)第四章 非金属及其化合物(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省泗阳中学2022-2023学年高一上学期1月期末化学试题江苏省盐城市射阳高级中学 上冈中学 新丰中学 东元中学2023-2024学年高一上学期1月期末化学试题
单选题
|
较易(0.85)
解题方法
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子2p轨道上有3个电子,Z是元素周期表中电负性最大的元素,W与Y同主族。下列说法正确的是
| A.原子半径:r(W)>r(Z)>r(Y)>r(X) |
| B.X氧化物的水化物是一定是强酸 |
| C.Y的第一电离能比同周期相邻元素小 |
| D.W的简单气态氢化物的稳定性比Y的强 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
6. 如NOx是大气中主要的污染物。大气中过量的NOx和水体中过量的NH 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g)
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO
2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。下列有关NO2、NO
转化为N2。下列有关NO2、NO 、NO
、NO 的说法正确的是
的说法正确的是
 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g)
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO
2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。下列有关NO2、NO
转化为N2。下列有关NO2、NO 、NO
、NO 的说法正确的是
的说法正确的是A.NO 的空间构型为V形 的空间构型为V形 |
B.NO2与NO 中的键角相同 中的键角相同 |
| C.NO2易溶于水是因NO2能与H2O形成分子间氢键 |
| D.配位离子[Fe(NO)]2+中NO提供空轨道 |
您最近一年使用:0次
单选题
|
较易(0.85)
解题方法
7. 如NOx是大气中主要的污染物。大气中过量的NOx和水体中过量的NH 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g)
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO
2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。在指定条件下,下列选项所示的物质间转化
转化为N2。在指定条件下,下列选项所示的物质间转化不能 实现的是
 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g)
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为2NO(g)+2CO(g) 2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO
2CO2(g)+N2(g) △H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。在指定条件下,下列选项所示的物质间转化
转化为N2。在指定条件下,下列选项所示的物质间转化A.N2(g)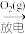 NO(g) NO(g) | B.NO(g) NaNO2(aq) NaNO2(aq) |
C.NH3(g)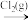 N2(g) N2(g) | D.NO2(g)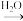 HNO3(aq) HNO3(aq) |
您最近一年使用:0次
单选题
|
适中(0.65)
8. 如NOx是大气中主要的污染物。大气中过量的NOx和水体中过量的NH 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为 △H=-746.5kJ·mol-1];也可将水体中的NO
△H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。对于反应
转化为N2。对于反应 ,下列说法正确的是
,下列说法正确的是
 、NO
、NO 、NO
、NO 均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为
均是污染物。通过催化还原的方法,可将烟气和机动车尾气中的NO转化为N2[反应为 △H=-746.5kJ·mol-1];也可将水体中的NO
△H=-746.5kJ·mol-1];也可将水体中的NO 、NO
、NO 转化为N2。对于反应
转化为N2。对于反应 ,下列说法正确的是
,下列说法正确的是| A.该反应在任何条件下都能自发进行 |
B.反应的平衡常数可表示为K=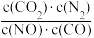 |
| C.使用高效的催化剂可以降低反应的焓变 |
D.其它条件不变,增大 的值,NO的转化率下降 的值,NO的转化率下降 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
9. 以含钴废渣(主要成分为CoO和Co2O3,含少量Al2O3和ZnO)为原料制备CoCO3的工艺流程如图:

下列说法正确的是

下列说法正确的是
| A.酸浸时可采用高温提高酸浸速率 |
| B.除铝时加入Na2CO3溶液过滤后所得滤渣是Al2(CO3)3 |
| C.萃取时萃取剂总量一定,分多次加入萃取比一次加入萃取效果更好 |
| D.沉钴时将含Co2+的溶液缓慢滴加到Na2CO3溶液中,可提高CoCO3的产率 |
您最近一年使用:0次
2022-05-27更新
|
423次组卷
|
6卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏省淮安市2022届高三下学期5月模拟测试化学试题(已下线)考点15 铝及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铝及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省常熟中学2023-2024学年高三上学期阶段性抽测一化学试题2024届江苏省常熟市中学高三上学期阶段性抽测一 化学试题
单选题
|
较易(0.85)
解题方法
10. 有机物Z为是合成某药物的重要中间体,可由下列反应制得。
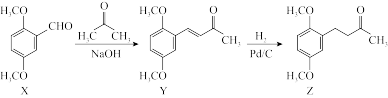
下列有关化合物X、Y和Z的说法正确的是

下列有关化合物X、Y和Z的说法正确的是
| A.1molX中含有6mol碳氧σ键 |
| B.Y分子含有三种官能团 |
| C.X、Y可用酸性KMnO4溶液鉴别 |
| D.Z分子与足量H2加成后的产物中含有3个手性碳原子 |
【知识点】 常见官能团名称、组成及结构解读 分子的手性解读 醛类性质
您最近一年使用:0次
11. 检验淀粉水解,实验步骤如下:
步骤1:向试管中加入4mL淀粉溶液,再加入少量稀硫酸,加热4分钟,冷却后将溶液分装在两支试管中;
步骤2:向一支试管中滴加几滴碘水,观察现象;
步骤3:向另一支试管中先加入烧碱溶液中和,再加入银氨溶液,水浴加热煮沸,观察现象。
下列说法错误的是
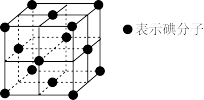
步骤1:向试管中加入4mL淀粉溶液,再加入少量稀硫酸,加热4分钟,冷却后将溶液分装在两支试管中;
步骤2:向一支试管中滴加几滴碘水,观察现象;
步骤3:向另一支试管中先加入烧碱溶液中和,再加入银氨溶液,水浴加热煮沸,观察现象。
下列说法错误的是

| A.步骤1中加入稀硫酸可以加快淀粉水解速率 |
| B.步骤2中溶液变蓝色,说明淀粉没有完全水解 |
| C.步骤3中水浴加热后观察到有光亮的银镜,说明淀粉已经水解 |
| D.碘晶胞如图所示,则碘分子的配位数是8 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
12. 间接电解法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列有关说法正确的是


| A.电解后右侧Na2SO4溶液浓度不变 |
B.电极I的电极反应式为:2HSO +2e-=S2O +2e-=S2O +2OH- +2OH- |
| C.电解过程中电极II附近溶液的pH减小 |
| D.工作时有0.4molH+通过质子膜时可处理4.48LNO |
您最近一年使用:0次
2022-05-27更新
|
267次组卷
|
2卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
单选题
|
较难(0.4)
解题方法
13. 室温下,Ka1(H2SO3)=10-1.81,Ka1(H2SO3)=10-6.99。室温下通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol·L-1NaHSO3溶液中加氨水至pH=7。
实验3:向0.10mol·L-1Na2SO3溶液中滴几滴0.10mol·L-1FeCl3溶液,再滴加KSCN溶液,溶液不变红。
实验4:向0.10mol·L-1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是
A.实验1的溶液中: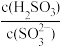 =10-1.6 =10-1.6 |
B.实验2得到的溶液中有 |
C.实验3中加FeCl3溶液的离子方程式为: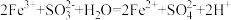 |
D.实验4的上层清液中有c(SO )•c(Ba2+)=Ksp(BaSO3),产生的气体中一定有SO2 )•c(Ba2+)=Ksp(BaSO3),产生的气体中一定有SO2 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
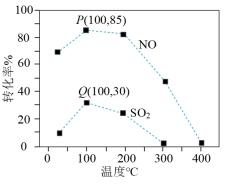
14. 某科研小组研究臭氧脱除SO2和NO工艺,反应原理及反应热、活化能数据如下:
反应I:NO(g)+O3(g) NO2(g)+O2(g) △H1=-200.9kJ·mol-1 Ea1=+3.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.9kJ·mol-1 Ea1=+3.2kJ·mol-1
反应II:SO2(g)+O3(g) SO3(g)+O2(g) △H2=-241.6kJ·mol-1 Ea2=+58kJ·mol-1
SO3(g)+O2(g) △H2=-241.6kJ·mol-1 Ea2=+58kJ·mol-1
已知该体系中臭氧发生分解反应:2O3(g) 3O2(g)。
3O2(g)。
向容积一定的反应器中充入含1.0molNO、1.0molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示,下列说法错误的是
反应I:NO(g)+O3(g)
 NO2(g)+O2(g) △H1=-200.9kJ·mol-1 Ea1=+3.2kJ·mol-1
NO2(g)+O2(g) △H1=-200.9kJ·mol-1 Ea1=+3.2kJ·mol-1反应II:SO2(g)+O3(g)
 SO3(g)+O2(g) △H2=-241.6kJ·mol-1 Ea2=+58kJ·mol-1
SO3(g)+O2(g) △H2=-241.6kJ·mol-1 Ea2=+58kJ·mol-1已知该体系中臭氧发生分解反应:2O3(g)
 3O2(g)。
3O2(g)。向容积一定的反应器中充入含1.0molNO、1.0molSO2的模拟烟气和2.0molO3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示,下列说法错误的是

| A.Q点一定为平衡状态点 |
| B.相同温度下NO的转化率远高于SO2,主要原因是Ea1小于Ea2 |
| C.300℃后,SO2转化率接近于零且不再变化,主要原因是O3分解 |
| D.其他条件不变,扩大反应器的容积可以降低NO和SO2单位时间内的转化率 |
您最近一年使用:0次
2022-05-27更新
|
743次组卷
|
5卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
江苏省淮安市2022届高三下学期5月模拟测试化学试题江苏省启东中学2022届高三最后一考化学试题(已下线)专题讲座(七) 常考速率、平衡图像题解题策略(练)-2023年高考化学一轮复习讲练测(全国通用)江苏省海安市立发中学2022-2023学年高三上学期学情检测卷(二)化学试题江苏省泰州中学2022-2023学年高二5月检测化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
解题方法
15. 钒被称为“工业味精”、“工业维生素”,在发展现代工业、国防等方面发挥着重要的作用。一种用废钒催化剂(含V2O5、少量Al2O3、Fe2O3)制取V2O5的工艺流程如图:

已知:溶液中四种含钒微粒的存在形式和颜色:V2+紫色,V3+绿色,VO2+蓝色,VO 黄色。回答下列问题:
黄色。回答下列问题:
(1)“酸浸、还原”时,V2O5被还原为VO2+,该反应的离子方程式为____ 。
(2)“碱浸、氧化”过程中会生成VO2+,在20.00mL0.1mol·L-1VO 溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为
溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为____ 。
(3)“操作1”包括转沉、沉钒和过滤等步骤。
①“转沉”过程中先加石灰乳、再加(NH4)2CO3生成(NH4)3VO4。已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n;则反应Ca3(VO4)2(s)+3CO (aq)
(aq) 2VO
2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为_____ (用含m、n的代数式表示)。
②“沉钒”时加NH4Cl生成NH4VO3,沉钒率随温度的变化如图1所示,温度高于80℃沉钒率下降的原因可能是_____ 。

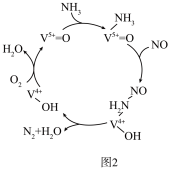
(4)有氧条件下,在V2O5的催化作用下NO可被NH3还原为N2。反应机理如图2所示。NO、NH3在有氧条件下的总反应化学方程式是____ 。
(5)测定产品中V2O5的纯度:称取2.000g产品用硫酸溶解得(VO2)2SO4溶液,加入50.00mL0.5000mol·L-1(NH4)2Fe(SO4)2溶液,发生的反应为VO +2H++Fe2+=VO2++Fe3++H2O,再用0.2000mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为5.00mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O,再用0.2000mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为5.00mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是____ 。(写出计算过程)。

已知:溶液中四种含钒微粒的存在形式和颜色:V2+紫色,V3+绿色,VO2+蓝色,VO
 黄色。回答下列问题:
黄色。回答下列问题:(1)“酸浸、还原”时,V2O5被还原为VO2+,该反应的离子方程式为
(2)“碱浸、氧化”过程中会生成VO2+,在20.00mL0.1mol·L-1VO
 溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为
溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为(3)“操作1”包括转沉、沉钒和过滤等步骤。
①“转沉”过程中先加石灰乳、再加(NH4)2CO3生成(NH4)3VO4。已知:Ksp(CaCO3)=m,Ksp[Ca3(VO4)2]=n;则反应Ca3(VO4)2(s)+3CO
 (aq)
(aq) 2VO
2VO (aq)+3CaCO3(s)的平衡常数为
(aq)+3CaCO3(s)的平衡常数为②“沉钒”时加NH4Cl生成NH4VO3,沉钒率随温度的变化如图1所示,温度高于80℃沉钒率下降的原因可能是

(4)有氧条件下,在V2O5的催化作用下NO可被NH3还原为N2。反应机理如图2所示。NO、NH3在有氧条件下的总反应化学方程式是

(5)测定产品中V2O5的纯度:称取2.000g产品用硫酸溶解得(VO2)2SO4溶液,加入50.00mL0.5000mol·L-1(NH4)2Fe(SO4)2溶液,发生的反应为VO
 +2H++Fe2+=VO2++Fe3++H2O,再用0.2000mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为5.00mL。已知MnO
+2H++Fe2+=VO2++Fe3++H2O,再用0.2000mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为5.00mL。已知MnO 被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是
您最近一年使用:0次
解答题-有机推断题
|
适中(0.65)
解题方法
16. 化合物G是一种重要的合成中间体,其合成路线如图:
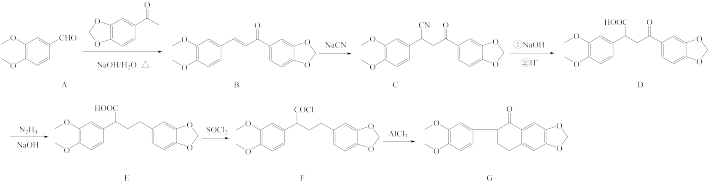
(1)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式____ 。
①遇FeCl3溶液显色
②能发生水解反应和银镜反应
③分子中不同化学环境的氢原子个数比是1∶1∶2∶6
(2)A→B的转化分两步完成,该过程可表示为A→X→B,则X的结构简式为____ 。
(3)D→E的反应类型为____ 。
(4)G分子中采取sp2杂化的碳原子数目是____ 。
(5)设计以 、CH3CHO为原料制备
、CH3CHO为原料制备 的合成路线
的合成路线____ 。(无机试剂和有机溶剂任用,合成路线示例见本题题干)。

(1)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式
①遇FeCl3溶液显色
②能发生水解反应和银镜反应
③分子中不同化学环境的氢原子个数比是1∶1∶2∶6
(2)A→B的转化分两步完成,该过程可表示为A→X→B,则X的结构简式为
(3)D→E的反应类型为
(4)G分子中采取sp2杂化的碳原子数目是
(5)设计以
 、CH3CHO为原料制备
、CH3CHO为原料制备 的合成路线
的合成路线
您最近一年使用:0次
解答题-工业流程题
|
适中(0.65)
解题方法
17. 实验室研究从炼铜烟灰(主要成分为CuO、Cu2O、ZnO、PbO等)中分别回收铜、铅元素的流程如图:

已知:Cu+在酸性环境中能转化为Cu和Cu2+。
(1)“酸浸”过程中,金属元素均由氧化物转化为硫酸盐,其中Cu2O生成CuSO4的化学方程式为_____ 。Cu2O粉末和Cu粉末外观均为红色,设计实验证明实验室制得的Cu粉中是否混有Cu2O____ 。
(2)“置换”过程中,铁屑加入初期反应速率迅速加快,其可能原因有:①反应放热,温度升高,速率加快,②____ ;铁屑完全消耗后,铜的产率随时间延长而下降,其可能的原因为____ 。
(3)已知:PbSO4、PbCl2均难溶于水,25℃时,PbSO4(s)+2Cl-(aq) PbCl2(s)+SO
PbCl2(s)+SO (aq)。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图所示。
(aq)。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图所示。

结合题给信息,请补充完整利用酸浸后的滤渣制备PbCl2晶体的实验方案:取一定量的滤渣,____ 。(可选用的试剂有:蒸馏水,5mol·L-1NaCl溶液,1mol·L-1NaCl溶液,NaCl固体)

已知:Cu+在酸性环境中能转化为Cu和Cu2+。
(1)“酸浸”过程中,金属元素均由氧化物转化为硫酸盐,其中Cu2O生成CuSO4的化学方程式为
(2)“置换”过程中,铁屑加入初期反应速率迅速加快,其可能原因有:①反应放热,温度升高,速率加快,②
(3)已知:PbSO4、PbCl2均难溶于水,25℃时,PbSO4(s)+2Cl-(aq)
 PbCl2(s)+SO
PbCl2(s)+SO (aq)。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图所示。
(aq)。一定条件下,在不同浓度的NaCl溶液中,温度对铅浸出率的影响、PbCl2的溶解度曲线分别如图所示。
结合题给信息,请补充完整利用酸浸后的滤渣制备PbCl2晶体的实验方案:取一定量的滤渣,
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
名校
解题方法
18. 硫化氢的转化是资源利用和环境保护的重要研究课题。
(1)工业上将含有硫化物的废水(以H2S、HS-、S2-的形式存在)引入氧化池,加入高锰酸钾溶液氧化。已知高锰酸钾在酸性条件下的还原产物为Mn2+,碱性条件下的为MnO2。
①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为____ 。
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因____ 。
(2)常温下,H2S的Ka1=1.3×10-7、Ka2=7.0×10-15,Ksp(MnS)=1.4×10-15。向含有0.0020mol·L-1Mn2+废水中通入一定量的H2S,当溶液的pH=a、c(HS-)=1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=____ 。
(3)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图1表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是____ 。
②若水膜过厚,H2S的氧化去除率减小的原因是____ 。
(4)甲硫醇是一种恶臭、有毒物质。生物法去除甲硫醇反应为2CH3SH+7O2=2CO2+2H2O+2H2SO4。研究表明,在H2S存在条件下,可改变甲硫醇(用 表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程____ 。
(1)工业上将含有硫化物的废水(以H2S、HS-、S2-的形式存在)引入氧化池,加入高锰酸钾溶液氧化。已知高锰酸钾在酸性条件下的还原产物为Mn2+,碱性条件下的为MnO2。
①pH>7时高锰酸钾将废水中的硫化物氧化为S,该反应的离子方程式为
②研究发现:其他条件相同时,废水呈酸性时硫化物的去除率明显大于呈碱性时去除率,则可能的原因
(2)常温下,H2S的Ka1=1.3×10-7、Ka2=7.0×10-15,Ksp(MnS)=1.4×10-15。向含有0.0020mol·L-1Mn2+废水中通入一定量的H2S,当溶液的pH=a、c(HS-)=1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
(3)表面喷淋水的活性炭可用于吸附氧化H2S,其原理可用图1表示。其它条件不变时,水膜的酸碱性与厚度会影响H2S的去除率。

①适当增大活性炭表面的水膜pH,H2S的氧化去除率增大的原因是
②若水膜过厚,H2S的氧化去除率减小的原因是
(4)甲硫醇是一种恶臭、有毒物质。生物法去除甲硫醇反应为2CH3SH+7O2=2CO2+2H2O+2H2SO4。研究表明,在H2S存在条件下,可改变甲硫醇(用
 表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
表示)生物降解途径,反应历程如图2所示,请用简洁的语言描述图中甲硫醇的降解过程
您最近一年使用:0次
2022-05-27更新
|
731次组卷
|
4卷引用:江苏省淮安市2022届高三下学期5月模拟测试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学反应原理、物质结构与性质、化学实验基础、有机化学基础
试卷题型(共 18题)
题型
数量
单选题
14
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氧化还原反应的规律 硫、氮氧化物对人体、环境的危害 酸雨 酸性氧化物的通性 吸热反应和放热反应 | |
| 2 | 0.94 | 原子、离子、原子团及其电子式的书写与判断 离子键 电子排布式 极性分子和非极性分子 | |
| 3 | 0.85 | 亚铁盐溶液蒸干灼烧 物质分离、提纯的常见物理方法 | |
| 4 | 0.85 | 氯气的用途 氨与氯化氢反应的实验 | |
| 5 | 0.85 | 元素周期律的应用 电离能变化规律 | |
| 6 | 0.85 | 二氧化氮与水反应 利用杂化轨道理论判断分子的空间构型 | |
| 7 | 0.85 | 自然界氮的固定 氨的还原性 一氧化氮的化学性质 二氧化氮与水反应 | |
| 8 | 0.65 | 催化剂对化学反应速率的影响 化学平衡的移动及其影响因素 化学平衡常数的概念及表达方式 化学反应自发过程 | |
| 9 | 0.65 | 温度对化学反应速率的影响 盐类双水解反应 萃取和分液 | |
| 10 | 0.85 | 常见官能团名称、组成及结构 分子的手性 醛类性质 | |
| 11 | 0.65 | 催化剂对化学反应速率的影响 淀粉、纤维素的水解 淀粉水解及其产物检验相关实验 常见分子晶体的结构 | |
| 12 | 0.65 | 电解原理的理解及判断 电解池电极反应式及化学方程式的书写与判断 | |
| 13 | 0.4 | 离子方程式的正误判断 电离平衡常数及影响因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 14 | 0.65 | 化学平衡的移动及其影响因素 化学平衡图像分析 转化率的相关计算及判断 | |
| 二、解答题 | |||
| 15 | 0.65 | 氧化还原反应方程式的配平 化学平衡的移动及其影响因素 化学平衡常数的有关计算 | 工业流程题 |
| 16 | 0.65 | 有机合成综合考查 | 有机推断题 |
| 17 | 0.65 | 氧化还原反应方程式的配平 影响化学反应速率的外因 化学实验基础操作 | 工业流程题 |
| 18 | 0.65 | 离子反应的发生及书写 化学反应原理综合考查 溶度积常数相关计算 | 原理综合题 |



