名校
1 . 回答下列问题
(1)过氧化钠与二氧化碳反应的化学方程式_____________ ,并用单线桥标出电子转移的方向和数目__________________ 。
(2)漂白粉的有效成分是______ (填化学式),制取漂白粉的化学方程式__________________ 。
(3)漂白粉长时间暴露在空气中就会失去效用,失效原因是(写出2个化学方程式)__________________ ;__________________ 。
(4)实验室用 制氯气的离子方程式
制氯气的离子方程式_______________ 。
(5)将钠投入到 溶液中,写出化学方程式
溶液中,写出化学方程式______________ 。
(6)除去碳酸钠中混有的碳酸氢钠应加入______ (填化学式)溶液,涉及到的反应的离子方程式为__________________ 。
(7)厨房里常用小苏打做糕点的发泡剂,写出其受热分解的化学方程式_________________ 。
(1)过氧化钠与二氧化碳反应的化学方程式
(2)漂白粉的有效成分是
(3)漂白粉长时间暴露在空气中就会失去效用,失效原因是(写出2个化学方程式)
(4)实验室用
 制氯气的离子方程式
制氯气的离子方程式(5)将钠投入到
 溶液中,写出化学方程式
溶液中,写出化学方程式(6)除去碳酸钠中混有的碳酸氢钠应加入
(7)厨房里常用小苏打做糕点的发泡剂,写出其受热分解的化学方程式
您最近一年使用:0次
名校
解题方法
2 . 下列有关 和
和 的性质比较正确的是
的性质比较正确的是
A.相同温度下,在水中的溶解性 |
B.相同温度下,等物质的量浓度的溶液中分别滴入酚酞,红色较深的是 |
C.1g碳酸钠和1g碳酸氢钠固体中分别加入几滴水后,测得温度较高的是 |
D.相同条件下,等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应产生 量较多的是Na2CO3 量较多的是Na2CO3 |
您最近一年使用:0次
名校
解题方法
3 . 碳酸钠是一种重要的无机化工原料,主要用于玻璃制品和陶瓷釉的生产,还广泛用于生活洗涤、酸类中和以及食品加工等。工业制碱法大致经历了如图所示的三个阶段。

Ⅰ.路布兰是开创化学工业的先驱者,路布兰制碱法是化工史上的一个里程碑。路布兰制碱法的反应原理如下:
①
②
③
(1)上述反应属于氧化还原反应的是_______ (填序号),该反应的还原产物为_______ (填化学式)。
(2)路布兰制碱法的缺点有_______ (写出一点即可)。
Ⅱ.1861年,比利时人欧内斯特·索尔维发明了以食盐、石灰石、氨气为原料制取碳酸钠的索尔维制碱法(又称氨碱法),其工业生产的简单流程如图所示。
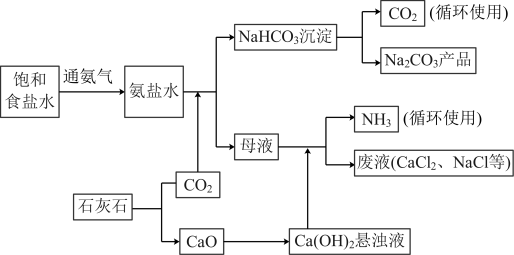
(3)上述流程涉及的物质中,属于酸性氧化物的是_______ (填化学式)。
(4)往饱和 溶液中持续通入
溶液中持续通入 ,写出其反应的离子方程式
,写出其反应的离子方程式_______ 。
Ⅲ.1943年左右我国著名科学家侯德榜先生克服困难,把合成氨工业和氨碱法制碱工业结合起来,发明了联合制碱法,也被人们称为“侯氏制碱法”,该方法大大提高了原料的利用率,其流程如图所示。

(5)已知氨气极易溶于水,该工艺中若先通入 后通入
后通入 和,可能造成的后果是
和,可能造成的后果是_______ 。
(6)煅烧时,发生反应的化学方程式为_______ 。
(7)提取的 产品中含有少量
产品中含有少量 ,将
,将 产品溶解,加入适量的稀盐酸和
产品溶解,加入适量的稀盐酸和 充分反应,煮沸、过滤、浓缩结晶,即可得到纯净的
充分反应,煮沸、过滤、浓缩结晶,即可得到纯净的 固体。加入稀盐酸和
固体。加入稀盐酸和 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

Ⅰ.路布兰是开创化学工业的先驱者,路布兰制碱法是化工史上的一个里程碑。路布兰制碱法的反应原理如下:
①

②

③

(1)上述反应属于氧化还原反应的是
(2)路布兰制碱法的缺点有
Ⅱ.1861年,比利时人欧内斯特·索尔维发明了以食盐、石灰石、氨气为原料制取碳酸钠的索尔维制碱法(又称氨碱法),其工业生产的简单流程如图所示。

(3)上述流程涉及的物质中,属于酸性氧化物的是
(4)往饱和
 溶液中持续通入
溶液中持续通入 ,写出其反应的离子方程式
,写出其反应的离子方程式Ⅲ.1943年左右我国著名科学家侯德榜先生克服困难,把合成氨工业和氨碱法制碱工业结合起来,发明了联合制碱法,也被人们称为“侯氏制碱法”,该方法大大提高了原料的利用率,其流程如图所示。

(5)已知氨气极易溶于水,该工艺中若先通入
 后通入
后通入 和,可能造成的后果是
和,可能造成的后果是(6)煅烧时,发生反应的化学方程式为
(7)提取的
 产品中含有少量
产品中含有少量 ,将
,将 产品溶解,加入适量的稀盐酸和
产品溶解,加入适量的稀盐酸和 充分反应,煮沸、过滤、浓缩结晶,即可得到纯净的
充分反应,煮沸、过滤、浓缩结晶,即可得到纯净的 固体。加入稀盐酸和
固体。加入稀盐酸和 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
2024-03-14更新
|
58次组卷
|
2卷引用:2024年广西南宁、柳州等地示范性高中高一下学期3月开学考调研测试 化学试题
名校
解题方法
4 . 下列所选仪器或操作符合实验要求的是
A | B | C | D |
|
|
|
|
比较 | 配制一定物质的量浓度的 | 检验干燥 | 测定醋酸溶液的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-02-12更新
|
264次组卷
|
2卷引用:广西南宁市2023-2024学年高一上学期教学质量调研(期末)考试化学试题
名校
5 . 下列实验装置或操作正确且能达到预期目的的是
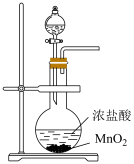 | 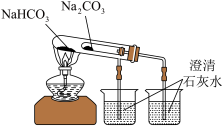 |
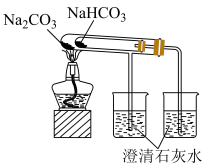
| A.实验室制取氯气 | B.比较 和 和 热稳定性 热稳定性 |
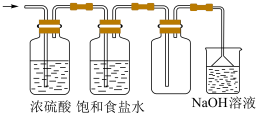 | 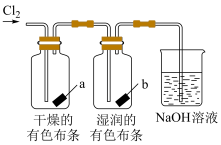 |
C.收集干燥纯净的 | D.验证氯气是否具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . Ⅰ.家庭厨卫用品中有许多常见的化学物质,括号内为其主要成分:
①料酒(乙醇);②食醋(乙酸);③碱面( );④小苏打(
);④小苏打( );⑤84消毒液(
);⑤84消毒液( ):⑥洁厕灵(
):⑥洁厕灵( );⑦铁锅(
);⑦铁锅( )
)
(1)乙醇的化学式为 ,属于
,属于______ (填“纯净物”或“混合物”)。
(2)用铁锅炒菜时,不宜加入过多的食醋,原因是:______ 。
(3)小苏打常用作面食的膨松剂,请用化学方程式说明原理______ 。
(4)家庭中不可将84消毒液与洁厕灵混用,否则会因产生一种有毒气体,请用离子方程式解释原因______ 。
Ⅱ.亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
(5)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素 可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是______。
可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是______。
(6)已知 能发生如下反应:
能发生如下反应: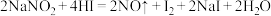 ,该反应的还原产物是
,该反应的还原产物是______ , 体现出的性质有
体现出的性质有______ 。请标出该反应的电子转移方向和数目______ 。
①料酒(乙醇);②食醋(乙酸);③碱面(
 );④小苏打(
);④小苏打( );⑤84消毒液(
);⑤84消毒液( ):⑥洁厕灵(
):⑥洁厕灵( );⑦铁锅(
);⑦铁锅( )
)(1)乙醇的化学式为
 ,属于
,属于(2)用铁锅炒菜时,不宜加入过多的食醋,原因是:
(3)小苏打常用作面食的膨松剂,请用化学方程式说明原理
(4)家庭中不可将84消毒液与洁厕灵混用,否则会因产生一种有毒气体,请用离子方程式解释原因
Ⅱ.亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。(5)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素
 可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是______。
可解除亚硝酸钠的中毒,下列关于上述中毒。解毒过程的说法中,正确的是______。| A.亚硝酸钠是还原剂 | B.维生素 是氧化剂 是氧化剂 |
C.维生素 能把铁离子还原成为亚铁离子 能把铁离子还原成为亚铁离子 | D.亚硝酸钠被还原 |
 能发生如下反应:
能发生如下反应: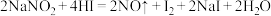 ,该反应的还原产物是
,该反应的还原产物是 体现出的性质有
体现出的性质有
您最近一年使用:0次
名校
7 . 下列各实验的操作、现象及所得出的结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向NaOH溶液中滴加饱和 溶液并加热 溶液并加热 | 溶液变为红褐色 | 生成 胶体 胶体 |
| B | 向 溶液中投入绿豆大小的Na 溶液中投入绿豆大小的Na | 有红色固体析出 | 还原性:Na>Cu |
| C | 向酚酞溶液中加入少量 固体 固体 | 溶液先变红后褪色 | 该反应中有碱生成, 有漂白性 有漂白性 |
| D | 向饱和 溶液中通入足量 溶液中通入足量 | 有白色固体析出 | 溶解度: |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 . 化学与生产、生活息息相关,下列表述错误的是
| A.江河入海口三角洲的形成与胶体的聚沉有关 |
| B.贝壳煅烧后加水制备石灰乳的过程不涉及氧化还原反应 |
| C.漂白衣物时,加几滴食醋与漂白液一起使用效果更好 |
| D.常用苏打缓解胃酸过多导致的烧心症状 |
您最近一年使用:0次
名校
9 . 回答下列问题。
(1)标况下,0.1mol 所占的体积约为
所占的体积约为_______ L,所含的电子总数约为________ 个。
(2)从400mL2.0mol/L的 溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中
溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中 的物质的量浓度为
的物质的量浓度为___________ mol/L。
(3) 和
和 组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中
组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中 的质量分数为
的质量分数为___________ %[保留小数点后1位]。
(4)常温常压下,某钢性瓶充满 气体时质量为273.90g,改充满
气体时质量为273.90g,改充满 则质量为275.50g。若充满
则质量为275.50g。若充满 则质量是
则质量是___________ g[保留小数点后2位]。
(5)往100mL4.0mol/L的NaOH溶液中缓缓地通入2.24L 气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为___________ 。
(1)标况下,0.1mol
 所占的体积约为
所占的体积约为(2)从400mL2.0mol/L的
 溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中
溶液中取出20mL,将这20mL加水稀释到100mL,所得的溶液中 的物质的量浓度为
的物质的量浓度为(3)
 和
和 组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中
组成的固体混合物40.0g加热至质量不再变化,冷却干燥后称得残余固体质量为33.8g,则原固体混合物中 的质量分数为
的质量分数为(4)常温常压下,某钢性瓶充满
 气体时质量为273.90g,改充满
气体时质量为273.90g,改充满 则质量为275.50g。若充满
则质量为275.50g。若充满 则质量是
则质量是(5)往100mL4.0mol/L的NaOH溶液中缓缓地通入2.24L
 气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
气体(标况),若忽略溶液体积的变化,所得溶液的溶质及其物质的量浓度分别为
您最近一年使用:0次
名校
10 . 由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。
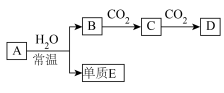
(1)若A为金属钠,则E为_______ ,A与水反应的离子方程式为_______ 。
(2)若A为过氧化钠,则E为_______ ,A与水反应的化学方程式为_______ 。
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是_______ 。
(4)写出侯氏制碱法中两个重要的化学方程式_______ ;_______ ;
(5)下列鉴别C和D的方案中,合理的是_______ ;
①取等量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是Na2CO3
②取等量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
③取等量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
④取等量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3

(1)若A为金属钠,则E为
(2)若A为过氧化钠,则E为
(3)A不论是Na还是Na2O2,依据转化关系判断物质D是
(4)写出侯氏制碱法中两个重要的化学方程式
(5)下列鉴别C和D的方案中,合理的是
①取等量的溶液于两支试管中,逐滴加入稀盐酸,开始就有气体放出的是Na2CO3
②取等量的溶液于两支试管中,加热,有气泡产生的是NaHCO3
③取等量的溶液于两支试管中,滴加BaCl2溶液,生成白色沉淀的是Na2CO3
④取等量的溶液于两支试管中,滴加Ba(OH)2溶液,生成白色沉淀的是Na2CO3
您最近一年使用:0次




 溶液
溶液


