解题方法
1 . Ⅰ.某小组同学探究Na2CO3的性质。
(1)用Na2CO3固体配制100 mL 0.200 mol·L-1Na2CO3溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和___________ 。
②计算需要Na2CO3固体的质量是___________ g。
③下列情况中,会使所配溶液浓度偏高的是___________ (填字母)。
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)探究Na2CO3与盐酸的反应。向0.200 mol·L-1Na2CO3溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为: +H+=
+H+= 、
、___________ 。
Ⅱ.某化学兴趣小组设计如下实验探究KMnO4固体与草酸(H2C2O4,具有还原性)反应的产物,以其产物为原料制备氯气:
室温下,取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀产生,溶液变为无色,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭。
分析实验并回答相应问题。
(3)M的化学式是___________ 。
(4)将充分反应后的混合物过滤,检验滤液中金属阳离子的方法及现象为___________ 、___________ 。向滤液中加入盐酸时又产生无色无味气体。
(5)将滤渣加入浓盐酸中加热,产生黄绿色气体,该反应的离子方程式为___________ 。
(1)用Na2CO3固体配制100 mL 0.200 mol·L-1Na2CO3溶液。
①用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
②计算需要Na2CO3固体的质量是
③下列情况中,会使所配溶液浓度偏高的是
a.转移时,没有洗涤烧杯和玻璃棒
b.定容时,眼睛俯视刻度线
c.摇匀后,发现液面低于刻度线,继续加水至液面与刻度线相切
(2)探究Na2CO3与盐酸的反应。向0.200 mol·L-1Na2CO3溶液中滴加稀盐酸,开始无气泡,继续滴加,产生气泡,反应的离子方程式为:
 +H+=
+H+= 、
、Ⅱ.某化学兴趣小组设计如下实验探究KMnO4固体与草酸(H2C2O4,具有还原性)反应的产物,以其产物为原料制备氯气:
室温下,取KMnO4固体于锥形瓶中,加入适量的草酸(H2C2O4)溶液,振荡,充分反应,可以观察到有黑色沉淀产生,溶液变为无色,同时生成无色无味的气体M,将燃着的木条靠近锥形瓶瓶口时木条熄灭。
分析实验并回答相应问题。
(3)M的化学式是
(4)将充分反应后的混合物过滤,检验滤液中金属阳离子的方法及现象为
(5)将滤渣加入浓盐酸中加热,产生黄绿色气体,该反应的离子方程式为
您最近一年使用:0次
名校
2 . 钠的一系列化合物在生活与生产中有非常重要的作用,某学习小组开展了相关研究活动:
(1)甲同学欲配制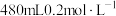 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有____________ 、烧杯和胶头滴管;下列操作会使所配溶液浓度偏小的是______ 。
a.用托盘天平称量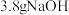 固体进行配制溶液
固体进行配制溶液
b.定容时俯视刻度线
c.未待溶解的 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作
d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
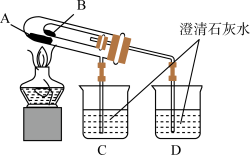
① 烧杯中的现象是
烧杯中的现象是____________
② 处应放置的药品是
处应放置的药品是____________
③热稳定性:
______  (大于、小于)
(大于、小于)
(3)丙同学为探究 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
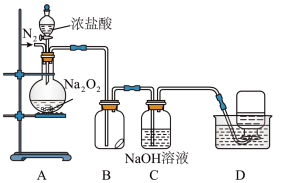
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。
Ⅱ.待产生连续气泡后,将装置 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。
①. 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:______ 。
②.资料显示, 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式______
(1)甲同学欲配制
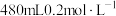 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有a.用托盘天平称量
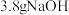 固体进行配制溶液
固体进行配制溶液b.定容时俯视刻度线
c.未待溶解的
 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较
 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
①
 烧杯中的现象是
烧杯中的现象是②
 处应放置的药品是
处应放置的药品是③热稳定性:

 (大于、小于)
(大于、小于)(3)丙同学为探究
 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的
 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。Ⅱ.待产生连续气泡后,将装置
 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。①.
 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:②.资料显示,
 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式
您最近一年使用:0次
解题方法
3 . 钠元素在自然界中分布很广,储量极为丰富,都以化合态存在,如氯化钠、碳酸钠、硫酸钠等。钠单质和钠的化合物在生产、生活中被广泛应用。请根据钠及其化合物性质按要求完成各题。
(1)钠原子在周期表中的位置为___________ ,钠离子的结构示意图___________ 。
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有___________ (填化学式,下同),既含有离子键又含有共价键的有___________ ,只含共价键的有___________ 。
(3)钠的化学性质活泼,暴露在空气中生成___________ 色Na2O,在空气中加热,生成___________ 色的Na2O2,Na2O2可用作呼吸面具、潜水艇的供氧剂,写出Na2O2和CO2反应的化学方程式:___________ 。
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
(5)下列有关物质的性质描述正确的是____。
(6)Na2CO3和NaHCO3是常见的钠盐,且两者之间可以相互转化,请回答下列问题:
①下列有关碳酸钠和碳酸氢钠的说法正确的是____ 。
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式___________ ;
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为___________ ;
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为____ 。
A.42% B.44% C.56% D.58%
(1)钠原子在周期表中的位置为
(2)请选择下列物质中合适的物质,按要求填空:
NaOH、 CaCl2 、 SO2 、H2O 、 NH4Cl
只含有离子键的有
(3)钠的化学性质活泼,暴露在空气中生成
(4)钠能在冷水中剧烈反应,该反应的实验现象中描述错误的是____。
| A.钠熔化成银白色小球 | B.钠在水面上迅速游动 |
| C.发出嘶嘶的声响 | D.溶液逐渐变红色 |
| A.钠与氧气反应时的产物主要取决于氧气的用量及纯度 |
| B.钠投入硫酸铜溶液中有气体和蓝色沉淀产生 |
| C.Na2O和Na2O2分别溶于水中,所得的产物相同 |
| D.FeCl3溶液用于铜质印刷线路制作,原因是两者发生置换反应 |
①下列有关碳酸钠和碳酸氢钠的说法正确的是
A.热稳定性:Na2CO3<NaHCO3
B.溶于水后,碳酸钠溶液呈碱性,碳酸氢钠溶液呈酸性
C.相同条件下,与同种酸反应的剧烈程度:Na2CO3<NaHCO3
D.石碱风化是物理过程
②写出Na2CO3在水溶液中的电离方程式
③向Na2CO3溶液中通入CO2可生成NaHCO3,该反应的化学方程式为
④加热15.0g碳酸钠和碳酸氢钠的固体混合物至质量不再发生变化,剩余固体的质量为11.9g,则混合物中碳酸氢钠的质量分数为
A.42% B.44% C.56% D.58%
您最近一年使用:0次
名校
解题方法
4 . Na2CO3和NaHCO3是两种重要的化工原料,二者的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
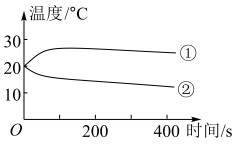
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)______ 。
(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是___________ ;滴加NaHCO3溶液的烧杯中开始时发生反应的离子方程式为:___________ 。(提示:溶液pH越小,OH-的浓度越小,溶液碱性越弱。)

(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),_____ 。经分析,上述方案存在缺陷(假定固体充分反应),会导致测定结果偏小,原因可能为:________ 。利用改进装置进行实验,ag样品加热至恒重后,称量所得固体质量为bg,则样品中NaHCO3质量分数为____ %(用含a、b的代数式表示)。
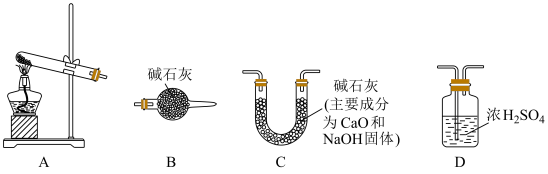
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)

(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是

(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),

您最近一年使用:0次
解题方法
5 . Na2CO3可用于纺织、制肥皂、造纸、制玻璃等,NaHCO3可用于制药、焙制糕点等,两者都是白色固体;某实验小组通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各 2g,分别放入两个小烧杯中,再各滴加 10mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加 2 滴酚酞试液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论___________ 。
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3 的烧杯中出现的现象:
I.溶液温度升高;
Ⅱ.滴入酚酞后溶液呈___________ 色。
(2)“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题:
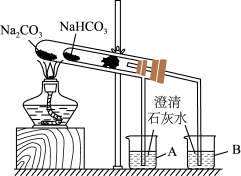
①整个实验过程中,能观察到烧杯 B 中的现象是___________ 。
②写出实验过程中试管中发生反应的化学方程式:___________ 。
③该实验可证明 NaHCO3 的热稳定性___________ (填“强于”“弱于”或“等于”)Na2CO3;证明热稳定性的实验装置中,能否将 NaHCO3、Na2CO3的位置互换?___________ (填“能”或“不能”)。
(3)能用来鉴别 Na2CO3 和 NaHCO3 两种白色固体的实验操作是___________ 。
A.将Na2CO3和NaHCO3 配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.分别加热两种固体样品,看固体是否全部分解挥发
C.分别在这两种物质的溶液中,加入少量NaCl溶液
(1)称取两种固体各 2g,分别放入两个小烧杯中,再各滴加 10mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴加 2 滴酚酞试液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论
②同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3 的烧杯中出现的现象:
I.溶液温度升高;
Ⅱ.滴入酚酞后溶液呈
(2)“套管实验”的实验装置如图所示,请分析实验原理,并回答下列问题:

①整个实验过程中,能观察到烧杯 B 中的现象是
②写出实验过程中试管中发生反应的化学方程式:
③该实验可证明 NaHCO3 的热稳定性
(3)能用来鉴别 Na2CO3 和 NaHCO3 两种白色固体的实验操作是
A.将Na2CO3和NaHCO3 配制成同浓度的溶液,用pH试纸测定pH值并做比较
B.分别加热两种固体样品,看固体是否全部分解挥发
C.分别在这两种物质的溶液中,加入少量NaCl溶液
您最近一年使用:0次
名校
解题方法
6 . 某学习小组根据侯氏制碱原理(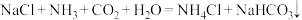 )制备少量
)制备少量 的流程如下:
的流程如下:

回答下列问题:
(1)流程中涉及的食盐水、二氧化碳和碳酸钠,其中属于电解质的有___________ 种。该流程中由 制
制 的化学方程式为
的化学方程式为___________ 。
(2)取过滤、洗涤、干燥后得到的 和煅烧得到的
和煅烧得到的 各0.9g分别放入如图所示的装置中。
各0.9g分别放入如图所示的装置中。

①某同学忘记贴上标签,如果采用下列实验,可以判断出装置中物质的实验有___________ (填字母)。
a.用针筒分别打入滴有酚酞的 水,用力振荡
水,用力振荡
b.用针筒分别打入少量的氢氧化钡溶液
③用针筒先分别滴入 的水,溶解后再分别滴入少量的稀盐酸,装置
的水,溶解后再分别滴入少量的稀盐酸,装置 和
和 中发生反应的离子方程式分别是
中发生反应的离子方程式分别是___________ ;在相同的温度和压强下,若分别加入过量的稀盐酸,则两装置中气球体积较大的是___________ (填序号)。
 )制备少量
)制备少量 的流程如下:
的流程如下:
回答下列问题:
(1)流程中涉及的食盐水、二氧化碳和碳酸钠,其中属于电解质的有
 制
制 的化学方程式为
的化学方程式为(2)取过滤、洗涤、干燥后得到的
 和煅烧得到的
和煅烧得到的 各0.9g分别放入如图所示的装置中。
各0.9g分别放入如图所示的装置中。
①某同学忘记贴上标签,如果采用下列实验,可以判断出装置中物质的实验有
a.用针筒分别打入滴有酚酞的
 水,用力振荡
水,用力振荡b.用针筒分别打入少量的氢氧化钡溶液
③用针筒先分别滴入
 的水,溶解后再分别滴入少量的稀盐酸,装置
的水,溶解后再分别滴入少量的稀盐酸,装置 和
和 中发生反应的离子方程式分别是
中发生反应的离子方程式分别是
您最近一年使用:0次
名校
解题方法
7 . Ⅰ. 和
和 是两种常见的钠盐。
是两种常见的钠盐。
向 和
和 的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
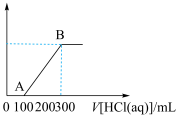
(1)OA段发生反应的离子方程式:________ 。
(2)原溶液中碳酸钠和碳酸氢钠的物质的量之比为_______ 。
Ⅱ.实验室中需0.2 mol/L的 溶液80 mL,请回答下列问题。
溶液80 mL,请回答下列问题。
(3)配制上述溶液所需的玻璃 仪器有:玻璃棒、烧杯和______ ,用托盘天平称取 固体,其质量是
固体,其质量是_______ g。
(4)实验时下图所示操作的先后顺序为______ (填编号)。
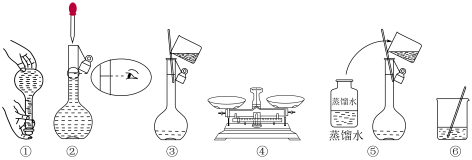
(5)取用任意体积的该 溶液时,下列物理量不随所取体积的多少而变化的是
溶液时,下列物理量不随所取体积的多少而变化的是______ 。
a.溶液中 的物质的量 b.溶液的浓度
的物质的量 b.溶液的浓度
c.溶液中 的数目 d.溶液的密度
的数目 d.溶液的密度
(6)下列操作中,会造成溶液浓度有何变化(填偏高,偏低,无影响)。
①定容时,俯视刻度线________ 。
②没有洗涤烧杯和玻璃棒_______ 。
③配制前容量瓶中残留少量蒸馏水______ 。
④摇匀后,发现液面低于刻度线_______ 。
⑤用天平称量时, 和砝码位置放颠倒了
和砝码位置放颠倒了_____ 。
⑥未冷却至室温就开始定容________ 。
(7)若需要0.05mol/L的 ,可用量筒量取
,可用量筒量取____ mL所配 溶液。
溶液。
 和
和 是两种常见的钠盐。
是两种常见的钠盐。向
 和
和 的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
的混合溶液中逐滴滴加盐酸,所得气体的体积与所加盐酸的体积关系如图所示。
(1)OA段发生反应的离子方程式:
(2)原溶液中碳酸钠和碳酸氢钠的物质的量之比为
Ⅱ.实验室中需0.2 mol/L的
 溶液80 mL,请回答下列问题。
溶液80 mL,请回答下列问题。(3)配制上述溶液所需的
 固体,其质量是
固体,其质量是(4)实验时下图所示操作的先后顺序为

(5)取用任意体积的该
 溶液时,下列物理量不随所取体积的多少而变化的是
溶液时,下列物理量不随所取体积的多少而变化的是a.溶液中
 的物质的量 b.溶液的浓度
的物质的量 b.溶液的浓度c.溶液中
 的数目 d.溶液的密度
的数目 d.溶液的密度(6)下列操作中,会造成溶液浓度有何变化(填偏高,偏低,无影响)。
①定容时,俯视刻度线
②没有洗涤烧杯和玻璃棒
③配制前容量瓶中残留少量蒸馏水
④摇匀后,发现液面低于刻度线
⑤用天平称量时,
 和砝码位置放颠倒了
和砝码位置放颠倒了⑥未冷却至室温就开始定容
(7)若需要0.05mol/L的
 ,可用量筒量取
,可用量筒量取 溶液。
溶液。
您最近一年使用:0次
2024-02-14更新
|
64次组卷
|
2卷引用:新疆乌鲁木齐市第十一中学2023-2024学年高一上学期1月期末化学试题
名校
8 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。
Ⅰ.如图为联合制碱法的主要过程(部分物质已略去):

(1)根据上述流程图,将化学方程式补充完整:______ 。
NH3+CO2+______+______=NaHCO3↓+______。
(2)上述联合制碱法流程可以循环使用的中一种物质是______ (填化学式)。
Ⅱ.某小组利用下列装置对Na2CO3和NaHCO3的性质进行探究(夹持装置已略去,气密性已检查)。

(3)方框中为洗气装置,请将该装置图补充完整______ 。
(4)试剂a为饱和NaHCO3溶液,其作用是______ 。
(5)实验持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因______ 。
Ⅰ.如图为联合制碱法的主要过程(部分物质已略去):

(1)根据上述流程图,将化学方程式补充完整:
NH3+CO2+______+______=NaHCO3↓+______。
(2)上述联合制碱法流程可以循环使用的中一种物质是
Ⅱ.某小组利用下列装置对Na2CO3和NaHCO3的性质进行探究(夹持装置已略去,气密性已检查)。

(3)方框中为洗气装置,请将该装置图补充完整
(4)试剂a为饱和NaHCO3溶液,其作用是
(5)实验持续一段时间后,观察到饱和Na2CO3溶液中有细小晶体析出,用化学方程式表示产生细小晶体的原因
您最近一年使用:0次
2024-02-11更新
|
84次组卷
|
2卷引用:四川省泸州市叙永第一中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
9 .  和
和 是厨房中常见的两种盐。
是厨房中常见的两种盐。
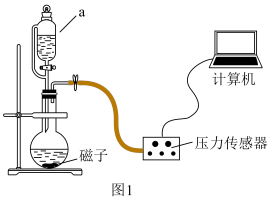
Ⅰ.某学生使用传感器进行如下实验(装置如图1),实验数据如图2:

i.向反应器中加入 的
的 溶液,逐滴滴加
溶液,逐滴滴加  的盐酸溶液。
的盐酸溶液。
ii.向反应器中加入 溶液,逐滴滴加一定体积的
溶液,逐滴滴加一定体积的  的盐酸溶液。
的盐酸溶液。
(1)若用无水碳酸钠来配制 的
的 溶液,需在
溶液,需在___________ (填仪器名称)上称取___________  无水碳酸钠。
无水碳酸钠。
(2)配制上述溶液用到的“容量瓶”是___________。
(3)定容操作时:沿着玻璃棒向容量瓶中加水至___________ 处,改用胶头滴管继续滴加水至凹液面最低处与刻度线相平,盖好瓶塞,颠倒摇匀。
(4)实验i中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前 采集的数据如图所示,结合离子方程式用文字表述原因
采集的数据如图所示,结合离子方程式用文字表述原因___________ 。
(5)实验ii为实验i的对照实验,根据图2信息,反应器中加入 溶液,其体积和浓度对应数值最合适的是
溶液,其体积和浓度对应数值最合适的是___________ 。
A.40、0.4 B.20、0.4 C.20、0.2
(6)利用如图3实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的为___________ 。

a. B.NaHCO3
B.NaHCO3
Ⅱ.如图4所示,此装置可用来制备 并验证其还原性,填写下列空白:
并验证其还原性,填写下列空白:
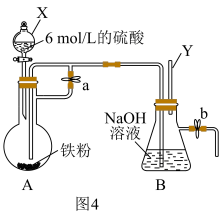
(7)检验反应后圆底烧瓶中是否有 生成所需试剂为
生成所需试剂为___________
(8)实验完毕,B瓶中产生 ,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)___________ ,现象:___________ 。
 和
和 是厨房中常见的两种盐。
是厨房中常见的两种盐。Ⅰ.某学生使用传感器进行如下实验(装置如图1),实验数据如图2:


i.向反应器中加入
 的
的 溶液,逐滴滴加
溶液,逐滴滴加  的盐酸溶液。
的盐酸溶液。ii.向反应器中加入
 溶液,逐滴滴加一定体积的
溶液,逐滴滴加一定体积的  的盐酸溶液。
的盐酸溶液。(1)若用无水碳酸钠来配制
 的
的 溶液,需在
溶液,需在 无水碳酸钠。
无水碳酸钠。(2)配制上述溶液用到的“容量瓶”是___________。
A. | B. | C.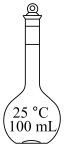 | D.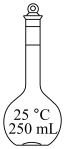 |
(3)定容操作时:沿着玻璃棒向容量瓶中加水至
(4)实验i中,当碳酸钠溶液与盐酸开始发生反应,压力传感器前
 采集的数据如图所示,结合离子方程式用文字表述原因
采集的数据如图所示,结合离子方程式用文字表述原因(5)实验ii为实验i的对照实验,根据图2信息,反应器中加入
 溶液,其体积和浓度对应数值最合适的是
溶液,其体积和浓度对应数值最合适的是A.40、0.4 B.20、0.4 C.20、0.2
(6)利用如图3实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的为

a.
 B.NaHCO3
B.NaHCO3Ⅱ.如图4所示,此装置可用来制备
 并验证其还原性,填写下列空白:
并验证其还原性,填写下列空白:
(7)检验反应后圆底烧瓶中是否有
 生成所需试剂为
生成所需试剂为(8)实验完毕,B瓶中产生
 ,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
,为验证其还原性,打开b处止水夹,充入一段时间空气,此时B瓶中发生的反应为(写化学方程式)
您最近一年使用:0次
解题方法
10 . 课外兴趣小组的同学探究Na2CO3和NaHCO3的性质,并测定混合物中NaHCO3的含量。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_____________ 。
(2)该实验_____________ (填“能”或“不能”)说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是_____________ 。
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:_____________ 。
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定
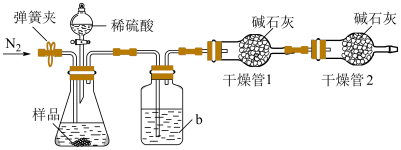
实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是_________________ (填名称)。
②第一次通入N2的目的是_________________ 。第二次通入N2的目的是_________________ 。如果没有进行第一次通N2的操作,测量的结果将会_________________ (填“偏大”“偏小”或“不变”)。
③计算出混合物中NaHCO3的质量分数为_________________ %(保留1位小数)。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
| 序号 | 实验操作 | 实验现象 | |
| ① | 在两支试管中分别加入1gNa2CO3、NaHCO3,再加入5mL水,充分振荡;用温度计测量两试管中溶液温度的变化 | Na2CO3 | NaHCO3 |
| 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 | ||
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液变微红 |
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是
(2)该实验
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
| 实验操作 | 实验数据 |
测量如下实验过程的pH变化  | 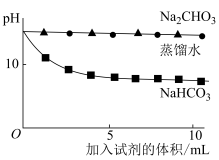 |
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定

实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是
②第一次通入N2的目的是
③计算出混合物中NaHCO3的质量分数为
您最近一年使用:0次



