名校
解题方法
1 . 氧化镁是优质的耐高温材料。某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备氧化镁的流程如图:
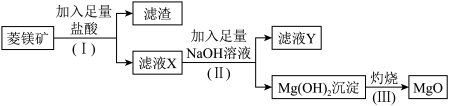
(1)步骤(Ⅰ)中分离操作的名称是___________ ;
(2)步骤(I)分离出的滤渣中主要含有_______ ,它属于______ (填“酸性”或“碱性”)氧化物;
(3)滤液Y中的阴离子除了含OH-、Cl-外还有___________ ;
(4)写出步骤(II)生成Mg(OH)2的离子方程式:_________ 。

(1)步骤(Ⅰ)中分离操作的名称是
(2)步骤(I)分离出的滤渣中主要含有
(3)滤液Y中的阴离子除了含OH-、Cl-外还有
(4)写出步骤(II)生成Mg(OH)2的离子方程式:
您最近一年使用:0次
2020-11-23更新
|
233次组卷
|
4卷引用:福建省南平市高级中学2020-2021学年高二上学期期中考试化学(会考)试题
2 . 根据下列实验操作和现象得出的结论正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 向CuSO4溶液中通入适量H2S气体 | 有黑色沉淀生成 | 酸性:H2S>H2SO4 |
| B | 将MgSO4溶液与足量的NaOH溶液混合 | 有白色沉淀生成 | Mg(OH)2不溶于强碱 |
| C | 向待测液中加入适量的浓氢氧化钠溶液并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变蓝色 | 待测液中含有NH |
| D | 向Fe(NO3)3溶液中加入HI溶液,再加入苯,振荡、静置 | 上层溶液呈紫红色,下层溶液呈黄色 | 氧化性:Fe3+>I2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-17更新
|
421次组卷
|
2卷引用:海南省2021-2022学年高三上学期学业水平诊断考试化学试题
3 . 下列有关物质的性质与用途具有对应关系的是
A.浓硫酸具有脱水性,可用于干燥 |
| B.维生素C具有还原性,可用于鲜榨的果汁保鲜 |
| C.氧化镁难溶于水,可用作阻燃材料 |
| D.次氯酸钠呈碱性,可用作染料等有机色素的漂白剂 |
您最近一年使用:0次
2019高三·全国·专题练习
4 . 某兴趣小组根据镁与沸水的反应推测镁也能与饱和碳酸氢钠溶液反应。资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。该兴趣小组设计了如下实验方案验证产物并探究反应原理。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变为红色。
(1)该小组对反应中产生的白色不溶物作出如下假设:
假设1:可能为_______________________________________ 。
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证假设:
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20 g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中,装置A增重0.36 g,装置B增重2.64 g,则白色不溶物的化学式为________ 。
实验Ⅰ:用砂纸擦去镁条表面氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红色变为红色。
(1)该小组对反应中产生的白色不溶物作出如下假设:
假设1:可能为
假设2:可能为MgCO3。
假设3:可能是碱式碳酸镁[xMgCO3·yMg(OH)2]。
(2)设计定性实验确定产物并验证假设:
| 实验序号 | 实验 | 预期现象和结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 | 产生气泡,沉淀全部溶解;白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2溶液 | 产生白色沉淀;说明溶液中存在的离子有 |
(3)设计定量实验确定实验Ⅰ的产物:称取实验Ⅰ中所得干燥、纯净的白色不溶物6.20 g,充分加热灼烧至不再产生气体为止,并使分解产生的气体全部进入装置A(盛足量浓硫酸)和B(盛足量碱石灰)中,装置A增重0.36 g,装置B增重2.64 g,则白色不溶物的化学式为
您最近一年使用:0次
名校
5 . 纳米氧化镁是在磁性、催化方面有许多特异功能的新材料,具有重要价值。工业以菱镁矿(主要成分为MgCO3,少量FeCO3和SiO2杂质)为原料制备纳米氧化镁工艺流程如图:
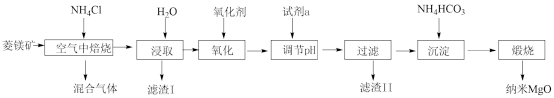
试回答下列问题:
(1)“焙烧”时生成的主要气体有___________ ;滤渣I的主要成分为___________ 。
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
上述流程中“氧化”的目的是___________ 。氧化剂常用空气或H2O2而不选用酸性KMnO4,解释其原因___________ 。
(3)试剂a可能是___________ 。
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是___________ 。
(5)该流程中可以循环利用的物质是___________ 。

试回答下列问题:
(1)“焙烧”时生成的主要气体有
(2)已知在该条件下金属离子开始沉淀和完全沉淀的pH如表:
| 金属离子 | Fe2+ | Fe3+ | Mg2+ |
| 开始沉淀pH | 6.3 | 1.5 | 8.9 |
| 完全沉淀pH | 8.1 | 2.8 | 10.9 |
(3)试剂a可能是
(4)资料显示煅烧MgCO3比煅烧Mg(OH)2更容易生成MgO纳米材料。“沉淀”时若将NH4HCO3更换成Na2CO3,则产生的后果是
(5)该流程中可以循环利用的物质是
您最近一年使用:0次
6 . 小强同学观看体操和举重比赛时,注意到运动员上场前都要在手上抹一些称为“镁粉”的白色粉末。小强和化学兴趣小组的同学一起探究“镁粉”的组成。
【提出猜想】①是金属镁的粉末;②是氧化镁;③是碳酸镁;④是氢氧化镁。大家一致认为猜想______ 是错误的,原因是______________________________ 。
【收集资料】氧化镁、碳酸镁和氢氧化镁都是白色粉末,三种物质几乎都不溶于水。其中,碳酸镁有很强的吸湿作用。
请你选取一种猜想,设计实验进行验证。你选的猜想是:________ ;设计实验:___________ 。
【提出猜想】①是金属镁的粉末;②是氧化镁;③是碳酸镁;④是氢氧化镁。大家一致认为猜想
【收集资料】氧化镁、碳酸镁和氢氧化镁都是白色粉末,三种物质几乎都不溶于水。其中,碳酸镁有很强的吸湿作用。
请你选取一种猜想,设计实验进行验证。你选的猜想是:
您最近一年使用:0次
名校
解题方法
7 . 下列物质的性质与应用关系的描述不正确的是
| A.氧化镁的熔点高,可用作耐高温材料 |
| B.金属钠具有还原性,可从CuSO4溶液中置换出铜 |
| C.过氧化钠有漂白性,可用于漂白纸浆及草帽等编织物 |
| D.碳酸钠溶液显碱性,其热溶液可除去物品表面的油污 |
您最近一年使用:0次
8 . 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________ ;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:
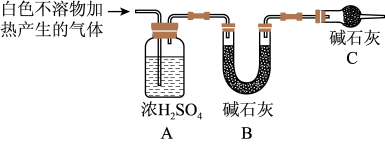
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________ ;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________ 。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 | 白色不溶物可能含有猜测2中不溶物 | |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:
您最近一年使用:0次
2016-12-09更新
|
586次组卷
|
3卷引用:2014年化学高考题型专练十八 探究型综合实验题练习卷
名校
9 . 下列有关物质的性质与用途具有对应关系的是
| A.SO2具有氧化性,可用于漂白纸张 | B.明矾易溶于水,可用作净水剂 |
| C.金属钠具有还原性,可用于高压钠灯 | D.MgO熔点高,可用于制作耐火材料 |
您最近一年使用:0次
2021-09-24更新
|
708次组卷
|
3卷引用:江苏省昆山市周市高级中学2020-2021学年高一上学期第二次模块测试化学试题
10 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
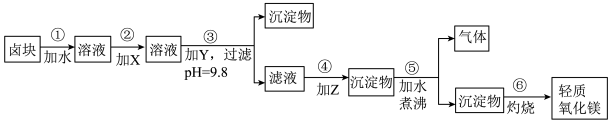
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
(1)在步骤②中加入的试剂X,最佳的选择是____________ ,其作用是_________________ ;
(2)在步骤③中加入的试剂应是_______________________ ;之所以要控制pH=9.8,其目的是___________________________________________________________ 。
(3)在步骤④中加入的试剂Z应是________________ ;
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________ 。

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6﹡ |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格/(元·吨-1) |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤③中加入的试剂应是
(3)在步骤④中加入的试剂Z应是
(4)在步骤⑤中发生反应的化学方程式是
您最近一年使用:0次



