1 . Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
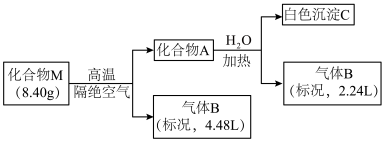
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________ (用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________ 。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______ 。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________ 。
(5)X的化学式_____________ 。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________ 。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________ 。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________ ,判断该同学设计的验证方法合理性并说明理由_________ 。

已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是
(2)化合物A与水反应的化学方程式是
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为
(5)X的化学式
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式
您最近一年使用:0次
2 . 氧化镁是优质的耐高温材料。某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备氧化镁的流程如下:

(1)步骤(Ⅰ)中分离操作的名称是_______ ,所需的玻璃仪器为_______ ;
(2)步骤(Ⅰ)分离出的滤渣中主要含有_______ ,它属于_______ (填“酸性”或“碱性”)氧化物;
(3)滤液Y中的阴离子除了含 、
、 外还有
外还有_______ ;
(4)写出步骤(Ⅲ)Mg(OH)2受热分解生成MgO和H2O的化学方程式:_______ 。

(1)步骤(Ⅰ)中分离操作的名称是
(2)步骤(Ⅰ)分离出的滤渣中主要含有
(3)滤液Y中的阴离子除了含
 、
、 外还有
外还有(4)写出步骤(Ⅲ)Mg(OH)2受热分解生成MgO和H2O的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 氧化镁是优质的耐高温材料。某兴趣小组利用菱镁矿(主要成分为MgCO3,还含有少量SiO2、Al2O3等杂质)设计制备氧化镁的流程如图:
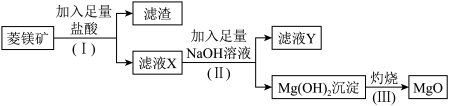
(1)步骤(Ⅰ)中分离操作的名称是___________ ;
(2)步骤(I)分离出的滤渣中主要含有_______ ,它属于______ (填“酸性”或“碱性”)氧化物;
(3)滤液Y中的阴离子除了含OH-、Cl-外还有___________ ;
(4)写出步骤(II)生成Mg(OH)2的离子方程式:_________ 。

(1)步骤(Ⅰ)中分离操作的名称是
(2)步骤(I)分离出的滤渣中主要含有
(3)滤液Y中的阴离子除了含OH-、Cl-外还有
(4)写出步骤(II)生成Mg(OH)2的离子方程式:
您最近一年使用:0次
2020-11-23更新
|
231次组卷
|
4卷引用:福建省南平市高级中学2020-2021学年高二上学期期中考试化学(会考)试题
4 . 下列有关物质性质与用途具有对应关系的是
| A.MgO熔点高,可用于电解冶炼镁 |
| B.酒精具有挥发性,可用于消毒杀菌 |
| C.Na2O2具有强氧化性,可用作供氧剂 |
| D.Fe粉具有还原性,可用作食品袋中的抗氧化剂 |
您最近一年使用:0次
5 . 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________ ;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:
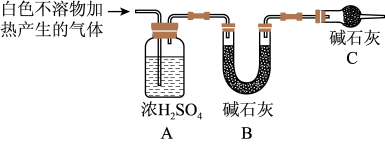
称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________ ;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________ 。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3•yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为 |
| 实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量 | 白色不溶物可能含有猜测2中不溶物 | |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 |

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:
您最近一年使用:0次
2016-12-09更新
|
584次组卷
|
3卷引用:2014年化学高考题型专练十八 探究型综合实验题练习卷
名校
6 . 下列有关物质的性质与用途具有对应关系的是
| A.SO2具有氧化性,可用于漂白纸张 | B.明矾易溶于水,可用作净水剂 |
| C.金属钠具有还原性,可用于高压钠灯 | D.MgO熔点高,可用于制作耐火材料 |
您最近一年使用:0次
2021-09-24更新
|
706次组卷
|
3卷引用:江苏省昆山市周市高级中学2020-2021学年高一上学期第二次模块测试化学试题
7 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
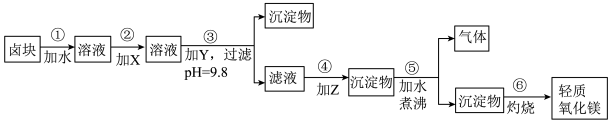
若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,所以,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去
表2 原料价格表
(1)在步骤②中加入的试剂X,最佳的选择是____________ ,其作用是_________________ ;
(2)在步骤③中加入的试剂应是_______________________ ;之所以要控制pH=9.8,其目的是___________________________________________________________ 。
(3)在步骤④中加入的试剂Z应是________________ ;
(4)在步骤⑤中发生反应的化学方程式是_____________________________________________ 。

若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6﹡ |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2 原料价格表
| 物质 | 价格/(元·吨-1) |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤③中加入的试剂应是
(3)在步骤④中加入的试剂Z应是
(4)在步骤⑤中发生反应的化学方程式是
您最近一年使用:0次
名校
解题方法
8 . 下列有关物质的性质与用途具有对应关系的是
| A.Mg(OH)2具有碱性,可用于制胃酸中和剂 | B.H2O2是无色液体,可用作消毒剂 |
| C.FeCl3具有氧化性,可用作净水剂 | D.Mg与CO2反应生成MgO和CO |
您最近一年使用:0次
解题方法
9 . 卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁(已知其中有一种中间产物是MgCO3)。
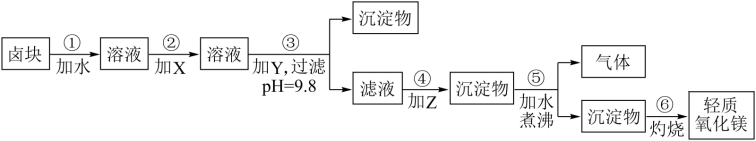
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
表2原料价格表
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(1)在步骤②中加入的试剂X,最佳的选择是______,其反应的离子方程式是 。
(2)在步骤③中如要控制pH=9.8,其目的是______;在步骤④中加入的试剂Z应是______;
(3)在步骤⑤中发生的化学方程式是______。

若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
表2原料价格表
| 物质 | 价格/元・吨-1 |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。
(1)在步骤②中加入的试剂X,最佳的选择是______,其反应的离子方程式是 。
(2)在步骤③中如要控制pH=9.8,其目的是______;在步骤④中加入的试剂Z应是______;
(3)在步骤⑤中发生的化学方程式是______。
您最近一年使用:0次
10 . 氧化物在生产、生活中有广泛应用。下列氧化物的性质与用途不具有对应关系的是
| A.ClO2具有强氧化性,可用于自来水的杀菌消毒 |
| B.SO2具有氧化性,工业上常用SO2漂白纸浆、毛、丝 |
| C.MgO的熔点高,可用作耐高温材料 |
| D.CaO能快速吸水,可用作食品干燥剂 |
您最近一年使用:0次



