1 . 碳酸亚铁可用于制备补血剂。某研究小组制备了FeCO3,并对FeCO3的性质和应用进行了探究。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN- Fe(SCN)64-(无色)
Fe(SCN)64-(无色)
Ⅰ.FeCO3的制取(夹持装置略)
实验i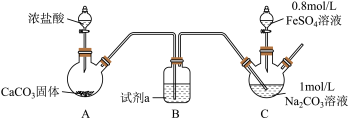
装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是__ 。
(2)向Na2CO3溶液通入CO2的目的是__ 。
(3)C装置中制取FeCO3的离子方程式为__ 。
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由__ 。
Ⅱ.FeCO3的性质探究
实验ii
实验iii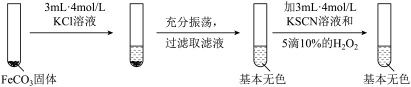
(5)对比实验ⅱ和ⅲ,得出的实验结论是__ 。
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式__ 。
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为__ 。该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是__ (不考虑操作不当引起的误差)。
已知:①FeCO3是白色固体,难溶于水
②Fe2++6SCN-
 Fe(SCN)64-(无色)
Fe(SCN)64-(无色)Ⅰ.FeCO3的制取(夹持装置略)
实验i

装置C中,向Na2CO3溶液(pH=11.9)通入一段时间CO2至其pH为7,滴加一定量FeSO4溶液,产生白色沉淀,过滤、洗涤、干燥,得到FeCO3固体。
(1)试剂a是
(2)向Na2CO3溶液通入CO2的目的是
(3)C装置中制取FeCO3的离子方程式为
(4)有同学认为C中出现白色沉淀之后应继续通CO2,你认为是否合理并说明理由
Ⅱ.FeCO3的性质探究
实验ii

实验iii

(5)对比实验ⅱ和ⅲ,得出的实验结论是
(6)依据实验ⅱ的现象,写出加入10%H2O2溶液的离子方程式
Ⅲ.FeCO3的应用
(7)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,此反应的离子方程式为
您最近一年使用:0次
2024高三下·全国·专题练习
解题方法
2 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: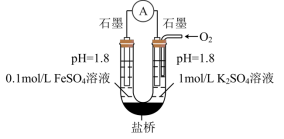
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近一年使用:0次
19-20高三·浙江·阶段练习
3 . I.为探究矿物样品M(仅含三种元素)的组成和性质,某实验小组设计并完成如下实验:

请回答下列问题:
(1)矿物样品M的化学式为_________________ 。
(2)在通入氧气条件下,矿物样品M也能与足量稀H2SO4反应得到暗绿色溶液,写出发生反应的离子方程式_____________________________ 。
(3)如何检验上述不含结晶水的盐中的阳离子?__________________________________ (写出实验操作、现象及结论)。
II.碱式碳酸镁可表示为xMg(OH)2·yMgCO3,某研究小组利用如下装置(装置图中部分夹持仪器已省略)测定其组成。
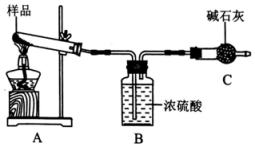
请回答:
(1)装置 C的仪器名称是______________ 。
(2)装置B中浓硫酸的作用是_____________________ 。
(3)利用此装置会使测定结果存在误差,为提高测定准确度,需对装置进行改进,其措施为__________________________________________________________________ (写两种)。

请回答下列问题:
(1)矿物样品M的化学式为
(2)在通入氧气条件下,矿物样品M也能与足量稀H2SO4反应得到暗绿色溶液,写出发生反应的离子方程式
(3)如何检验上述不含结晶水的盐中的阳离子?
II.碱式碳酸镁可表示为xMg(OH)2·yMgCO3,某研究小组利用如下装置(装置图中部分夹持仪器已省略)测定其组成。

请回答:
(1)装置 C的仪器名称是
(2)装置B中浓硫酸的作用是
(3)利用此装置会使测定结果存在误差,为提高测定准确度,需对装置进行改进,其措施为
您最近一年使用:0次
解题方法
4 . 为了探究Cu(NO3)2的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
回答下列问题:
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,充分反应后将铁丝取出。为检验铁的氧化产物,进行如下实验。(可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水)
(1)请完成下表:
【实验结论】Cu(NO3)2能将Fe氧化为Fe2+。
Ⅱ.Cu(NO3)2的热稳定性
用下图所示的实验装置A加热Cu(NO3)2固体,产生红棕色气体,试管中残留物为黑色固体,b中收集到无色气体。
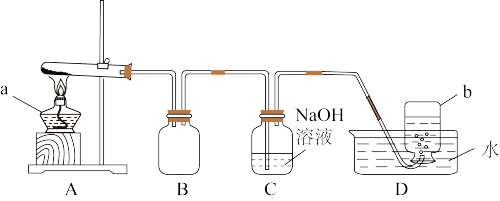
(2)仪器a的名称是______________ 。装置B的作用是___________________ 。
(3)【提出设想】b中收集到的无色气体可能是:
i.氧气 ⅱ.一氧化氮 ⅲ.空气
【实验验证】该小组为验证上述设想,用玻璃片在水下盖住集气瓶口,并取出正放在桌面上,移开玻璃片后瓶口未发现颜色变化,将带火星的木条伸入集气瓶,未见复燃。
【实验结论】b中的气体是________ 。根据上述实验结果,该小组得出了Cu(NO3)2固体加热分解的产物。请你帮助写出Cu(NO3)2加热分解的化学方程式_______________________ ;
C中反应的离子方程式_________________________________________ 。
回答下列问题:
Ⅰ.Cu(NO3)2的氧化性
将光亮的铁丝伸入Cu(NO3)2溶液中,充分反应后将铁丝取出。为检验铁的氧化产物,进行如下实验。(可选用试剂:KSCN溶液、K3[Fe(CN)6]溶液、氯水)
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量溶液于试管中,加入KSCN溶液,振荡 | 不存在Fe3+ | |
| 另取少量溶液于试管中,加入 | 蓝色沉淀 | 存在Fe2+ |
Ⅱ.Cu(NO3)2的热稳定性
用下图所示的实验装置A加热Cu(NO3)2固体,产生红棕色气体,试管中残留物为黑色固体,b中收集到无色气体。

(2)仪器a的名称是
(3)【提出设想】b中收集到的无色气体可能是:
i.氧气 ⅱ.一氧化氮 ⅲ.空气
【实验验证】该小组为验证上述设想,用玻璃片在水下盖住集气瓶口,并取出正放在桌面上,移开玻璃片后瓶口未发现颜色变化,将带火星的木条伸入集气瓶,未见复燃。
【实验结论】b中的气体是
C中反应的离子方程式
您最近一年使用:0次
5 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
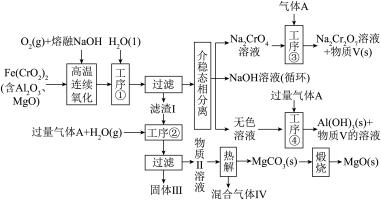
回答下列问题:
(1)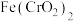 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:_________ 。
(2)滤渣Ⅰ的主要成分是_________ (填化学式)。工序③中发生反应的离子方程式为_________ 。
(3)热解工序产生的混合气体Ⅳ最适宜返回工序_________ (填“①”或“②”或“③”或“④”)参与内循环。
(4)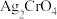 难溶于水,常温时
难溶于水,常温时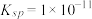 ;
;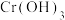 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。
①欲使 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为_________  的
的 溶液。
溶液。
②20℃时,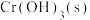 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确_________ 的是(填字母)。
A.NaOH浓度越小,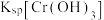 越小
越小
B.x、y两点对应的溶液中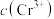 不相等
不相等
C.当NaOH浓度小于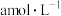 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大,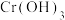 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使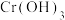 溶解平衡逆向移动
溶解平衡逆向移动
D.当NaOH浓度为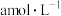 时,溶液中
时,溶液中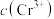 一定最小
一定最小
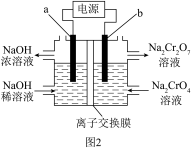
(5)工序③也可以利用电解法制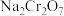 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为_________ (填离子符号)交换膜。制备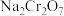 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少_________ g。
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
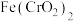 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:(2)滤渣Ⅰ的主要成分是
(3)热解工序产生的混合气体Ⅳ最适宜返回工序
(4)
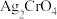 难溶于水,常温时
难溶于水,常温时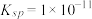 ;
;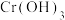 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。①欲使
 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。②20℃时,
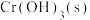 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
A.NaOH浓度越小,
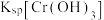 越小
越小B.x、y两点对应的溶液中
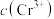 不相等
不相等C.当NaOH浓度小于
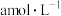 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大,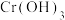 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使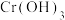 溶解平衡逆向移动
溶解平衡逆向移动D.当NaOH浓度为
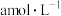 时,溶液中
时,溶液中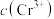 一定最小
一定最小(5)工序③也可以利用电解法制
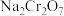 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为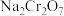 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
您最近一年使用:0次
2022-11-30更新
|
985次组卷
|
5卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题江西省宁冈中学2022-2023学年高三上学期12月月考化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题
6 . 某化学兴趣小组为了探究AgNO3的性质,通过查阅资料和老师指导设计了如下实验:
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe3+。
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。
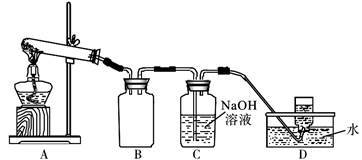
(2)装置B的作用是________________________ 。
(3)经小组讨论并验证该无色气体为O2,其验证方法是___________________________________ 。
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.__________________ 。
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
【实验结论】若假设i成立,该小组得出AgNO3固体热分解反应的化学方程式为______________ 。
Ⅰ.探究AgNO3的氧化性
实验方法:将光亮的铁丝伸入新配制的AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,先将溶液中的Ag除尽后,进行了如下实验。可选用的试剂:蒸馏水、稀氨水、KSCN溶液、高锰酸钾酸性溶液、新制氯水。
(1)请完成下表:
| 实验操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中, | 存在Fe3+ | |
| 取少量除尽Ag+后的溶液于试管中, | 不存在Fe2+ |
Ⅱ.探究AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。
当反应结束后,试管中残留同体为黑色。

(2)装置B的作用是
(3)经小组讨论并验证该无色气体为O2,其验证方法是
(4)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水和稀硝酸。
【提出设想】试管中残留的黑色同体可能是:i.Ag;ii.Ag2O;iii.
【实验验证】该小组为验证上述设想iii是否成立,进行了如下实验(仪器和药品任选)
| 实验操作 | 现象和结论 |
您最近一年使用:0次
7 . 某学习小组为研究碳素钢的性质,用铁钉(碳素钢)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是______________________ 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______ (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为________ 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1 和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。
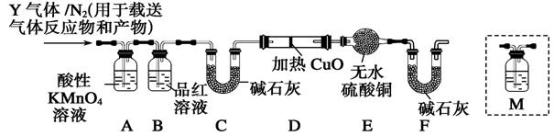
(3)装置B中试剂的作用是______________________ 。
(4)分析Y气体中的Q2气体是如何生成的____________________ (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于________ (填序号)。
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是______________ 。
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O===2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1 和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。

(3)装置B中试剂的作用是
(4)分析Y气体中的Q2气体是如何生成的
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于
A.A之前 B.A—B间 C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是
您最近一年使用:0次
名校
8 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
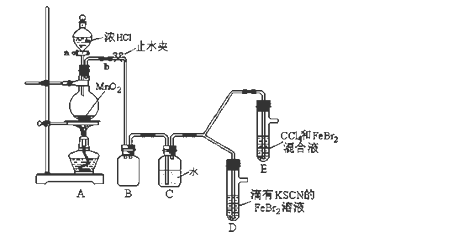
(1)①装置A中发生反应的离子方程式是_____________________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)用改正后的装置进行实验,实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化 。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式 (离子或化学方程式不限定)解释产生白色沉淀原因__________________ 、_______________________

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由 |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用
您最近一年使用:0次
2016-12-09更新
|
1544次组卷
|
5卷引用:2015届辽宁朝阳市三校协作体高三下学期第一次联考理综化学试卷



