2024高三下·全国·专题练习
解题方法
1 . 探究pH对 溶液的配制和保存的影响。
溶液的配制和保存的影响。
I. 溶液的配制
溶液的配制
将 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
II. 溶液的保存
溶液的保存
将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
(1)①中的浑浊主要是FeOOH,用离子方程式表示其生成过程_______ 。
(2)该实验的初步结论:保存 溶液的最佳pH是
溶液的最佳pH是_______ 。
(3)进一步探究pH对 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;
ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因_______ 。
b.依据实验i和ii推断:③比②中 更易变质的原因是
更易变质的原因是_______ 。
c.按上述原理进行实验,证实①中 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,_______ 。
 溶液的配制和保存的影响。
溶液的配制和保存的影响。I.
 溶液的配制
溶液的配制将
 分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:
分别溶于10mL蒸馏水或10mL稀硫酸,现象如下:| 编号 | 溶剂 | 溶液性状 | |
| ① | 蒸馏水 | 浅黄色澄清溶液 |  ;滴加1mol/LKSCN溶液无明显变化 ;滴加1mol/LKSCN溶液无明显变化 |
| ② |  | 无色澄清溶液 |  ;滴加1mol/LKSCN溶液微微变红 ;滴加1mol/LKSCN溶液微微变红 |
| ③ |  | 无色澄清溶液 | 滴加1mol/LKSCN溶液微微变红 |
 溶液的保存
溶液的保存将实验I中配制的三份溶液分别在空气中放置24小时后,记录如下。
| 编号 | 溶液性状 | |
| ① | 橙色浑浊 | 用 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 酸化后,浊液变澄清,再滴加1mol/LKSCN溶液后变深红 |
| ② | 无色溶液 | 滴加1mol/L的KSCN溶液后显浅红色 |
| ③ | 无色溶液 | 滴加1mol/L的KSCN溶液后显红色,颜色比②略深 |
(2)该实验的初步结论:保存
 溶液的最佳pH是
溶液的最佳pH是(3)进一步探究pH对
 变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后:
变质影响的原因。用下图所示装置完成实验(滴加试剂时溶液体积和导电性变化可忽略)。向右池持续稳定通入氧气,待电流计示数稳定后: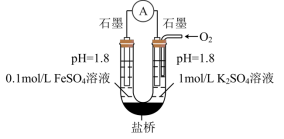
 接近2mol/L,电流没有明显变化;
接近2mol/L,电流没有明显变化;ii.向右池滴加等量浓硫酸,电流明显增大。
已知:电流增大表明化学反应速率加快,在该实验条件下与物质的氧化性(还原性)增强有关。
a.结合电极反应式分析ii中电流增大的原因
b.依据实验i和ii推断:③比②中
 更易变质的原因是
更易变质的原因是c.按上述原理进行实验,证实①中
 更易变质的主要原因是
更易变质的主要原因是 的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
的还原性增强,氧化速率加快,而与氧气性质变化关系不大。实验方案及预期现象是:向右池持续稳定通入氧气,待电流计示数稳定后,
您最近半年使用:0次
2 . 铁酸锌(ZnFe2O4)是可见光的敏感半导体材料,也可以用作脱硫剂,难溶于水和稀硫酸,以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4的过程可以表示为下图:

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:___________ 。
(2)下列说法正确的是___________。
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)___________ 。
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:___________ 。
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为___________ 。

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:
(2)下列说法正确的是___________。
| A.杂质中的SiO2属于酸性氧化物,能与Fe2O3反应 |
| B.除杂过程包括加足量锌粉、双氧水氧化等步骤,除Pb2+和Cu2+外,与锌粉反应的离子还有Fe3+和H+ |
| C.碳酸氢钠是为了调节溶液的pH,也可以用弱碱NH3·H2O代替 |
| D.ZnFe2O4难溶于稀硫酸,但在SO2-H2SO4体系中溶解度会明显增大 |
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为
您最近半年使用:0次
3 . 向 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②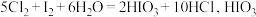 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是

 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②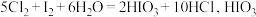 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是
A.还原性: |
B.b点溶液中 |
C.a点时已通入标准状况下氯气的总体积为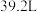 |
D.c点溶液中阴离子的个数为 |
您最近半年使用:0次
2023-12-01更新
|
847次组卷
|
4卷引用:广东省深圳市七校2023-2024学年高一上学期期中联考化学试题
4 . I.某兴趣小组对比合物X开展探究实验。
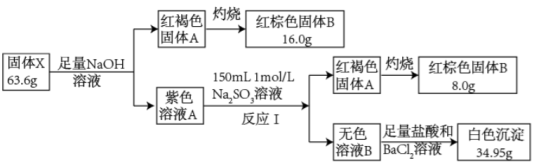
已知固体X由3种元素组成,可溶于水,熔色反应显黄色,X可在加热条件下由红棕色固体B与Na2O2反应得到。请回答:
(1)组成X的3种元素是___________ (填元素符号)。
(2)白色沉淀的化学式为___________ 。
(3)紫色溶液A中溶质的化学式为___________ 。
(4)反应Ⅰ的离子方程式为___________ 。
Ⅱ.某学习小组在研究H2还原红棕色固体B的实验中,发现生成的黑色粉末被磁铁吸引,为探究黑色粉末的组成,他们进行如下实验:
(5)向黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有___________ 。
(6)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管中,加入足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象,请分析此方案是否可行,并解释原因___________ 。

已知固体X由3种元素组成,可溶于水,熔色反应显黄色,X可在加热条件下由红棕色固体B与Na2O2反应得到。请回答:
(1)组成X的3种元素是
(2)白色沉淀的化学式为
(3)紫色溶液A中溶质的化学式为
(4)反应Ⅰ的离子方程式为
Ⅱ.某学习小组在研究H2还原红棕色固体B的实验中,发现生成的黑色粉末被磁铁吸引,为探究黑色粉末的组成,他们进行如下实验:
(5)向黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
(6)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管中,加入足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象,请分析此方案是否可行,并解释原因
您最近半年使用:0次
名校
解题方法
5 . 标准状况下,将SO2和Cl2组成的混合气体a L通入200mL 0.1mol·L-1 Fe2(SO4)3溶液中,充分反应后,气体被完全吸收,溶液的棕黄色变浅(溶液体积近似不变)。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为23.3g。则下列分析错误的是(已知:SO2+2Fe3++2H2O=SO +2Fe2++4H+)
+2Fe2++4H+)
 +2Fe2++4H+)
+2Fe2++4H+)| A.a L混合气体的物质的量可能为0.08mol |
| B.混合气体中SO2的体积为0.896L |
| C.所得沉淀为0.1mol的BaSO4 |
| D.混合气体中Cl2的物质的量可能为0.03mol |
您最近半年使用:0次
2023-02-16更新
|
1750次组卷
|
3卷引用:上海市复旦大学附属中学2022-2023学年高一上学期2月期末考试化学试题
6 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
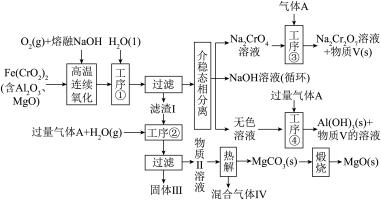
回答下列问题:
(1)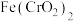 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:_________ 。
(2)滤渣Ⅰ的主要成分是_________ (填化学式)。工序③中发生反应的离子方程式为_________ 。
(3)热解工序产生的混合气体Ⅳ最适宜返回工序_________ (填“①”或“②”或“③”或“④”)参与内循环。
(4) 难溶于水,常温时
难溶于水,常温时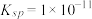 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。
①欲使 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为_________  的
的 溶液。
溶液。
②20℃时,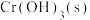 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确_________ 的是(填字母)。
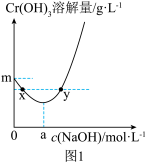
A.NaOH浓度越小,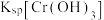 越小
越小
B.x、y两点对应的溶液中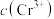 不相等
不相等
C.当NaOH浓度小于 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动
D.当NaOH浓度为 时,溶液中
时,溶液中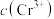 一定最小
一定最小
(5)工序③也可以利用电解法制 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为_________ (填离子符号)交换膜。制备 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少_________ g。
 的深度利用和
的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
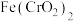 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式:(2)滤渣Ⅰ的主要成分是
(3)热解工序产生的混合气体Ⅳ最适宜返回工序
(4)
 难溶于水,常温时
难溶于水,常温时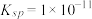 ;
; 难溶于水,能溶于强酸、强碱。
难溶于水,能溶于强酸、强碱。①欲使
 的
的 溶液中的
溶液中的 沉淀完全(离子浓度小于
沉淀完全(离子浓度小于 ),需加入等体积浓度至少为
),需加入等体积浓度至少为 的
的 溶液。
溶液。②20℃时,
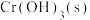 在不同浓度的NaOH溶液中的最大溶解量(
在不同浓度的NaOH溶液中的最大溶解量( )如图1所示。下列叙述正确
)如图1所示。下列叙述正确
A.NaOH浓度越小,
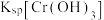 越小
越小B.x、y两点对应的溶液中
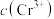 不相等
不相等C.当NaOH浓度小于
 时,随着NaOH浓度的增大,
时,随着NaOH浓度的增大, 溶解量减小是因为
溶解量减小是因为 浓度增大使
浓度增大使 溶解平衡逆向移动
溶解平衡逆向移动D.当NaOH浓度为
 时,溶液中
时,溶液中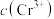 一定最小
一定最小(5)工序③也可以利用电解法制
 ,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为
,工作原理如下图2所示(a、b电极均为石墨)。该装置中的离子交换膜为 时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
时,若电路中有4mol电子转移时,理论上右侧溶液总质量减少
您最近半年使用:0次
2022-11-30更新
|
973次组卷
|
5卷引用:江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题
江西省临川第一中学2022-2023学年高三上学期11月教学质量检测化学试题 (已下线)河南省湘豫名校联考2022-2023学年高三上学期12月期末摸底考试变式汇编(17-21)辽宁省部分省级示范性高中2022-2023学年高二下学期3月测试化学试题江西省宁冈中学2022-2023学年高三上学期12月月考化学试题江西省吉安市第三中学2022-2023学年高三上学期12月月考化学试题
7 . 化合物X由四种元素组成,某实验小组按如下流程进行相关实验。
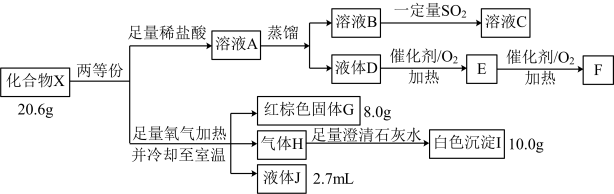
已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为_______ 。
(2)溶液A的溶质组成为_______ (用化学式表示)。
(3)写出 的化学方程式
的化学方程式_______ 。
(4)X可溶于HI溶液中,写出反应的离子方程式_______ 。
(5)设计实验,检验溶液C中可能的金属阳离子_______ 。

已知:J能使无水硫酸铜变蓝,上述物质中E和F能发生银镜反应。请回答:
(1)组成X的四种元素为
(2)溶液A的溶质组成为
(3)写出
 的化学方程式
的化学方程式(4)X可溶于HI溶液中,写出反应的离子方程式
(5)设计实验,检验溶液C中可能的金属阳离子
您最近半年使用:0次
8 . 化合物X(含3种常见元素)可用作照相显影剂。对X开展探究实验如图:
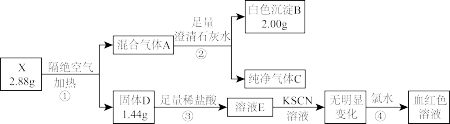
请回答:
(1)组成X的3种元素是_______ (填元素符号),白色沉淀B的化学式是_______ 。
(2)X隔绝空气受热分解的化学方程式_______ 。
(3)已知固体D不稳定,在空气中受热易迅速被氧化为磁性固体。甲同学认为磁性固体为_______ ,发生的化学方程式为_______ 。
(4)某同学在步骤④时,逐滴滴入氯水直至过量,结果出现的血红色又重新褪去,请说明可能的原因_______ 。

请回答:
(1)组成X的3种元素是
(2)X隔绝空气受热分解的化学方程式
(3)已知固体D不稳定,在空气中受热易迅速被氧化为磁性固体。甲同学认为磁性固体为
(4)某同学在步骤④时,逐滴滴入氯水直至过量,结果出现的血红色又重新褪去,请说明可能的原因
您最近半年使用:0次
名校
解题方法
9 . 氧化铁是一种红棕色粉末俗称铁红,是常见的铁的氧化物。
Ⅰ.请列举氧化铁一种用途;_______ 。
Ⅱ.氧化亚铜 也是红色粉末,有类似于氧化铁的用途。查阅资料可知:
也是红色粉末,有类似于氧化铁的用途。查阅资料可知: 是一种碱性氧化物,溶于稀硫酸生成
是一种碱性氧化物,溶于稀硫酸生成 和
和 ,在空气中加热生成
,在空气中加热生成 .实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
.实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
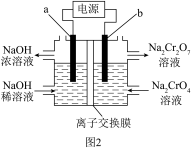
假设1:红色粉末是 ;假设2:红色粉末是
;假设2:红色粉末是 ;假设3:
;假设3:_______ 。
他们取少量粉末,欲向其中加入足量稀硫酸,并滴加 溶液,通过现象推断其成分。请回答下列问题:
溶液,通过现象推断其成分。请回答下列问题:
(1)若假设1成立,则实验现象是_______ 。
(2)有人认为,若滴加 试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?
试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?_______ (填“合理”或“不合理”).请简述你的理由(不需写出反应的方程式):_______ 。
(3)按照他们的设计加入足量稀硫酸充分反应后,滴加 溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
ⅰ. 是难溶于水的白色固体; ⅱ.
是难溶于水的白色固体; ⅱ. 的化学性质与
的化学性质与 的相似 ⅲ.
的相似 ⅲ.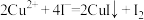 。
。
同学们按照如表方案进行实验,证明了白色沉淀的成分为 .请你补全表格中相关内容:
.请你补全表格中相关内容:
 与
与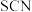 -反应的离子方程式为
-反应的离子方程式为_______ .由此可以证明,实验室中红色粉末的成分是_______ 。
(4)同学们认为,通过加热法测定 的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中
的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中 质量分数为
质量分数为_______ 。
Ⅰ.请列举氧化铁一种用途;
Ⅱ.氧化亚铜
 也是红色粉末,有类似于氧化铁的用途。查阅资料可知:
也是红色粉末,有类似于氧化铁的用途。查阅资料可知: 是一种碱性氧化物,溶于稀硫酸生成
是一种碱性氧化物,溶于稀硫酸生成 和
和 ,在空气中加热生成
,在空气中加热生成 .实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:
.实验室有一些红色粉末,根据来源,只知其成分可能含有氧化铁或氧化亚铜.某化学小组欲一探究竟,提出如下假设:假设1:红色粉末是
 ;假设2:红色粉末是
;假设2:红色粉末是 ;假设3:
;假设3:他们取少量粉末,欲向其中加入足量稀硫酸,并滴加
 溶液,通过现象推断其成分。请回答下列问题:
溶液,通过现象推断其成分。请回答下列问题:(1)若假设1成立,则实验现象是
(2)有人认为,若滴加
 试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?
试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法是否合理?(3)按照他们的设计加入足量稀硫酸充分反应后,滴加
 溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:
溶液,溶液先变为红色,然后红色逐渐变浅直至消失,同时生成一种白色沉淀。为了探究白色沉淀产生的原因,同学们首先查阅资料,得知:ⅰ.
 是难溶于水的白色固体; ⅱ.
是难溶于水的白色固体; ⅱ. 的化学性质与
的化学性质与 的相似 ⅲ.
的相似 ⅲ.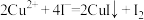 。
。同学们按照如表方案进行实验,证明了白色沉淀的成分为
 .请你补全表格中相关内容:
.请你补全表格中相关内容:| 实验方案 | 实验现象 |
步骤1:取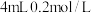 的 的 ,溶液于试管中,向其中滴加3滴 ,溶液于试管中,向其中滴加3滴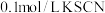 溶液 溶液 | |
步骤2:取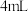  的 的 溶液于试管中,向其中滴加3滴 溶液于试管中,向其中滴加3滴 溶液 溶液 |
 与
与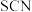 -反应的离子方程式为
-反应的离子方程式为(4)同学们认为,通过加热法测定
 的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中
的质量分数,也可以判断红色粉末的成分.他们取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg,则混合物中 质量分数为
质量分数为
您最近半年使用:0次
2021-01-28更新
|
1155次组卷
|
2卷引用:山西省2020-2021学年高一上学期期末考试化学试题
名校
解题方法
10 . 已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1
①写出FeCl3溶液与KI溶液反应的离子方程式_____ 。
②加入KSCN溶液的目的是_____ 。
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
本实验改用0.1 mol•L-1 KI溶液的目的是______ 。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因:______ 。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I 在水中均呈棕黄色,两者有如下关系:I2+I-⇌I
在水中均呈棕黄色,两者有如下关系:I2+I-⇌I 。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I
。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I 。
。
①为验证假设,乙同学设计并完成了实验3。
实验3的结论是_____ 。
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-⇌I 的存在。请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中
的存在。请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中____ ,振荡、静置,对比观察现象。
(1)甲同学首先进行了实验1
| 实验1 | 实验步骤 | 实验现象 |
| ⅰ.取2 mL 1 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同) | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1 mol•L-1 KSCN溶液. | ⅱ.溶液不显红色. |
②加入KSCN溶液的目的是
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2。
| 实验2 | 实验步骤 | 实验现象 |
| ⅰ.取2 mL 0.1 mol•L-1 KI溶液,滴加0.1 mol•L-1 FeCl3溶液3滴。 | ⅰ.溶液呈棕黄色。 | |
| ⅱ.向其中滴加2滴0.1 mol•L-1 KSCN溶液。 | ⅱ.溶液显红色。 | |
| ⅲ.继续加入2 mL CCl4,充分振荡、静置。 | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因:
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I
 在水中均呈棕黄色,两者有如下关系:I2+I-⇌I
在水中均呈棕黄色,两者有如下关系:I2+I-⇌I 。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I
。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I 。
。①为验证假设,乙同学设计并完成了实验3。
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ.取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4,振荡、静置。 | ⅰ.液体分层,上层呈黄色,下层呈紫红色。 | |
| ⅱ.取1 mL饱和碘水,加入2 mL CCl4,振荡静置。 | ⅱ.液体分层,上层为无色,下层呈紫红色。 |
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-⇌I
 的存在。请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中
的存在。请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中
您最近半年使用:0次
2020-12-23更新
|
1072次组卷
|
2卷引用:广东实验中学2020-2021学年高二上学期期中考试化学试题



