名校
解题方法
1 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如下图所示(CuS不溶于水)。下列说法中,不正确的是
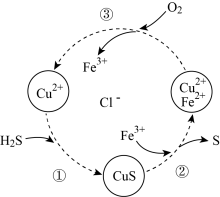

| A.过程①中,生成CuS的反应为Cu2++H2S=CuS↓+2H+ |
| B.反应过程中需不断向体系中补充FeCl3 |
| C.过程③中,通入1mol O2产生2mol Fe3+ |
D.回收S的总反应为2H2S+O2 2H2O+2S↓ 2H2O+2S↓ |
您最近一年使用:0次
2023-02-12更新
|
617次组卷
|
2卷引用:湖南省长沙市长郡中学2022-2023学年高一上学期期末考试化学试题
解题方法
2 . 下列相关反应方程式不正确的是
| A.过氧化钠用作供氧剂:2Na2O2 + 2CO2 = 2Na2CO3 + O2 |
| B.保存FeSO4溶液需添加铁粉:2Fe3+ + Fe = 3Fe2+ |
| C.工业上制备漂白粉:2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O |
D.硝酸型酸雨腐蚀大理石石雕:CO + 2H+ = H2O + CO2↑ + 2H+ = H2O + CO2↑ |
您最近一年使用:0次
2021-01-27更新
|
1336次组卷
|
2卷引用:福建省南平市2020-2021学年高一上学期期末考试化学试题
名校
3 . I.如图是利用电化学装置将SO2转化为重要的化工原料H2SO4的原理示意图。
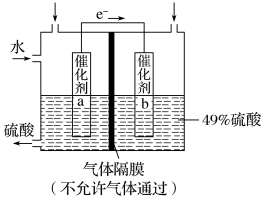
请回答下列问题:
(1)该装置将_______ 能转化为______ 能。
(2)催化剂b表面O2发生_______ 反应,其附近溶液酸性______ (填“增强”、“不变”或“减弱”)。
(3)催化剂a表面的电极反应式:_______ 。
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是______ 。
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是______ 。
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由______ 。
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为______ 。

请回答下列问题:
(1)该装置将
(2)催化剂b表面O2发生
(3)催化剂a表面的电极反应式:
II.某废料铁泥主要成分是Fe2O3、FeO和Fe,其他杂质不与硫酸反应。实验室用该废料提取Fe2O3,设计实验流程如图:

(4)步骤(I)充分反应后进行的实验操作名称是
(5)步骤(II)中加入H2O2溶液后需要适当加热但温度不能过高,原因是
(6)为了检验溶液B中是否有亚铁离子剩余,有同学提出只需要取少量溶液B于试管中并向其中滴加氢氧化钠溶液,然后观察现象即可证明。请你判断该同学的方法是否可行并说出理由
(7)步骤(III)中将NaOH溶液换成氨气也可以得到Fe(OH)3沉淀,反应的离子方程式为
您最近一年使用:0次
2023-05-19更新
|
712次组卷
|
2卷引用:贵州省遵义市仁怀市高中教育联盟2022-2023学年高一下学期5月期中考试化学试题
名校
解题方法
4 . 下列说法正确的是
| A.某黄色溶液与淀粉-KI溶液混合后呈蓝色,说明该溶液一定是氯水 |
| B.NaOH溶液可盛放在带磨口玻璃塞的玻璃瓶中,也可盛放在带橡胶塞的玻璃瓶中 |
C.若用 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入 制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入 |
D.由 可知,硅酸的酸性强于碳酸 可知,硅酸的酸性强于碳酸 |
您最近一年使用:0次
2023-03-11更新
|
584次组卷
|
5卷引用:湖南省长沙市湖南师大附中2022-2023学年高一下学期第一次月考化学试题
10-11高一上·福建三明·期中
名校
5 . 要除去FeCl2溶液中少量的FeCl3,下列方法可行的是
| A.滴入KSCN溶液 | B.加入铁粉 | C.通入氯气 | D.加入铜粉 |
您最近一年使用:0次
2022-03-06更新
|
726次组卷
|
37卷引用:2010年福建省三明一中高一上学期期中考试化学卷
(已下线)2010年福建省三明一中高一上学期期中考试化学卷(已下线)2011-2012学年福建省三明市普通高中高一上学期联合命题考试化学试卷(已下线)2011-2012学年福建省大田第一中学高一第一学期联合命题考试化学试卷(已下线)2012-2013学年福建省福清东张中学高一上学期期末考试化学试卷(已下线)2012-2013学年广东省执信中学高一上学期期末考试化学试卷2015-2016学年江苏省盐城市亭湖区南洋中学高一上学期期末化学试卷2016-2017学年山东省枣庄八中高一12月月考化学卷山东省济南第一中学2017-2018学年高一上学期期末考试化学试题河北省邢台市第八中学2018-2019学年高一下学期期末考试化学试题新疆疏勒县八一中学2018-2019学年高一上学期期末考试化学试题云南省广南县第三中学校2019-2020学年高一上学期期末考试化学试题广西壮族自治区来宾市金秀县民族中学2019-2020学年高一上学期期末考试化学试题广西壮族自治区来宾市忻城县民族中学2019-2020学年高一上学期期末考试化学试题四川省内江市2019-2020学年高一下学期期末检测化学(文)试题(已下线)3.1.2 铁及其化合物之间的转化关系练习(2)——《高中新教材同步备课》(鲁科版 必修第一册)(已下线)第三章 铁 金属材料(基础过关)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)甘肃省武威市民勤县第一中学2019-2020学年高一下学期期中考试化学(文) 试题(已下线)3.1.2 铁的重要化合物-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)(已下线)3.1.2 铁的重要化合物(基础练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)湖南省常德市外国语学校2020-2021学年高一上学期第二次月考化学试题云南省弥勒市第一中学黄冈校区2020-2021学年高一12月月考化学试题山西省朔州市怀仁市大地学校2020-2021学年高一上学期第四次月考化学试题湖南省岳阳市华容县2020-2021学年高一上学期期末考试化学试题云南省玉溪市第二中学2020-2021学年高一下学期期中考试化学(文)试题云南省玉溪师范学院附属中学2021-2022学年高一下学期开学测试化学试题课前-3.1.1铁及其化合物(课前)-鲁科版2019必修第一册(已下线)2010-2011学年江苏省扬州中学高二上学期期末考试化学试题(必修)(已下线)2011-2012学年广东省兴中学高二下学期期中学业水平考试化学试卷2015-2016学年广东省广州市南沙一中高二下学期期中文科化学试卷2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(已下线)【艺体生文化课百题突围系列-基础练测】专题2.10 金属及其化合物上海市嘉定区封浜高中2017学年第一学期高二化学期终考试2020届高三化学无机化学二轮专题复习——铁盐及亚铁盐的性质2【精编25题】广东省广州市天河区华南师范大学附属中学2020届高三化学专题训练(15)上海市徐汇区2022届高三一模化学试题上海市虹口区复兴高级中学2022-2023学年高三上学期期中考试化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
6 . 下列实验目的、操作、现象及结论合理的是
| 实验目的 | 实验操作 | 现象及结论 | |
| A | 检验CO还原Fe2O3的生成物中是否含有Fe3O4 | 取反应后的固体溶于稀盐酸,滴加KSCN溶液 | 若溶液变红色,则还原产物中含有Fe3O4 |
| B | 比较Fe3+和I2氧化性强弱 | 向FeCl3溶液中滴加淀粉碘化钾溶液 | 若溶液变蓝色,则氧化性:Fe3+>I2 |
| C | 检验FeCl3溶液中是否含有Fe2+ | 向溶液中滴加酸性KMnO4溶液 | 若紫红色退去,则溶液中含有Fe2+ |
| D | 检验溶液中是否含有CO | 取少量溶液于试管中,滴加稀盐酸 | 若产生的气体能使澄清石灰水变浑浊,则溶液中含有CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-03-02更新
|
803次组卷
|
4卷引用:浙江省衢州市2022-2023学年高一上学期期末教学质量检测化学试题
名校
7 . 在某酸性溶液中,能大量共存的离子组是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
2023-01-07更新
|
574次组卷
|
3卷引用:北京市第八中学2022-2023学年高一上学期期末考试化学试题
8 . 实验室由硫铁矿烧渣(主要成分为 、
、 、
、 )制备软磁性材料
)制备软磁性材料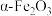 。主要转化流程如下:
。主要转化流程如下:
①酸浸。写出烧渣酸浸时 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式___________ 。
②还原。向“酸浸”后的溶液中加入过量铁粉,使 完全转化为
完全转化为 ,该过程除生成
,该过程除生成 外,还会生成
外,还会生成___________ (填化学式);检验 是否还原完全的实验操作是
是否还原完全的实验操作是___________ 。
③除杂。向“还原”后滤液中加入NaOH溶液,调节pH为___________ ,使 除去完全。[已知:
除去完全。[已知: 时
时 沉淀完全,
沉淀完全, 时
时 开始沉淀。]
开始沉淀。]
④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化,___________ ,过滤,少量冰水洗涤,低温干燥,得到 晶体。
晶体。 。将
。将 溶液与氨水
溶液与氨水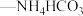 混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。___________ ;生成 的离子方程式为
的离子方程式为___________ 。
②生成的 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是___________ 。
(3)制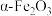 。将纯净的
。将纯净的 放入管式炉内煅烧2h,获得产品
放入管式炉内煅烧2h,获得产品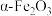 。下图为其他条件相同时不同煅烧温度对产品中
。下图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于800℃时,产品中
质量分数的影响,当煅烧温度高于800℃时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是___________ 。
 、
、 、
、 )制备软磁性材料
)制备软磁性材料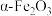 。主要转化流程如下:
。主要转化流程如下:
①酸浸。写出烧渣酸浸时
 与稀硫酸反应的化学方程式
与稀硫酸反应的化学方程式②还原。向“酸浸”后的溶液中加入过量铁粉,使
 完全转化为
完全转化为 ,该过程除生成
,该过程除生成 外,还会生成
外,还会生成 是否还原完全的实验操作是
是否还原完全的实验操作是③除杂。向“还原”后滤液中加入NaOH溶液,调节pH为
 除去完全。[已知:
除去完全。[已知: 时
时 沉淀完全,
沉淀完全, 时
时 开始沉淀。]
开始沉淀。]④结晶。结合题图所示的绿矾溶解度曲线,补充完整获得
 晶体的实验操作。向
晶体的实验操作。向 溶液中再加入稀硫酸酸化,
溶液中再加入稀硫酸酸化, 晶体。
晶体。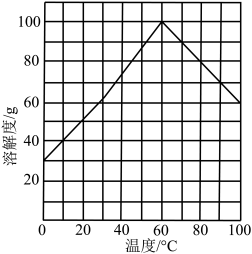
 。将
。将 溶液与氨水
溶液与氨水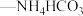 混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
混合溶液中的一种加入到三颈瓶中(装置见图),通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。
 的离子方程式为
的离子方程式为②生成的
 沉淀需“洗涤完全”,检验方法是
沉淀需“洗涤完全”,检验方法是(3)制
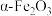 。将纯净的
。将纯净的 放入管式炉内煅烧2h,获得产品
放入管式炉内煅烧2h,获得产品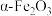 。下图为其他条件相同时不同煅烧温度对产品中
。下图为其他条件相同时不同煅烧温度对产品中 质量分数的影响,当煅烧温度高于800℃时,产品中
质量分数的影响,当煅烧温度高于800℃时,产品中 质量分数降低,铁元素质量分数升高,其可能原因是
质量分数降低,铁元素质量分数升高,其可能原因是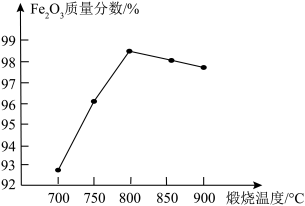
您最近一年使用:0次
2023-04-22更新
|
577次组卷
|
2卷引用:江苏省黄埭中学2022-2023学年高一下学期期中调研测试化学试题
名校
解题方法
9 . 向一定量的Fe、FeO、Fe2O3的混合物中加入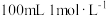 的盐酸,恰好使混合物完全反应,放出
的盐酸,恰好使混合物完全反应,放出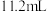 (标准状况)气体,向所得溶液中加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为
(标准状况)气体,向所得溶液中加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为
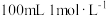 的盐酸,恰好使混合物完全反应,放出
的盐酸,恰好使混合物完全反应,放出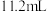 (标准状况)气体,向所得溶液中加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为
(标准状况)气体,向所得溶液中加入KSCN溶液不变红色。用足量的CO在高温下还原相同质量的此混合物,所得铁的质量为| A.2.8g | B.11.2g | C.5.6g | D.无法计算 |
您最近一年使用:0次
2021-12-16更新
|
1455次组卷
|
6卷引用:山东省泰安市第一中学2021-2022学年高一12月月考化学试题
山东省泰安市第一中学2021-2022学年高一12月月考化学试题云南省弥勒市第一中学2021-2022学年高一上学期第四次月考化学试题第三章 铁 金属材料(已下线)第14讲 铁的单质、氧化物和氢氧化物(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 ) 黑龙江省黑河市第九中学2021--2022学年高 一上学期期末考试化学试题重庆市南开中学2022-2023学年高一上学期12月定时练习化学试题
名校
解题方法
10 . 下列有关除杂的操作中不正确的是
A. 溶液中含少量 溶液中含少量 杂质:加入过量的 杂质:加入过量的 粉,过滤 粉,过滤 |
B.除去 溶液中少量的 溶液中少量的 :加入新制氯水 :加入新制氯水 |
C.除 溶液中少量的 溶液中少量的 杂质可以向溶液中加入过量铁粉,然后过滤 杂质可以向溶液中加入过量铁粉,然后过滤 |
D.除 溶液中的 溶液中的 杂质可以向溶液中加入过量铁粉 杂质可以向溶液中加入过量铁粉 |
您最近一年使用:0次
2022-08-17更新
|
1263次组卷
|
4卷引用:第三章 铁金属材料 本章复习提升
第三章 铁金属材料 本章复习提升河南省上蔡第一高级中学2022-2023学年高一上学期期末考试化学试题(已下线) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末考试练习题浙江省舟山市定海第一中学2022-2023学年高三上学期9月月考化学试题



