名校
1 . 市售铁强化盐中铁含量测定。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为___________ 。
(2)样品中铁元素的质量分数为___________ (列出式子即可)。
已知:①铁强化盐中含有NaCl、KIO3、NaFeY,其中n(KIO3):n(NaFeY)=1:50,
②I2+2S2O
 =2I-+S4O
=2I-+S4O
称取m g样品,加稀硫酸溶解后配成100 mL溶液。取出10 mL,加入稍过量的KI溶液,充分反应后,滴入淀粉溶液,用c mol/L Na2S2O3标准溶液滴定,重复操作2~3次,消耗Na2S2O3标准溶液平均值为V mL。
(1)I-除了与Fe3+反应外,还可发生的反应的离子方程式为
(2)样品中铁元素的质量分数为
您最近一年使用:0次
名校
2 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
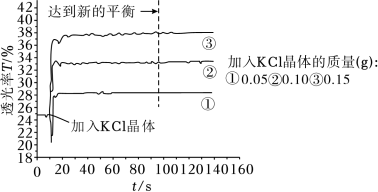
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
61次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
解题方法
3 . 以废锌铁合金(含Zn、ZnO及少量Fe、 、Cu、CuO和油污)为原料制备
、Cu、CuO和油污)为原料制备 的流程如下:
的流程如下:
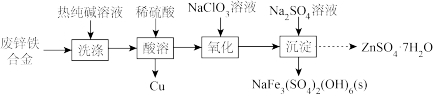
(1)“洗涤”的目的是_______ 。
(2)“酸溶”所得滤液中不含 ,证明滤液中不含
,证明滤液中不含 的实验操作为
的实验操作为_______ 。
(3)“氧化”过程控制体系温度为80℃的方法是_______ 。“氧化”后的溶液中,阳离子有_______ 。
(4)三价铁在不同温度和pH下沉淀的形式如左图所示,图中阴影部分是黄铁矾钠[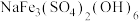 ]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
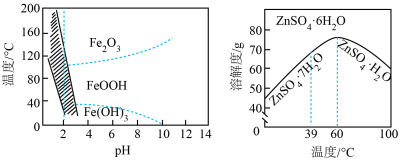
已知: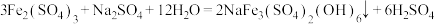
以“氧化”后所得溶液制备 的方案如下:
的方案如下:
在80℃下,用pH计测定“氧化”后所得溶液的pH为4.1,滴加_______ 调节溶液pH至2.0;边搅拌边向溶液中滴加1.0
 溶液同时用1.0
溶液同时用1.0 NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;_______ ,停止滴加1.0
 溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,
溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,_______ ,冷却至室温,过滤,冷水洗涤,低温干燥得产品 。
。
实验中可选用的试剂:1.0
 溶液、1.0
溶液、1.0 HCl溶液、1.0
HCl溶液、1.0 NaOH溶液、1.0
NaOH溶液、1.0
 溶液。
溶液。
(5)取1.800g 样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500
样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500 EDTA(
EDTA( )标准溶液滴定至终点(滴定反应为
)标准溶液滴定至终点(滴定反应为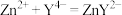 ,平行滴定3次,平均消耗EDTA溶液35.00mL。计算
,平行滴定3次,平均消耗EDTA溶液35.00mL。计算 样品中
样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)_______ 。
 、Cu、CuO和油污)为原料制备
、Cu、CuO和油污)为原料制备 的流程如下:
的流程如下:
(1)“洗涤”的目的是
(2)“酸溶”所得滤液中不含
 ,证明滤液中不含
,证明滤液中不含 的实验操作为
的实验操作为(3)“氧化”过程控制体系温度为80℃的方法是
(4)三价铁在不同温度和pH下沉淀的形式如左图所示,图中阴影部分是黄铁矾钠[
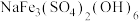 ]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
]稳定存在的区域;硫酸锌溶解度曲线如右图所示。
已知:
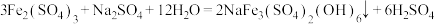
以“氧化”后所得溶液制备
 的方案如下:
的方案如下:在80℃下,用pH计测定“氧化”后所得溶液的pH为4.1,滴加

 溶液同时用1.0
溶液同时用1.0 NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
NaOH溶液控制溶液pH保持在2.0左右,产生大量沉淀;
 溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃,
溶液;趁热过滤;将滤液在80℃下蒸发浓缩至有晶膜出现,降温至60℃, 。
。实验中可选用的试剂:1.0

 溶液、1.0
溶液、1.0 HCl溶液、1.0
HCl溶液、1.0 NaOH溶液、1.0
NaOH溶液、1.0
 溶液。
溶液。(5)取1.800g
 样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500
样品配成100.00mL溶液,准确量取10.00mL溶液于锥形瓶中,加30mL蒸馏水稀释;然后滴加氨水调节溶液pH=10,用0.01500 EDTA(
EDTA( )标准溶液滴定至终点(滴定反应为
)标准溶液滴定至终点(滴定反应为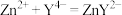 ,平行滴定3次,平均消耗EDTA溶液35.00mL。计算
,平行滴定3次,平均消耗EDTA溶液35.00mL。计算 样品中
样品中 的质量分数(写出计算过程)
的质量分数(写出计算过程)
您最近一年使用:0次
解题方法
4 . 以黄铁矿为原料制硫酸产生的硫酸渣中含 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
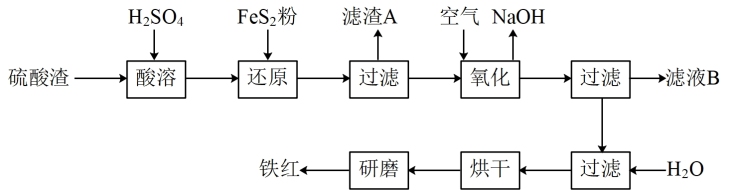
请回答下列问题:
(1) 中硫元素化合价为
中硫元素化合价为_______ ,滤渣A的名称为_______ 。
(2)酸溶时,粉碎硫酸渣的目的是____ ,酸溶过程中,溶解 的离子方程式是
的离子方程式是____ 。
(3)配平下列离子方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是_______ 。
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为_______ %。
 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
请回答下列问题:
(1)
 中硫元素化合价为
中硫元素化合价为(2)酸溶时,粉碎硫酸渣的目的是
 的离子方程式是
的离子方程式是(3)配平下列离子方程式:
_______
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为
您最近一年使用:0次
名校
5 . 在分析化学上,测定含 酸性溶液中钛元素的含量通常涉及两个反应:
酸性溶液中钛元素的含量通常涉及两个反应:
I.用 粉还原
粉还原 得到
得到 ;
;
II.用 溶液滴定,反应的离子方程式为
溶液滴定,反应的离子方程式为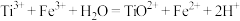 。
。
下列说法错误的是
 酸性溶液中钛元素的含量通常涉及两个反应:
酸性溶液中钛元素的含量通常涉及两个反应:I.用
 粉还原
粉还原 得到
得到 ;
;II.用
 溶液滴定,反应的离子方程式为
溶液滴定,反应的离子方程式为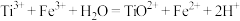 。
。下列说法错误的是
A.还原性: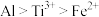 |
B.反应I中氧化产物和还原产物的物质的量之比为 |
C.反应II的滴定实验可选用 溶液作指示剂 溶液作指示剂 |
D.反应I中生成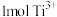 时消耗的 时消耗的 和反应Ⅱ中消耗 和反应Ⅱ中消耗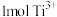 时生成的 时生成的 的量相同 的量相同 |
您最近一年使用:0次
2023-02-14更新
|
654次组卷
|
4卷引用:湖南省新高考教学教研联盟(长郡十八校联盟)2022-2023学年高二下学期5月联考化学试题
解题方法
6 . 已知K3[Fe(CN)6]溶液遇 Fe2+生成蓝色沉淀,可检验溶液中的Fe2+。某实验小组测定菠菜和黑木耳中的铁元素。实验如下:
I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:
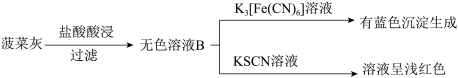
(1)操作i中起分离作用的仪器名称为_______ ;溶液A中未能检测出Fe2+的可能原因是_______ 。
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是_______ 。
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于_______ (填仪器名称)中灼烧。经过一系列操作后配制成100mL待测液。过程中,用到盐酸羟胺(在溶液中可完全电离出NH3OH+与Cl-)将溶液中Fe3+还原Fe2+,同时产生一种无污染的气体。该反应的离子方程式为_______ ;配制100mL一定物质的量浓度的酸性高锰酸钾溶液时,所需要的玻璃仪器除量筒、玻璃棒、烧杯外还有_______ 。
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)_______ (mg/100g);若以13.93mg/100g 为标准值,则本次实验的相对偏差为_______ 。(保留三位有效数字)

I.水煮菠菜(铁元素主要以难溶的 FeC2O4形式存在)检验法:

II.灼烧检验法:

(1)操作i中起分离作用的仪器名称为
(2)甲同学取少量无色溶液B,滴加酸性KMnO4溶液,振荡后,溶液紫色消失,因此得出结论,溶液B含有Fe2+。乙同学认为甲同学的实验方法不严谨,理由是
有研究表明,黑木耳中铁的含量约为13.93mg/100g,是菠菜含铁量的10倍以上。
III.测定木耳铁中元素含量。
(3)称取2.00g干黑木耳置于
(4)从配制的待测液中取出10mL,利用吸光度法测得其吸光度为0.400(吸光度与Fe2+的浓度关系如下图所示)。试计算该黑木耳中铁元素的含量(溶液密度为1g·mL-1)

您最近一年使用:0次
名校
7 . 某草酸亚铁样品(FeC2O4·xH2O)中含有少量硫酸亚铁,现用滴定法测定该样品中FeC2O4的含量。
①将准确称量的ag草酸亚铁样品置于250 mL的锥形瓶内,加入适量2 mol·L-1的A溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.02000 mol·L-1的KMnO4标准溶液滴定至终点,记下滴定管内液面读数为bmL(滴定管起始读数为0.00);
②向上述滴定后混合液中加入适量的Zn粉和过量的2 mol·L-1的A溶液,煮沸5~8 min,经检验溶液合格后,继续用浓度为0.02000 mol·L-1的KMnO4标准溶液滴定至终点,记下滴定管内液面读数为cmL;
③重复以上实验1~2次;
④数据处理。
(1)以上实验方案中的A溶液最合适的是_______ 。
(2)以上实验方案中滴定终点锥形瓶内溶液的颜色变化为_______ 。
(3)以上步骤②中Zn粉的作用_______ ,检验溶液是否合格最合适的试剂是_______ 。
(4)某小组的一次实验测定数据记录如下:
计算0.1970 g样品中:n(Fe2+)=_______ ;n( )=
)=_______ 。
①将准确称量的ag草酸亚铁样品置于250 mL的锥形瓶内,加入适量2 mol·L-1的A溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.02000 mol·L-1的KMnO4标准溶液滴定至终点,记下滴定管内液面读数为bmL(滴定管起始读数为0.00);
②向上述滴定后混合液中加入适量的Zn粉和过量的2 mol·L-1的A溶液,煮沸5~8 min,经检验溶液合格后,继续用浓度为0.02000 mol·L-1的KMnO4标准溶液滴定至终点,记下滴定管内液面读数为cmL;
③重复以上实验1~2次;
④数据处理。
(1)以上实验方案中的A溶液最合适的是
(2)以上实验方案中滴定终点锥形瓶内溶液的颜色变化为
(3)以上步骤②中Zn粉的作用
(4)某小组的一次实验测定数据记录如下:
| a(g) | 起始读数(mL) | b(mL) | c(mL) |
| 0.1970 | 0.00 | 31.30 | 42.40 |
 )=
)=
您最近一年使用:0次
解题方法
8 . 某同学取氧化铁和铝粉混合物按教材中的实验装置(如图)进行铝热反应。反应开始后,持续有大量熔融物落人下方的沙子中。已知Al、 、Fe、
、Fe、 熔点、沸点数据如下表:
熔点、沸点数据如下表:

(1)氧化铁和铝粉都选用粉末状的,这样做的目的是_______ 。
(2)该铝热反应的化学方程式为_______ 。请写出该铝热反应的一种应用_______ 。
(3)甲同学根据表中熔沸点数据,推测熔融物成分是铝铁合金,该推测_______ (填“不合理”或“合理”),验证熔融物中含有铁的一种最简单的方法是_______ 。
(4)为证明熔融物中含有铝单质并测量铝单质的百分含量,可取反应后的熔融物研碎取样称量,加入如图所示装置,滴入足量NaOH溶液充分反应,测量生成气体体积。
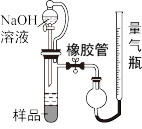
①样品与NaOH溶液反应,可观察到的现象是_______ 。
②装置中使用带橡胶管的分液漏斗代替普通分液漏斗,目的是_______ 。如果装置使用普通分液漏斗,测量出的铝单质的百分含量将会_______ 。(填“偏大”或“偏小”)。
(5)为确定熔融物中是否还有残留的 ,乙同学将熔融物用稀硫酸溶解后并加入KSCN试剂,发现溶液没有变红,乙同学得出的结论是:熔融物无残留的
,乙同学将熔融物用稀硫酸溶解后并加入KSCN试剂,发现溶液没有变红,乙同学得出的结论是:熔融物无残留的 。但老师指出其结论不准确,原因是熔融物中的
。但老师指出其结论不准确,原因是熔融物中的_______ (填化学式)可能将酸溶后所得的 还原为
还原为 。
。
 、Fe、
、Fe、 熔点、沸点数据如下表:
熔点、沸点数据如下表:| 物质 | Al |  | Fe |  |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |

(1)氧化铁和铝粉都选用粉末状的,这样做的目的是
(2)该铝热反应的化学方程式为
(3)甲同学根据表中熔沸点数据,推测熔融物成分是铝铁合金,该推测
(4)为证明熔融物中含有铝单质并测量铝单质的百分含量,可取反应后的熔融物研碎取样称量,加入如图所示装置,滴入足量NaOH溶液充分反应,测量生成气体体积。

①样品与NaOH溶液反应,可观察到的现象是
②装置中使用带橡胶管的分液漏斗代替普通分液漏斗,目的是
(5)为确定熔融物中是否还有残留的
 ,乙同学将熔融物用稀硫酸溶解后并加入KSCN试剂,发现溶液没有变红,乙同学得出的结论是:熔融物无残留的
,乙同学将熔融物用稀硫酸溶解后并加入KSCN试剂,发现溶液没有变红,乙同学得出的结论是:熔融物无残留的 。但老师指出其结论不准确,原因是熔融物中的
。但老师指出其结论不准确,原因是熔融物中的 还原为
还原为 。
。
您最近一年使用:0次
名校
解题方法
9 . 铁及其化合物在生产、生活中存在广泛用途。回答下列问题。
(1)右图所示为铁元素在周期表中的信息,方格中“55.85”的意义为:___________ 。铁在周期表中的位置是___________ 。
(2)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,生成棕黄色溶液和红褐色沉淀。写出发生变质反应的离子方程式___________ 。实验室中检验绿矾晶体是否变质的操作是:___________ 。
(3)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是___________ 和___________ 。
(4)航母舰体由合金钢制造而成,在海洋中行驶时,舰体发生的电化学腐蚀类型为___________ 腐蚀,其中正极发生的电极反应式为___________ 。
(5)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的金属元素Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Fe2+、Al3+或AlO 。为什么海水中Fe元素的含量极低?
。为什么海水中Fe元素的含量极低?___________
(6)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑。若生成2mol Na2FeO4,则反应中电子转移的物质的量为___________ mol。
(1)右图所示为铁元素在周期表中的信息,方格中“55.85”的意义为:
| 26 Fe Fe 3d64s2 55.85 |
(2)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,生成棕黄色溶液和红褐色沉淀。写出发生变质反应的离子方程式
(3)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是
(4)航母舰体由合金钢制造而成,在海洋中行驶时,舰体发生的电化学腐蚀类型为
(5)海水中含量较高的金属元素有Na、Mg、Ca等,地壳中含量最高的金属元素Al、Fe在海水中的含量却极低,以至食盐提纯过程一般无需考虑除Fe3+、Fe2+、Al3+或AlO
 。为什么海水中Fe元素的含量极低?
。为什么海水中Fe元素的含量极低?(6)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:2FeSO4+6Na2O2=2NaFeO4+2Na2O+2Na2SO4+O2↑。若生成2mol Na2FeO4,则反应中电子转移的物质的量为
您最近一年使用:0次



