1 . 根据下列装置图,回答有关问题:___________ ,该反应为可逆反应,其离子方程式为___________ 。
(2)装置乙中,直流电源a为___________ 极(填“正”或“负”),阳极反应式为___________ 。
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了___________ (填“析氢腐蚀”或“吸氧腐蚀”),其腐蚀速率比c试管中铁钉的腐蚀速率___________ (“快”“慢”或“相等”),c试管内正极的电极反应式为___________ 。
(4)装置丁中,从交换膜右侧向左侧迁移的离子是___________ ,负极的电极反应式为___________ 。
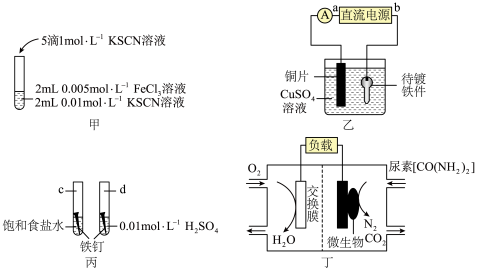
(2)装置乙中,直流电源a为
(3)装置丙中,d试管内铁钉除发生化学腐蚀外,还发生了
(4)装置丁中,从交换膜右侧向左侧迁移的离子是
您最近一年使用:0次
名校
解题方法
2 . 下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 实验方案 |
| A | CO还原Fe2O3实验中,Fe2O3是否全部被还原 | 向CO还原Fe2O3所得到的产物中加入稀盐酸,再滴加KSCN溶液,观察颜色变化 |
| B | 比较CH3COO-和ClO-结合H+的能力大小 | 室温下,用pH计分别测定等物质的量浓度的CH3COONa溶液和NaClO溶液的pH |
| C | 比较Ksp(BaSO4)和Ksp(BaCO3)的相对大小 | 将BaSO4粉末和Na2CO3饱和溶液混合,充分振荡,静置,取少量上层清液,滴加盐酸和BaCl2溶液,观察是否有沉淀产生 |
| D | 蔗糖水解产物是否具有还原性 | 向蔗糖溶液中加入少量稀硫酸,加热煮沸,冷却后加入银氨溶液,水浴加热,观察现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-17更新
|
1276次组卷
|
4卷引用:江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题
江西省宜春市宜丰中学2023-2024学年高二下学期3月月考化学试题江苏省南京市盐城市2024届高三一模考试化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)题型6 元素及其化合物 化学实验基础(25题)-2024年高考化学常考点必杀300题(新高考通用)
名校
解题方法
3 . 根据要求完成下列方程式。
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。
①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式___________ 。
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式___________ 。
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式___________ 。
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式___________ 。
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式___________ 。(提示:反应中价态不变)
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式___________ 。(已知:氯气遇到黄血盐可以得到赤血盐)
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3]
 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式
您最近一年使用:0次
名校
4 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
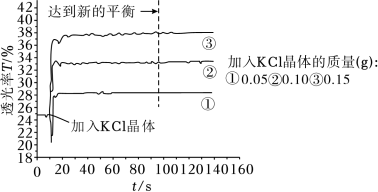
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
53次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
5 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:
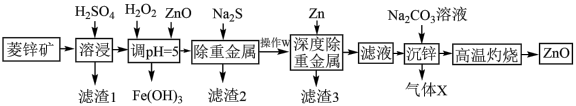
(1)写出Ni、Fe元素在周期表中的位置_______ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释_______ 。
(2)加入H2O2的目的是_______ ;“调pH”时除ZnO外还可以选用的物质是_______ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了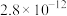 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为_______ 。证明Fe3+已除尽的化学方法是_______ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:_______ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为_______ 。
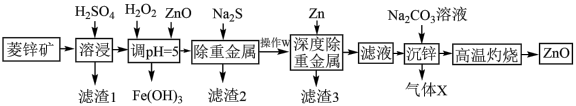
(1)写出Ni、Fe元素在周期表中的位置
(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
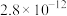 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为
您最近一年使用:0次
6 . 下列实验操作过程中不会形成配位键的是
A. 溶于 溶于 中形成紫红色的溶液 中形成紫红色的溶液 |
B. 粉末溶于水形成蓝色的溶液 粉末溶于水形成蓝色的溶液 |
C.将硫氰化铵溶液滴加到含 的溶液中检验 的溶液中检验 |
D.向 溶液中加入过量的氨水 溶液中加入过量的氨水 |
您最近一年使用:0次
2024-03-29更新
|
322次组卷
|
3卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二下学期第1次月考化学试题
7 . Ⅰ.中国“奋斗号”载人潜水器在马里亚纳海沟成功坐底深度10909米,挑战了全球海洋最深处。国产新型钛合金、能源供给锂电池等功不可没。磷酸亚铁锂(LiFePO4)可作为锂电池的正极材料,请回答下列问题:
(1)潜水器外壳使用的钛合金
| A.耐高压 | B.耐腐蚀 | C.硬度小 | D.密度小 |
(2)磷酸亚铁锂(LiFePO4)中Fe的化合价为
(3)铁元素的相关信息如图所示,其相对原子质量是

(4)有关铁的性质,说法正确的是________。
| A.在空气中,加热Fe(OH)2可得FeO |
| B.一定条件下,Fe 能与水蒸气反应生成H2 |
| C.常温下,Fe与浓硫酸能反应生成SO2 |
| D.实验室用FeCl3溶液与NaOH溶液反应制备Fe(OH)3胶体 |
(5)古代中国四大发明之一的司南是由天然的磁石制成的,其主要成分是________。
| A.Fe | B.FeO | C.Fe2O3 | D.Fe3O4 |
(6)要检验Fe3+,可选用的试剂是________。
| A.KSCN 溶液 | B.KMnO4溶液 | C.稀硝酸 | D.BaCl2溶液 |
Ⅱ.钠是生活中常见的金属元素,其多种化合物因其特殊性质在生活中都有广泛应用,例如,NaHCO3可用作食品膨松剂、Na2O2可用作供氧剂等。
(7)NaHCO3可用作膨松剂,原因是
(8)下列电离方程式正确的是________。
| A.NaOH = Na+ + O2-+ H+ | B.H2O = H+ + OH- |
C.HClO ClO-+ H+ ClO-+ H+ | D.CH3COONH4 CH3COO-+ NH4+ CH3COO-+ NH4+ |
(9)钠与滴加酚酞的水反应时
| A.钠浮在水面上 | B.钠熔成小球 | C.钠静止在水面上 | D.溶液变为红色 |
(10)Na2O2可作载人潜水器供氧剂,下列关于Na2O2说法正确的是________。
| A.只有离子键 | B.可在常温下由Na与O2反应制得 |
| C.Na2O2与H2O发生化合反应 | D.Na2O2与CO2反应有O2生成 |
您最近一年使用:0次
名校
解题方法
8 . 某实验小组为探究 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.
Ⅰ.探究 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为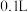 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: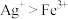 .
.
(1)检验溶液中还有 剩余的试剂为
剩余的试剂为___________ 。
(2)相较于 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为______________________________ 。
Ⅱ.探究反应 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
(3)若要证明该反应为可逆反应,只需用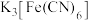 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式_________________________ 。
Ⅲ.测定反应 的平衡常数
的平衡常数
取 中上层清液,用
中上层清液,用 酸性
酸性 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.
(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是___________ ;滴定终点时的现象为___________ 。
(5)平衡时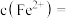
___________ (用含V、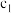 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值___________ (填“偏大”“偏小”或“不影响”)。
 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.Ⅰ.探究
 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为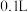 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: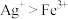 .
.(1)检验溶液中还有
 剩余的试剂为
剩余的试剂为(2)相较于
 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为Ⅱ.探究反应
 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.(3)若要证明该反应为可逆反应,只需用
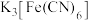 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式Ⅲ.测定反应
 的平衡常数
的平衡常数 取
 中上层清液,用
中上层清液,用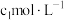 酸性
酸性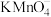 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是
(5)平衡时
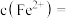
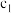 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值
您最近一年使用:0次
9 . 铁酸锌(ZnFe2O4)是可见光的敏感半导体材料,也可以用作脱硫剂,难溶于水和稀硫酸,以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4的过程可以表示为下图:

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:___________ 。
(2)下列说法正确的是___________。
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)___________ 。
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:___________ 。
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为___________ 。

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:
(2)下列说法正确的是___________。
| A.杂质中的SiO2属于酸性氧化物,能与Fe2O3反应 |
| B.除杂过程包括加足量锌粉、双氧水氧化等步骤,除Pb2+和Cu2+外,与锌粉反应的离子还有Fe3+和H+ |
| C.碳酸氢钠是为了调节溶液的pH,也可以用弱碱NH3·H2O代替 |
| D.ZnFe2O4难溶于稀硫酸,但在SO2-H2SO4体系中溶解度会明显增大 |
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为
您最近一年使用:0次
名校
解题方法
10 . 向盛有少量蒸馏水的试管里滴加2滴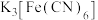 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。
下列说法正确的是
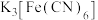 溶液,然后再滴加2滴硫氰化钾溶液。
溶液,然后再滴加2滴硫氰化钾溶液。下列说法正确的是
| A.溶液颜色由黄色变为红色 |
B. 中由 中由 提供孤电子对, 提供孤电子对, 提供空轨道 提供空轨道 |
C. 和 和 与 与 的配位能力: 的配位能力: |
D. 中含 中含 键的物质的量为 键的物质的量为 |
您最近一年使用:0次
2024-02-16更新
|
240次组卷
|
2卷引用:重庆市南开中学2023-2024学年高二上学期期末考试化学试题



