名校
1 . KSCN是实验室常用的化学试剂。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。
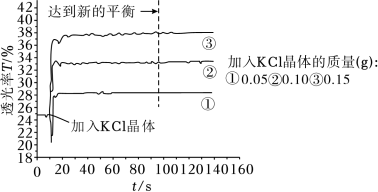
已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl- [FeCl4]-(黄色)。
[FeCl4]-(黄色)。
①采用FeCl3稀溶液是为了避免_______ (填离子符号)的颜色对实验干扰。
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度_______ (填“增大”“减小”或“不变”),从平衡移动的角度分析可能的原因_______ 。
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O +I2=S4O
+I2=S4O +2I-;
+2I-;
ii.I2+I- I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;
iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为_______ ;根据信息预测最终测定的结果将_______ (填“偏大”“偏小”或“无影响”)。
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式_______ ;到达滴定终点时消耗标准液20.00mL,样品中铜元素质量分数为_______ ,滴定后仍存在少量CuI沉淀,测得溶液中c(I-)=0.2mol•L-1,则c(SCN-)=_______ 。
(1)探究KCl浓度对Fe3+与SCN-显色反应的影响
将25mL0.005mol•L-1FeCl3与25mL0.01mol•L-1KSCN溶液混合得红色溶液,各取3mL溶液分别加KCl晶体进行透光实验,结果如图所示。

已知:i.溶液颜色越浅,透光率(T)越高;
ii.FeCl3溶液中存在Fe3++4Cl-
 [FeCl4]-(黄色)。
[FeCl4]-(黄色)。①采用FeCl3稀溶液是为了避免
②由实验结果分析,随着KCl浓度增大,Fe(SCN)3的浓度
(2)探究KSCN在铜含量测定过程中的作用
步骤如下:取1.0g铜盐样品溶于稀盐酸配成250mL溶液,取10.00mL加入过量KI充分反应,用0.0100mol•L-1的Na2S2O3标准液滴定至终点。
已知:i.2Cu2++4I-=2CuI↓+I2;2S2O
 +I2=S4O
+I2=S4O +2I-;
+2I-;ii.I2+I-
 I
I ,CuI沉淀强烈吸附I
,CuI沉淀强烈吸附I ;
;iii.Ksp(CuI)=1.0×10-12;Ksp(CuSCN)=4.8×10-15
①以淀粉为指示剂,滴定终点的颜色变化为
②通过实验探究,在滴定过程中加入KSCN可使测定结果更准确,写出发生反应的离子方程式
您最近一年使用:0次
2024-04-05更新
|
61次组卷
|
3卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高二下学期开学化学试题
2 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:
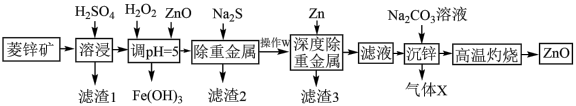
(1)写出Ni、Fe元素在周期表中的位置_______ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释_______ 。
(2)加入H2O2的目的是_______ ;“调pH”时除ZnO外还可以选用的物质是_______ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了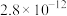 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为_______ 。证明Fe3+已除尽的化学方法是_______ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:_______ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为_______ 。
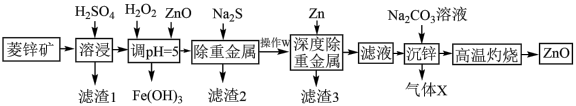
(1)写出Ni、Fe元素在周期表中的位置
(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
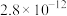 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是_______。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
(6)活性氧化锌纯度测定,已知:1.0mL1.0mol/LEDTA标准溶液相当于氧化锌质量为0.080克。取w克所得活性氧化锌样品配成含Zn2+的待测液,用c mol/LEDTA标准液进行滴定,消耗标准液VmL。计算产品中氧化锌纯度为
您最近一年使用:0次
名校
解题方法
3 . 某实验小组为探究 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.
Ⅰ.探究 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为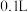 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: .
.
(1)检验溶液中还有 剩余的试剂为
剩余的试剂为___________ 。
(2)相较于 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为______________________________ 。
Ⅱ.探究反应 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
(3)若要证明该反应为可逆反应,只需用 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式_________________________ 。
Ⅲ.测定反应 的平衡常数
的平衡常数
取 中上层清液,用
中上层清液,用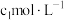 酸性
酸性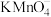 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.
(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是___________ ;滴定终点时的现象为___________ 。
(5)平衡时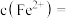
___________ (用含V、 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值___________ (填“偏大”“偏小”或“不影响”)。
 和
和 的氧化能力设计如下实验.
的氧化能力设计如下实验.Ⅰ.探究
 和
和 氧化
氧化 的速率向体积均为
的速率向体积均为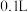 、浓度均为
、浓度均为 的
的 溶液和
溶液和 溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验,
溶液中加入表面积相同、质量相等的铜片,反应一段时间后,经检验, 已完全消耗,
已完全消耗, 还有剩余.该小组同学猜测
还有剩余.该小组同学猜测 和
和 的氧化能力:
的氧化能力: .
.(1)检验溶液中还有
 剩余的试剂为
剩余的试剂为(2)相较于
 溶液,
溶液, 溶液和铜反应速率较快的原因为
溶液和铜反应速率较快的原因为Ⅱ.探究反应
 为可逆反应 将浓度均为
为可逆反应 将浓度均为 的
的 溶液和
溶液和 溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.
溶液等体积混合,一段时间后,溶液变为黄色,且有灰黑色沉淀生成.(3)若要证明该反应为可逆反应,只需用
 溶液检测出有
溶液检测出有 的存在即可,写出该检测反应的离子方程式
的存在即可,写出该检测反应的离子方程式Ⅲ.测定反应
 的平衡常数
的平衡常数 取
 中上层清液,用
中上层清液,用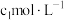 酸性
酸性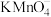 溶液滴定上层清液中剩余的
溶液滴定上层清液中剩余的 ,并记录滴定终点所消耗的酸性
,并记录滴定终点所消耗的酸性 溶液的体积;重复滴定3次,平均消耗酸性
溶液的体积;重复滴定3次,平均消耗酸性 溶液的体积为
溶液的体积为 .
.(4)滴定至接近终点时,控制标准溶液半滴滴入,其操作是用锥形瓶口内壁轻靠滴定管尖嘴悬挂的液滴.要使这半滴液体流入锥形瓶内的操作是
(5)平衡时
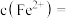
 、
、 的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性
的代数式表示),由此可计算出反应的平衡常数K.若盛装酸性 溶液的滴定管未润洗,则计算得到的K值
溶液的滴定管未润洗,则计算得到的K值
您最近一年使用:0次
4 . 铁酸锌(ZnFe2O4)是可见光的敏感半导体材料,也可以用作脱硫剂,难溶于水和稀硫酸,以锌灰(含ZnO及少量PbO、CuO、Fe2O3、SiO2)和Fe2(SO4)3为原料制备的ZnFe2O4的过程可以表示为下图:

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:___________ 。
(2)下列说法正确的是___________。
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)___________ 。
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:___________ 。
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为___________ 。

已知:锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性
(1)请写出ZnO与氢氧化钠溶液反应的化学反应方程式:
(2)下列说法正确的是___________。
| A.杂质中的SiO2属于酸性氧化物,能与Fe2O3反应 |
| B.除杂过程包括加足量锌粉、双氧水氧化等步骤,除Pb2+和Cu2+外,与锌粉反应的离子还有Fe3+和H+ |
| C.碳酸氢钠是为了调节溶液的pH,也可以用弱碱NH3·H2O代替 |
| D.ZnFe2O4难溶于稀硫酸,但在SO2-H2SO4体系中溶解度会明显增大 |
(3)浸取过程中为了提高锌灰的浸取效果,还可以采取哪些方法(写出两种)
(4)700℃时ZnFe2O4会分解,设计实验验证ZnFe2O4中含有Fe元素:
(5)400℃时,装有脱硫剂的硫化反应器中,ZnFe2O4与H2、H2S反应生硫化物,其化学方程式为
您最近一年使用:0次
解题方法
5 . 磷酸亚铁[Fe3(PO4)2⋅8H2O]为白蓝色晶体,溶于强酸,不溶于水、醋酸和乙醇。主要用于制造磷酸铁锂电池。
(1)实验室制备磷酸亚铁晶体的步骤如下:
步骤1 在下图所示的三颈烧瓶中先加入抗坏血酸( )稀溶液作底液。
)稀溶液作底液。
步骤2 向三颈烧瓶中,滴入 与
与 混合溶液至pH=4。
混合溶液至pH=4。
步骤3 滴入 溶液,最终维持pH=6,充分反应后,静置。
溶液,最终维持pH=6,充分反应后,静置。
步骤4 过滤、洗涤,干燥得磷酸亚铁晶体。
①常温下, 溶液的水解平衡常数为
溶液的水解平衡常数为_______ ;该溶液呈_______ (填“酸性”、“碱性”或“中性”)。[已知 ,
, ,
, ]
]
②实验中配制 溶液时,先要对蒸馏水进行的操作是
溶液时,先要对蒸馏水进行的操作是_______ 。
③实验过程中,反应时需不断搅拌的目的是_______ 。
④制备磷酸亚铁主要反应的化学方程式为_______ 。
⑤检验磷酸亚铁粗产品中混有杂质(氢氧化铁)的方法是_______ 。
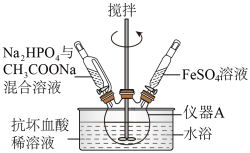
(2)由上述制得的磷酸亚铁粗产品(混有氢氧化铁)可制备磷酸铁( )。其他条件一定,制备
)。其他条件一定,制备 时测得Fe的有效转化率
时测得Fe的有效转化率 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
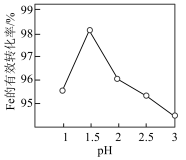
请设计制备磷酸铁的实验方案:_______ 。(实验中须使用的试剂有:1
 ,30%
,30% 溶液,1
溶液,1
 )。
)。
(1)实验室制备磷酸亚铁晶体的步骤如下:
步骤1 在下图所示的三颈烧瓶中先加入抗坏血酸(
 )稀溶液作底液。
)稀溶液作底液。步骤2 向三颈烧瓶中,滴入
 与
与 混合溶液至pH=4。
混合溶液至pH=4。步骤3 滴入
 溶液,最终维持pH=6,充分反应后,静置。
溶液,最终维持pH=6,充分反应后,静置。步骤4 过滤、洗涤,干燥得磷酸亚铁晶体。

①常温下,
 溶液的水解平衡常数为
溶液的水解平衡常数为 ,
, ,
, ]
]②实验中配制
 溶液时,先要对蒸馏水进行的操作是
溶液时,先要对蒸馏水进行的操作是③实验过程中,反应时需不断搅拌的目的是
④制备磷酸亚铁主要反应的化学方程式为
⑤检验磷酸亚铁粗产品中混有杂质(氢氧化铁)的方法是
(2)由上述制得的磷酸亚铁粗产品(混有氢氧化铁)可制备磷酸铁(
 )。其他条件一定,制备
)。其他条件一定,制备 时测得Fe的有效转化率
时测得Fe的有效转化率 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
请设计制备磷酸铁的实验方案:

 ,30%
,30% 溶液,1
溶液,1
 )。
)。
您最近一年使用:0次
名校
6 .  是中学化学实验中常用的试剂。回答下列问题:
是中学化学实验中常用的试剂。回答下列问题:
(1) 溶液中存在:
溶液中存在: 。
。
①实验室配制 溶液的操作是取一定量
溶液的操作是取一定量 固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是
固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是___________ 。
②对 溶液进行加热,溶液变为红褐色,由此判断,
溶液进行加热,溶液变为红褐色,由此判断,
___________ 0(填“>”或“<”),判断理由是___________ 。
(2)在稀 溶液中滴加几滴
溶液中滴加几滴 溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
①参照组甲溶液颜色为___________ 。
②解释产生实验I中现象的原因:___________ 。
③实验III中产生异常现象的原因可能是___________ ,为了验证该猜想,请设计简单实验:___________ 。
 是中学化学实验中常用的试剂。回答下列问题:
是中学化学实验中常用的试剂。回答下列问题:(1)
 溶液中存在:
溶液中存在: 。
。①实验室配制
 溶液的操作是取一定量
溶液的操作是取一定量 固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是
固体溶于浓硝酸中,加入蒸馏水稀释至指定体积。其中,浓硝酸的作用是②对
 溶液进行加热,溶液变为红褐色,由此判断,
溶液进行加热,溶液变为红褐色,由此判断,
(2)在稀
 溶液中滴加几滴
溶液中滴加几滴 溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):
溶液,将所得溶液分成甲、乙、丙、丁四份并进行如下实验(甲为参照组):| 序号 | 操作 | 现象 |
| I | 向乙中加入少量铁粉,振荡 | 溶液颜色比甲浅 |
| II | 向丙中加入少量 粉末,振荡 粉末,振荡 | 溶液颜色与甲无明显变化 |
| III | 向丁中滴加足量的新制氯水,振荡 | 溶液颜色变为黄色 |
②解释产生实验I中现象的原因:
③实验III中产生异常现象的原因可能是
您最近一年使用:0次
2023-12-01更新
|
24次组卷
|
2卷引用:海南省海南华侨中学 海南省农垦中学2023-2024学年高二上学期11月学业水平测试期中联考化学试题
名校
解题方法
7 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
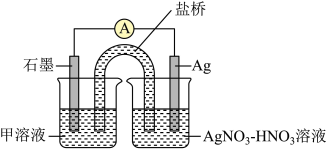
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
612次组卷
|
7卷引用:湖南省娄底市新化县2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 高铁酸钾(K2FeO4)是一种优良的杀菌消毒剂和净水剂,实验小组制备高铁酸钾并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。_____ ;A中反应的化学方程式为_____ 。
(2)装置B盛放的试剂为_____ ,若省略该装置造成的后果为_____ 。
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有_____ (任答两点)。
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为_____ (填选项字母),原因为_____ 。
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为_____ 。
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为_____ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。
(2)装置B盛放的试剂为
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为
您最近一年使用:0次
解题方法
9 . 铁及其化合物在生活、生产上有重要的应用。
(1)常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损,___________ (填“白铁皮”或“马口铁”)腐蚀速率更快。
(2)铁元素的常见价态有+2、+3价,Fe2+比Fe3+的稳定性弱的原因是___________ 。
(3)依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可与Fe2+形成橙红色配合物)
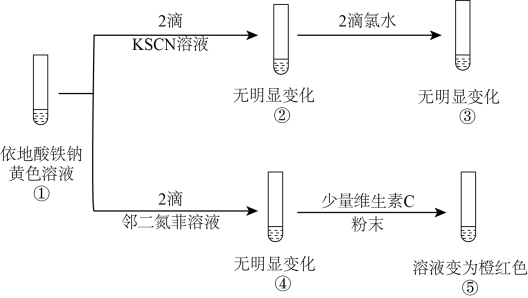
下列说法正确的是___________ (填字母)。
a.依据现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
b.依据现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
c.依据现象①、②和③推测,SCN-与Fe3+形成配合物的稳定性强于依地酸铁钠
d.依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与Fe2+形成的配合物更稳定
(4)高铁酸钠(Na2FeO4)是一种新型水处理剂,用高铁酸钠处理水时被还原为Fe3+。某兴趣小组欲以硫铁矿(主要成分为FeS2,有少量SiO2等杂质)为原料制备高铁酸钠的工艺流程如下:
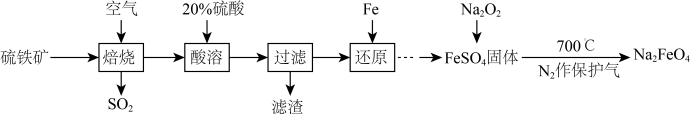
回答下列问题:
①焙烧前硫铁矿需粉碎,其目的是___________ 。
②焙烧后得到的固体主要成分为Fe2O3,写出焙烧过程主要反应的化学方程式:___________ 。
③还原反应的离子方程式为___________ 。
(5)高铁酸钠(Na2FeO4)易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。将NaClO(含NaOH)饱和溶液与FeCl3饱和溶液(显酸性)混合也可湿法制取高铁酸钠。具体做法是:边搅拌,边将___________ 缓慢滴加到___________ 中得Na2FeO4,写出该反应的离子方程式___________ 。
(1)常用的白铁皮是在薄钢板表面镀上一层锌,罐装食品用的马口铁是在薄钢板表面镀上一层锡。若上述两种钢铁制品的表面出现破损,
(2)铁元素的常见价态有+2、+3价,Fe2+比Fe3+的稳定性弱的原因是
(3)依地酸铁钠是一种强化补铁剂。某实验小组采用如下实验探究该补铁剂中铁元素的化合价。(已知:依地酸根是常见的配体,邻二氮菲可与Fe2+形成橙红色配合物)

下列说法正确的是
a.依据现象②和③推测,依地酸铁钠中不含Fe(Ⅲ)
b.依据现象②和⑤推测,依地酸铁钠中含Fe(Ⅱ)
c.依据现象①、②和③推测,SCN-与Fe3+形成配合物的稳定性强于依地酸铁钠
d.依据现象①、④和⑤推测,与依地酸根相比,邻二氮菲与Fe2+形成的配合物更稳定
(4)高铁酸钠(Na2FeO4)是一种新型水处理剂,用高铁酸钠处理水时被还原为Fe3+。某兴趣小组欲以硫铁矿(主要成分为FeS2,有少量SiO2等杂质)为原料制备高铁酸钠的工艺流程如下:

回答下列问题:
①焙烧前硫铁矿需粉碎,其目的是
②焙烧后得到的固体主要成分为Fe2O3,写出焙烧过程主要反应的化学方程式:
③还原反应的离子方程式为
(5)高铁酸钠(Na2FeO4)易溶于水,微溶于浓KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在0℃~5℃、强碱性溶液中较稳定。将NaClO(含NaOH)饱和溶液与FeCl3饱和溶液(显酸性)混合也可湿法制取高铁酸钠。具体做法是:边搅拌,边将
您最近一年使用:0次
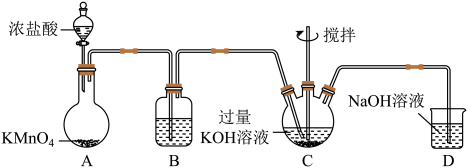
10 . 据公安部统计,截至2023年6月底,成都汽车保有量超过600万辆,仅次于北京,居全国第二、高密度的车辆行驶,容易引发交通事故,若车辆受到相对较大撞击,就会引起安全气囊弹出,从而保护车内乘客。叠氮化钠是汽车安全气囊内的重要填充物质。某化学兴趣小组根据工业制备叠氮化钠(NaN3)的方法在实验室设计出制备该物质的装置如下:
已知:ⅰ.工业上制备 的原理分两步进行:
的原理分两步进行:
①将 通入熔融状态的Na中先制得
通入熔融状态的Na中先制得 ,
,
②将 与
与 加热至
加热至 左右合成
左右合成 ,在合成过程中,易发生副反应:
,在合成过程中,易发生副反应: ;
;
ⅱ. 和
和 的性质如下表:
的性质如下表:
ⅲ. 属于危险化学药品,工业上一般用NaClO销毁剩余
属于危险化学药品,工业上一般用NaClO销毁剩余 ;
;
ⅳ. 与
与 离子反应产生鲜明的血红色,此反应非常灵敏。
离子反应产生鲜明的血红色,此反应非常灵敏。
回答下列问题:
(1)盛装浓氨水的仪器的名称是___________ 。
(2)连接好装置之后,应进行的操作是___________ 。
(3)实验室用 和稀硝酸反应制备
和稀硝酸反应制备 ,其离子方程式为
,其离子方程式为___________ 。
(4)图中虚线框处应选用的装置是___________ (填标号)。

(5)安全气囊中填充 的理由是
的理由是___________ 。
(6)在销毁多余 时会有
时会有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为___________ ;如何检测销毁是否彻底,请提供一种检测方法:___________ 。

已知:ⅰ.工业上制备
 的原理分两步进行:
的原理分两步进行:①将
 通入熔融状态的Na中先制得
通入熔融状态的Na中先制得 ,
,②将
 与
与 加热至
加热至 左右合成
左右合成 ,在合成过程中,易发生副反应:
,在合成过程中,易发生副反应: ;
;ⅱ.
 和
和 的性质如下表:
的性质如下表:| 物质 |  |  |
| 性质 | 白色固体,易溶于水,有一定危险性,受撞击易快速分解出一种无色、无味、无毒的气体,且有固体Na生成。 | 无色、有甜味的气体,有轻微麻醉作用,常用于医疗,有一定氧化性。 |
 属于危险化学药品,工业上一般用NaClO销毁剩余
属于危险化学药品,工业上一般用NaClO销毁剩余 ;
;ⅳ.
 与
与 离子反应产生鲜明的血红色,此反应非常灵敏。
离子反应产生鲜明的血红色,此反应非常灵敏。回答下列问题:
(1)盛装浓氨水的仪器的名称是
(2)连接好装置之后,应进行的操作是
(3)实验室用
 和稀硝酸反应制备
和稀硝酸反应制备 ,其离子方程式为
,其离子方程式为(4)图中虚线框处应选用的装置是

(5)安全气囊中填充
 的理由是
的理由是(6)在销毁多余
 时会有
时会有 和
和 生成,该反应的化学方程式为
生成,该反应的化学方程式为
您最近一年使用:0次



