解题方法
1 . 用锰废料(含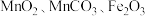 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下:
(1)流程中将锰废料粉碎的原因是_________ 。
(2)通入 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为__________ ,能证明“吸收”后上层清液中没有 的试剂为
的试剂为_________ 。
(3)加入 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式________ ,所得“滤渣”的主要成分为_________ 。
(4)“化浆”操作中,________ (填“能”或“不能”)将稀硫酸换成稀盐酸;
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为____ 。
(6)“系列操作”是过滤、洗涤、干燥,证明 洗涤干净的操作为
洗涤干净的操作为______ 。
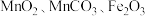 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下: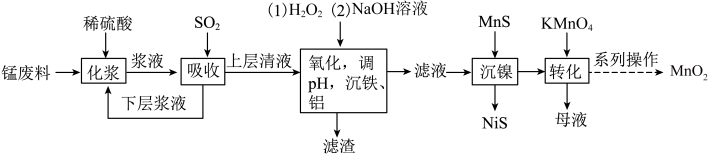
(1)流程中将锰废料粉碎的原因是
(2)通入
 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为 的试剂为
的试剂为(3)加入
 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式(4)“化浆”操作中,
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为
(6)“系列操作”是过滤、洗涤、干燥,证明
 洗涤干净的操作为
洗涤干净的操作为
您最近一年使用:0次
2 . 电子工业中常用FeCl3溶液做“腐蚀液”,腐蚀覆铜板制作印刷电路板。为使“腐蚀液”能得到循环利用并回收铜的流程图如下:
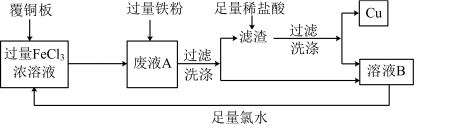
(1)写出FeCl3溶液与铜反应的离子方程式___________ 。
(2)滤渣的成分为___________ (填化学式)。
(3)加足量氯水后反应的离子方程式为___________ 。
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是___________ 。
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
①判断等物质的量的四种氧化剂分别与足量的酸性FeSO4溶液反应,得到Fe3+最多的是___________ (填化学式)。
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式___________ 。
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为___________ mol/L。

(1)写出FeCl3溶液与铜反应的离子方程式
(2)滤渣的成分为
(3)加足量氯水后反应的离子方程式为
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
| 氧化剂 | KMnO4 | KClO3 | H2O2 | Cl2 |
| 还原产物 | Mn2+ | Cl- | H2O | Cl- |
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为
您最近一年使用:0次
解题方法
3 . 高铁酸钾( )是一种高效、无毒的强氧化剂。在工业上,一种通过
)是一种高效、无毒的强氧化剂。在工业上,一种通过 溶液制备
溶液制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:

(1) 中Fe元素的化合价为
中Fe元素的化合价为______ 价,NaOH的电子式为______ 。
(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为______ 。Fe2+在溶液中放置不稳定,易被氧化成Fe3+,用KSCN溶液检验溶液中的Fe3+是较好的方法,此法的离子方程式为______ 。
(3)通过“氧化”时发生的反应可知,在该条件下物质氧化性: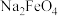
______ NaClO(填“>”或“<”)。
(4)“转化”时,发生反应的化学方程式为______ ,说明物质的溶解度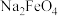
______ (填“>”或“<”) 。
。
 )是一种高效、无毒的强氧化剂。在工业上,一种通过
)是一种高效、无毒的强氧化剂。在工业上,一种通过 溶液制备
溶液制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:
(1)
 中Fe元素的化合价为
中Fe元素的化合价为(2)“氧化、沉淀”时,氧化剂和还原剂的物质的量之比为
(3)通过“氧化”时发生的反应可知,在该条件下物质氧化性:
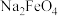
(4)“转化”时,发生反应的化学方程式为
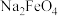
 。
。
您最近一年使用:0次
名校
4 . 已知某工业废水中含有大量的 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: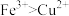 。
。
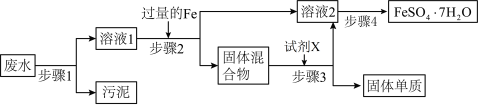
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是___________ (填离子符号)
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是___________ (填离子符号)。
(3) 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度___________ (填“有”或“无)影响,理由是___________ 。
(4)检验上述工业废水中是否存在 常用方法的名称是
常用方法的名称是___________ 。
(5)步骤3中加入的试剂X为________ (填试剂名称),发生反应的离子方程式为_________ 。
(6)步骤4中涉及的操作是:___________ 、___________ 、过滤、洗涤、烘干。烘干操作需在低温条件下进行,原因是___________ 。
 ,还可能大量存在
,还可能大量存在 中的几种,以及部分污泥,通过下列流程可从该废水中回收
中的几种,以及部分污泥,通过下列流程可从该废水中回收 晶体及固体单质。已知氧化性:
晶体及固体单质。已知氧化性: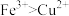 。
。
(1)不做任何实验就可以确定上述工业废水中一定不存在的离子是
(2)根据步骤2中得到固体混合物可以确定上述工业废水中肯定存在的离子是
(3)
 的存在对回收
的存在对回收 晶体的纯度
晶体的纯度(4)检验上述工业废水中是否存在
 常用方法的名称是
常用方法的名称是(5)步骤3中加入的试剂X为
(6)步骤4中涉及的操作是:
您最近一年使用:0次
解题方法
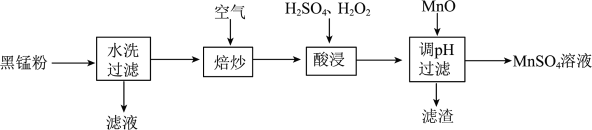
5 . 为了保护环境、利用锰资源,可通过如下流程用废旧电池中黑锰粉(含有 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是_______ , 中含有的化学键类型是
中含有的化学键类型是_______ 。
(2)“焙炒”时 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是_______ ;写出 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式_______ 。
(3)加快“酸浸”速率的措施是_______ (写两条即可);“酸浸”时除了固体溶解、溶液颜色变化外,还可能有的现象是_______ ;“酸浸”中加 的目的是
的目的是_______ 。
(4)“滤渣”的主要成分是_______ 。
(5)请设计实验方案检验所得 溶液中无
溶液中无 :
:_______ (写出操作、现象和结论)。
 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是
 中含有的化学键类型是
中含有的化学键类型是(2)“焙炒”时
 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式(3)加快“酸浸”速率的措施是
 的目的是
的目的是(4)“滤渣”的主要成分是
(5)请设计实验方案检验所得
 溶液中无
溶液中无 :
:
您最近一年使用:0次
解题方法
6 . I.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
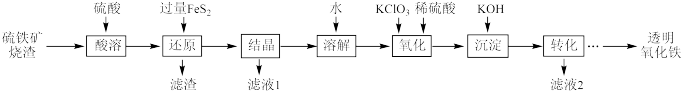
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为___________ 。
(2)“滤渣”中的主要成分是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“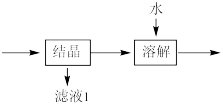 ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
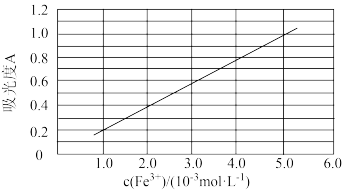
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为___________ %(保留小数点后一位)。
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:
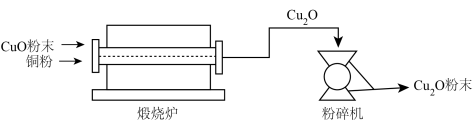
(7)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(7)粉碎机中,发生的变化属于
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次
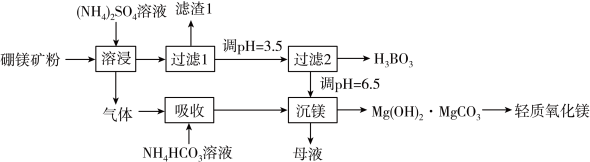
7 . 硼酸( )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含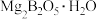 、
、 及少量
及少量 、
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:
回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式___________ 。
(2)“滤渣1”的主要成分有___________ (填化学式)。为检验“过滤1”后的滤液中是否含有 离子,可选用的化学试剂是
离子,可选用的化学试剂是___________ (填化学式)。
(3)已知 的电离方程式为
的电离方程式为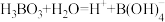 ,可知
,可知 为
为___________ 元弱酸,请写出 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式___________ ;“过滤2”前,将溶液pH调节至3.5的目的是___________ 。
(4)“沉镁”后分离生成的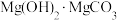 沉淀的操作为
沉淀的操作为___________ ,母液经加热后可返回___________ (填“溶浸”“吸收”或“沉镁”)工序循环使用。高温焙烧碱式碳酸镁可制备轻质氧化镁,写出化学方程式___________ 。
 )是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含
)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。一种以硼镁矿(含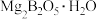 、
、 及少量
及少量 、
、 )为原料生产硼酸及轻质氧化镁的工艺流程如下:
)为原料生产硼酸及轻质氧化镁的工艺流程如下:
已知:

回答下列问题:
(1)在95℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式
(2)“滤渣1”的主要成分有
 离子,可选用的化学试剂是
离子,可选用的化学试剂是(3)已知
 的电离方程式为
的电离方程式为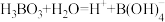 ,可知
,可知 为
为 与足量
与足量 溶液反应的离子方程式
溶液反应的离子方程式(4)“沉镁”后分离生成的
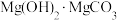 沉淀的操作为
沉淀的操作为
您最近一年使用:0次
8 . 某废旧合金材料中主要含Fe、Cu、Al及其氧化物,为节约和充分利用资源,通过如下工艺流程回收Cu、Al,并制取绿矾等。
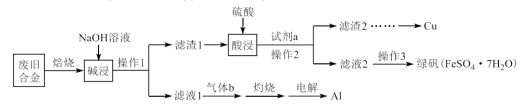
回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式_______ 。
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式_______ 。
(3)操作3包括加入少量稀硫酸、_______ 、过滤、洗涤、干燥。
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是_______ (填标号)。
a.稀盐酸、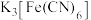 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液
c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下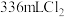 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中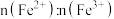 的比值是多少
的比值是多少______ (不要求计算过程)?

回答下列问题:
(1)写出“碱浸”时发生反应的化学方程式
(2)“滤液1”中通入过量“气体b”产生沉淀,写出其反应的离子方程式
(3)操作3包括加入少量稀硫酸、
(4)绿矾可用作净水剂,在医学上可用作补血剂,绿矾在空气中易被氧化为硫酸铁等。
①为检验绿矾中是否含有
 ,可选择的最佳试剂组合是
,可选择的最佳试剂组合是a.稀盐酸、
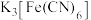 溶液 b.稀硝酸、KSCN溶液
溶液 b.稀硝酸、KSCN溶液c.稀盐酸、KSCN溶液 d.稀硫酸、NaOH溶液
②现取一定量部分被氧化的绿矾,溶于稀盐酸后,加入足量的
 溶液,过滤得9.32g沉淀;再通入标准状况下
溶液,过滤得9.32g沉淀;再通入标准状况下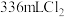 ,恰好将滤液中的
,恰好将滤液中的 完全氧化。则该绿矾中
完全氧化。则该绿矾中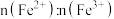 的比值是多少
的比值是多少
您最近一年使用:0次
名校
解题方法
9 . 铁是人类使用最早的金属之一。运用所学知识,回答下列问题:
(1)电子工业用 溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的化学方程式为
溶液与铜反应的化学方程式为_______ 。
(2)某研究性学习小组为测定 溶液腐蚀铜后所得溶液的组成,进行了如下实验:
溶液腐蚀铜后所得溶液的组成,进行了如下实验:
①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有_______ 。
②溶液组成测定:取50.0mL待测溶液,加入足量的 溶液,得到14.35g白色沉淀,则溶液中
溶液,得到14.35g白色沉淀,则溶液中
_______  。
。
③验证该溶液中是否含有 ,正确的实验方法是
,正确的实验方法是_______ (填序号)。
A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有
C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有
D.取适量溶液,滴入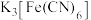 溶液,若产生蓝色沉淀,证明含有
溶液,若产生蓝色沉淀,证明含有
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:
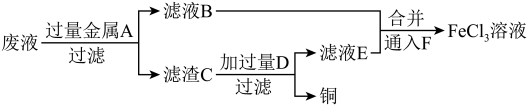
①滤渣C中物质的化学式为_______ 。
②加入过量D发生反应的离子方程式为_______ 。
③向滤液B和滤液E中通入F的目的是_______ ,该反应的离子方程式为_______ 。
④向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是_______ (填序号)。
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
(1)电子工业用
 溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀覆在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的化学方程式为
溶液与铜反应的化学方程式为(2)某研究性学习小组为测定
 溶液腐蚀铜后所得溶液的组成,进行了如下实验:
溶液腐蚀铜后所得溶液的组成,进行了如下实验:①取少量待测溶液,滴入KSCN溶液呈红色,则待测液中含有的金属阳离子有
②溶液组成测定:取50.0mL待测溶液,加入足量的
 溶液,得到14.35g白色沉淀,则溶液中
溶液,得到14.35g白色沉淀,则溶液中
 。
。③验证该溶液中是否含有
 ,正确的实验方法是
,正确的实验方法是A.观察溶液是否呈浅绿色
B.取适量溶液,滴入酸性高锰酸钾溶液,若褪色,证明含有

C.取适量溶液先滴入双氧水再滴入KSCN溶液,若溶液显红色,证明原溶液中含有

D.取适量溶液,滴入
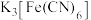 溶液,若产生蓝色沉淀,证明含有
溶液,若产生蓝色沉淀,证明含有
(3)工程师欲从制造印刷电路板的废液中回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案:
①滤渣C中物质的化学式为
②加入过量D发生反应的离子方程式为
③向滤液B和滤液E中通入F的目的是
④向盛有氯化铁、氯化亚铁、氯化铜混合溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.有铜单质剩余但无铁单质剩余 B.有铁单质剩余但无铜单质剩余
C.铁、铜单质都有剩余 D.铁、铜单质都无剩余
您最近一年使用:0次
名校
10 . 铁红( )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
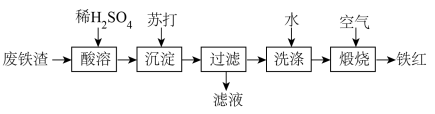
请回答下列问题:
(1)苏打的化学式为_______ ;沉淀的化学式为_______ ;“滤液”中主要溶质的化学式为_______
(2)要检测“酸溶”后,溶液中是否含有 所用的试剂是
所用的试剂是_______ ;若溶液中检测不到 的原因是
的原因是_______ ;
(3)“酸溶”时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______
(4)实验室过滤所需的玻璃仪器有_______
(5)煅烧的化学方程式为_______
 )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
请回答下列问题:
(1)苏打的化学式为
(2)要检测“酸溶”后,溶液中是否含有
 所用的试剂是
所用的试剂是 的原因是
的原因是(3)“酸溶”时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(4)实验室过滤所需的玻璃仪器有
(5)煅烧的化学方程式为
您最近一年使用:0次
2023-02-11更新
|
379次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题



