名校
1 . 下列离子方程式书写正确的是
A. 通入氢氧化钠溶液: 通入氢氧化钠溶液: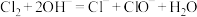 |
B. 溶液中滴加稀氨水: 溶液中滴加稀氨水: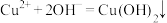 |
C.过量 通入饱和碳酸钠溶液: 通入饱和碳酸钠溶液: |
D.利用覆铜板制作印刷电路板: |
您最近半年使用:0次
2 . 下列有关实验操作、现象和结论都正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向某溶液中滴加几滴新制氯水,振荡,再加入少量 溶液,溶液变为红色 溶液,溶液变为红色 | 溶液中一定含有 |
B | 将未经打磨的铝片放入 溶液中,无气泡产生 溶液中,无气泡产生 |  溶液不能溶解 溶液不能溶解 |
C | 向等浓度等体积的 和 和 溶液中,分别滴加几滴酚酞, 溶液中,分别滴加几滴酚酞, 溶液红色更深 溶液红色更深 | 等浓度的 和 和 溶液, 溶液, 溶液碱性强 溶液碱性强 |
D | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,鲜花褪色 | 氯气具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
3 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若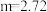 ,则充分反应后得到
,则充分反应后得到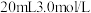 氯化亚铁溶液和
氯化亚铁溶液和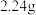 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: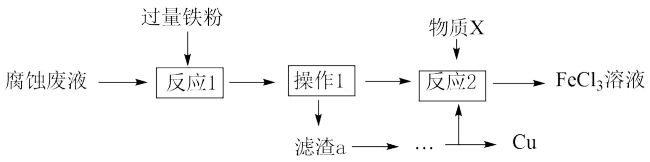
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
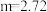 ,则充分反应后得到
,则充分反应后得到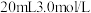 氯化亚铁溶液和
氯化亚铁溶液和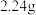 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近半年使用:0次
解题方法
4 . 化学实验是研究化学的重要途径之一。七校某化学兴趣小组在实验室分组进行实验。
I.兴趣小组一:配 溶液,请回答下列问题:
溶液,请回答下列问题:
(1)计算需要 的质量为
的质量为___________ g。
(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有________ 和________ (填名称)。
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是___________ (填序号)。
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
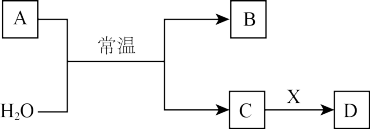
Ⅱ.A、B、C、D、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。______________ ;A的水溶液放置一段时间后,溶液的酸性变化为___________ (填“增大”、“减小”或“不变”)。
(5)若A为金属单质,C俗称烧碱。A与 反应的离子方程式为
反应的离子方程式为__________________ 。铝和烧碱溶液反应的化学方程式___________________ 。
(6)若C是磁性氧化物,则A与 反应化学方程式为
反应化学方程式为__________ ;X是稀硫酸则检验D中金属阳离子的试分别是__________ 、__________ 。
(7)除去铁红中氧化铝的离子方程式__________ 。
(8)为了验证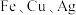 三种金属的活动性顺序,下列选用的药品可行的是
三种金属的活动性顺序,下列选用的药品可行的是__________ (填标号)。
①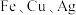 、稀盐酸
、稀盐酸
② 溶液、
溶液、 溶液
溶液
③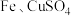 溶液、
溶液、
④ 溶液、
溶液、 溶液、
溶液、
⑤ 溶液、
溶液、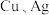
I.兴趣小组一:配
 溶液,请回答下列问题:
溶液,请回答下列问题:(1)计算需要
 的质量为
的质量为(2)配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
(3)在此配制过程中,下列情况会使所得溶液的浓度偏高的是
A.转移溶液时未洗涤烧杯和玻璃棒
B.定容时俯视刻度线观察液面
C.容量瓶用蒸馏水洗净后未干燥
D.称量固体时,砝码上沾有杂质
E.摇匀后静置,发现液面低于刻度线,再补加蒸馏水至刻度线
Ⅱ.A、B、C、D、X是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(5)若A为金属单质,C俗称烧碱。A与
 反应的离子方程式为
反应的离子方程式为(6)若C是磁性氧化物,则A与
 反应化学方程式为
反应化学方程式为(7)除去铁红中氧化铝的离子方程式
(8)为了验证
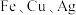 三种金属的活动性顺序,下列选用的药品可行的是
三种金属的活动性顺序,下列选用的药品可行的是①
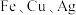 、稀盐酸
、稀盐酸②
 溶液、
溶液、 溶液
溶液③
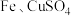 溶液、
溶液、
④
 溶液、
溶液、 溶液、
溶液、
⑤
 溶液、
溶液、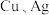
您最近半年使用:0次
解题方法
5 . 下列离子能大量共存的是
A.与铝反应产生大量气泡的溶液中: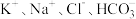 |
B.透明的溶液中: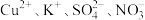 |
C.含有大量 的溶液中: 的溶液中: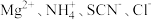 |
D.新制的氯水中: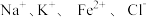 |
您最近半年使用:0次
名校
解题方法
6 . SO2是硫元素中一种重要物质。在生产生活中有着重要用途。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。_____ 。根据以上现象,该小组同学认为SO2与FeCl3溶液发生氧化还原反应。
a.请设计实验方案检验溶液中是否还有Fe3+:_____ 。
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO 。该做法
。该做法_____ (填“合理”或“不合理”),理由是_____ 。
②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有_____ (填字母)。
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)_____ 。
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是_____ (用离子方程式表示)。
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是_____ 。
(1)某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
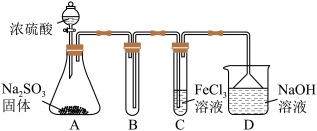
a.请设计实验方案检验溶液中是否还有Fe3+:
b.该小组同学向C试管反应后的溶液中先加入稀硝酸,后加入BaCl2溶液,发现出现白色沉淀,即可证明反应生成了SO
 。该做法
。该做法②为了验证SO2具有还原性,实验中可以代替FeCl3溶液的试剂有
A.浓硫酸 B.酸性KMnO4溶液 C.碘水 D.NaCl溶液
(2)某同学利用如图所示的装置研究SO2的性质:(已知熔点:SO2:-76.1℃,SO3:16.8℃,沸点:SO2:-10℃,SO3:45℃)
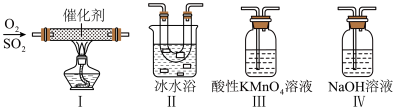
②乙同学按Ⅰ、Ⅱ、III顺序连接装置,发现装置III溶液褪色,出现该现象的原因是
③乙同学按Ⅰ、Ⅱ、Ⅳ顺序连接装置,若装置Ⅳ中有50mL2.5mol·L-1NaOH溶液,反应后增重4.8g,则装置Ⅳ中发生反应的化学方程式是
您最近半年使用:0次
2024-04-03更新
|
255次组卷
|
2卷引用:重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
名校
解题方法
7 . 下列离子方程式正确的是
A.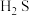 通入 通入  溶液: 溶液: |
B. 投入 投入  溶液: 溶液: |
C. 溶液中加入过量氨水: 溶液中加入过量氨水: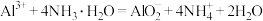 |
D.向  溶液中加入过量的 溶液中加入过量的  溶液: 溶液: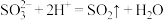 |
您最近半年使用:0次
名校
解题方法
8 . 下列方程式与所给事实不相符的是
A.硫酸铜溶液中加少量氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2 |
B.氢气燃烧热为285.8kJ/mol:H2(g)+ O2(g)=H2O(l) ΔH=−285.8kJ/mol O2(g)=H2O(l) ΔH=−285.8kJ/mol |
| C.用KSCN溶液检验Fe3+:Fe3++3SCN−=Fe(SCN)3↓ |
| D.加热CuCl2溶液,溶液变成黄绿色:[Cu(H2O)4]2++4Cl−⇌[CuCl4]2−+4H2O ΔH>0 |
您最近半年使用:0次
9 . 实验室用如下装置制取氯气,并进行氯气性质实验。回答下列问题:

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有 。加热时B中的化学方程式为
。加热时B中的化学方程式为___________ 。
(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为___________ (用化学式表示)。
(3)D中盛放的试剂为___________ 。
(4)对比E和F中现象的差异可得出的结论是___________ 。
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入___________ 溶液,溶液未出现红色,证明猜测1和猜测3不正确;
②再加入___________ (填试剂和现象)证明猜测2正确。
由此得出离子的还原性Fe2+___________ I-(填“大于”,“等于”,“小于”)。
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是___________ (填化学式)。

已知:E中放置干燥红色布条,F中放置湿润红色布条。
(1)A中盛有浓盐酸,B中盛有
 。加热时B中的化学方程式为
。加热时B中的化学方程式为(2)在实验室通过KMnO4与浓盐酸常温下反应也可制取氯气,据此推断KMnO4、Cl2、MnO2三种物质的氧化性由强到弱的顺序为
(3)D中盛放的试剂为
(4)对比E和F中现象的差异可得出的结论是
(5)实验后观察到G中溶液呈棕黄色,同学们猜测氧化产物可能有以下三种情况:
猜测1:只有Fe3+;
猜测2:只有I2;
猜测3:既有Fe3+又有I2。
于是取上述实验后G中的溶液进行如下实验:
①加入
②再加入
由此得出离子的还原性Fe2+
(6)H装置可用于模拟工业制造漂白粉的原理,实验后制得产品的有效成分是
您最近半年使用:0次
10 . 电子工业中常用FeCl3溶液做“腐蚀液”,腐蚀覆铜板制作印刷电路板。为使“腐蚀液”能得到循环利用并回收铜的流程图如下:
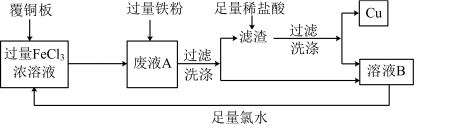
(1)写出FeCl3溶液与铜反应的离子方程式___________ 。
(2)滤渣的成分为___________ (填化学式)。
(3)加足量氯水后反应的离子方程式为___________ 。
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是___________ 。
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
①判断等物质的量的四种氧化剂分别与足量的酸性FeSO4溶液反应,得到Fe3+最多的是___________ (填化学式)。
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式___________ 。
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为___________ mol/L。

(1)写出FeCl3溶液与铜反应的离子方程式
(2)滤渣的成分为
(3)加足量氯水后反应的离子方程式为
(4)将少量溶液B滴入氢氧化钠溶液中,产生的现象是
(5)能在酸性环境下将Fe2+氧化为Fe3+的氧化剂有KMnO4、KClO3、H2O2、Cl2等。已知下列四种氧化剂氧化Fe2+后对应的还原产物如下:
| 氧化剂 | KMnO4 | KClO3 | H2O2 | Cl2 |
| 还原产物 | Mn2+ | Cl- | H2O | Cl- |
②写出KClO3溶液与酸性FeSO4溶液反应的离子方程式
(6)取废液A加入12.6 g铁粉,充分反应后过滤、洗涤、干燥得滤渣 11.0 g,滤渣与足量盐酸反应后过滤、洗涤、干燥得到9.6 g Cu。合并两次的滤液和洗涤液得溶液B 500 mL,则溶液B中含FeCl2的物质的量浓度为
您最近半年使用:0次



