名校
解题方法
1 . 化学与生活有着密切联系,下列说法错误的是
| A.五彩缤纷的烟花利用焰色试验的原理 |
| B.碳酸氢钠药片可用于治疗胃酸过多 |
| C.维生素C可将Fe3+转变为Fe2+,维生素C表现还原性 |
| D.为防止食品被氧化,常在包装袋中放入生石灰 |
您最近一年使用:0次
2 . 由下列实验操作及现象不能够得出相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将石墨电极放入NaCl溶液中,连接小灯泡,接通电源 | 小灯泡变亮 | NaCl是电解质 |
| B | 向澄清的苯酚钠溶液中通入CO2气体 | 溶液变浑浊 | 苯酚的酸性比碳酸弱 |
| C | 把水滴入盛有少量Na2O2的试管中,立即把带火星木条放在试管口 | 木条复燃 | 反应生成了O2 |
| D | 向可能含有Fe2+的FeCl3溶液中加入酸性KMnO4溶液 | 酸性 KMnO4溶液褪色 | FeCl3溶液中混有Fe2+杂质离子 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
3 . 某兴趣小组,用如图所示实验方案探究 与
与 的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
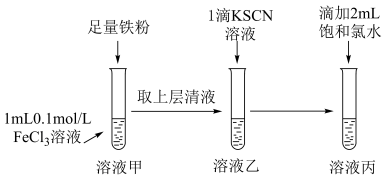
回答下列问题:
(1)试管1中发生反应的离子方程式为___________ 。
(2)编号①试管3中发生反应的离子方程式为___________ 和 。
。
(3)进一步探究编号②试管3中溶液褪色的原因,同学甲提出如下假设并设计了实验。
假设1:溶液褪色的原因是KSCN被转化。
假设2:溶液褪色的原因是___________ 。
同学乙查阅资料发现 可以被氧化成
可以被氧化成 ,请设计实验证明:
,请设计实验证明:
(4)编号③中未观察到溶液变红,可能的原因是___________ 。
 与
与 的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
的相互转化,在控制其它试剂用量相同的条件下,改变KSCN溶液的用量,出现了异常现象。实验结果如下表所示。
| 实验编号 |  /( /( ) ) | 试管1 | 试管2 | 试管3 |
| ① | 1 | 溶液由棕黄色变为浅绿色 | 无明显现象 | 溶液变为红色 |
| ② | 0.1 | 溶液变为红色,而后红色褪去 | ||
| ③ | 0.01 | 溶液变为棕黄色,未见红色 |
(1)试管1中发生反应的离子方程式为
(2)编号①试管3中发生反应的离子方程式为
 。
。(3)进一步探究编号②试管3中溶液褪色的原因,同学甲提出如下假设并设计了实验。
假设1:溶液褪色的原因是KSCN被转化。
假设2:溶液褪色的原因是
| 实验操作 | 实验现象 | 实验结论 |
| 取两份褪色后的溶液1mL于试管A、B中, | ||
| 往试管A中滴加 | 溶液恢复红色 | 假设1成立 |
| 往试管B中滴加 | 溶液未恢复红色 | 假设2不成立 |
 可以被氧化成
可以被氧化成 ,请设计实验证明:
,请设计实验证明:(4)编号③中未观察到溶液变红,可能的原因是
您最近一年使用:0次
2023-12-08更新
|
193次组卷
|
2卷引用:重庆市长寿区八校联考2023-2024学年高一上学期1月期末化学试题
4 . 高铁酸钾(K2FeO4)是一种新型绿色消毒剂,常用ClO-和Fe3+在KOH溶液中制得,同时生成KCl,下列说法正确的是
| A.随着反应的进行,溶液碱性会增强 |
| B.该反应中,氧化产物和还原产物个数比为3:2 |
| C.检验反应后溶液中的C1-,可加入AgNO3溶液,若产生白色沉淀则有Cl- |
| D.K2FeO4对饮用水杀菌消毒时,自身被还原为Fe(OH)3胶体,可吸附水中悬浮物 |
您最近一年使用:0次
2023-12-04更新
|
233次组卷
|
3卷引用:重庆实验外国语学校2023-2024学年高一上学期11月半期检测化学试题
重庆实验外国语学校2023-2024学年高一上学期11月半期检测化学试题(已下线)寒假作业07 铁及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)江西省上饶市婺源天佑中学2023-2024学年高一上学期12月考试化学试题
5 . 室温下,下列实验探究方案能达到实验目的的是
| 选项 | 探究方案 | 实验目的 |
| A | 将铁锈溶于足量浓盐酸,再向溶液中滴入几滴 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 检验铁锈中是否含有二价铁 |
| B | 将 溶液与 溶液与 溶液混合,观察现象 溶液混合,观察现象 | 验证结合质子能力: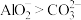 |
| C | 向 溶液中滴入硫酸酸化的 溶液中滴入硫酸酸化的 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 | 验证氧化性: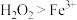 |
| D | 用pH计分别测定等体积的 溶液和 溶液和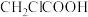 溶液的pH 溶液的pH | 探究键的极性对羟酸酸性的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-27更新
|
296次组卷
|
2卷引用:重庆市第八中学2024届高三上学期高考适应性月考卷(三)化学试题
解题方法
6 . 为了保护环境、利用锰资源,可通过如下流程用废旧电池中黑锰粉(含有 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
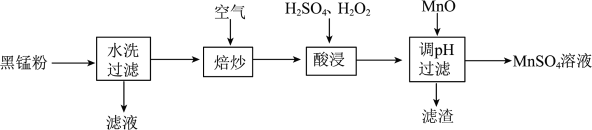
请回答下列问题:
(1)元素Mn在周期表中的位置是_______ , 中含有的化学键类型是
中含有的化学键类型是_______ 。
(2)“焙炒”时 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是_______ ;写出 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式_______ 。
(3)加快“酸浸”速率的措施是_______ (写两条即可);“酸浸”时除了固体溶解、溶液颜色变化外,还可能有的现象是_______ ;“酸浸”中加 的目的是
的目的是_______ 。
(4)“滤渣”的主要成分是_______ 。
(5)请设计实验方案检验所得 溶液中无
溶液中无 :
:_______ (写出操作、现象和结论)。
 、MnOOH、
、MnOOH、 和少量
和少量 、
、 及炭黑等)制备
及炭黑等)制备 。
。
请回答下列问题:
(1)元素Mn在周期表中的位置是
 中含有的化学键类型是
中含有的化学键类型是(2)“焙炒”时
 除氧化MnOOH外,还有一个作用是
除氧化MnOOH外,还有一个作用是 与MnOOH反应的化学方程式
与MnOOH反应的化学方程式(3)加快“酸浸”速率的措施是
 的目的是
的目的是(4)“滤渣”的主要成分是
(5)请设计实验方案检验所得
 溶液中无
溶液中无 :
:
您最近一年使用:0次
解题方法
7 . I.由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4·7H2O),然后制取透明氧化铁颜料的流程如下:
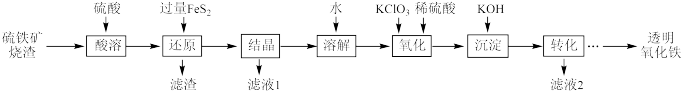
已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为___________ 。
(2)“滤渣”中的主要成分是___________ 。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)流程中“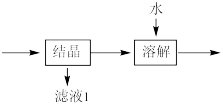 ”环节的目的是
”环节的目的是___________ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以___________ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:
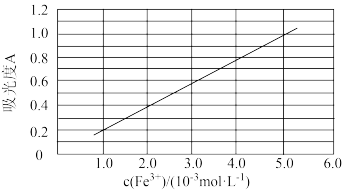
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为___________ %(保留小数点后一位)。
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:
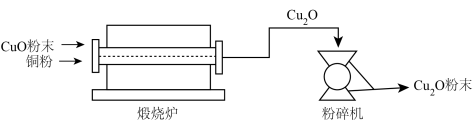
(7)粉碎机中,发生的变化属于___________ (填“物理变化”或“化学变化”)。
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为___________ 。

已知:①透明氧化铁又称纳米氧化铁,粒子直径微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
②Fe3+能将FeS2中的硫元素氧化为+6价。
回答下列问题:
(1)FeS2的电子式为
(2)“滤渣”中的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)流程中“
 ”环节的目的是
”环节的目的是(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示:

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL。测得溶液吸光度A=0.8,则透明氧化铁中氧化铁红(Fe2O3)的质量分数为
Ⅱ.氧化亚铜(Cu2O)用途广泛,干法生产Cu2O粉末的主要工艺流程如下:

(7)粉碎机中,发生的变化属于
(8)800~900℃时,煅烧炉中发生化合反应,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
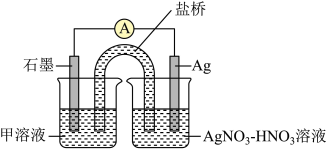
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
609次组卷
|
7卷引用:重庆市百师联盟2024届高三一轮复习联考(二)
名校
解题方法
9 . 某溶液中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1 mol/L。
某同学欲探究溶液的组成,进行了如下实验:
①用仪器a蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入适量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仪器a的名称是___________ 。
(2)③中加入适量盐酸生成无色气体的离子方程式是___________ 。
实验室制备红棕色气体时采用的收集方式为___________ 。
(3)无色气体与O2按照一定比例通入水中可被完全吸收,请写出该反应的化学方程式___________ 。
(4)该同学最终确定原溶液中所含阴离子是___________ ,阳离子是___________ (写离子符号)。
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为___________ g。
| 阳离子 | K+、Mg2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、 、 、 、 、 、 、 |
①用仪器a蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入适量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)仪器a的名称是
(2)③中加入适量盐酸生成无色气体的离子方程式是
实验室制备红棕色气体时采用的收集方式为
(3)无色气体与O2按照一定比例通入水中可被完全吸收,请写出该反应的化学方程式
(4)该同学最终确定原溶液中所含阴离子是
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为
您最近一年使用:0次
名校
解题方法
10 . 下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中: 、 、 、 、 、 、 |
B.溶液中的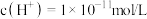 的溶液: 的溶液: 、 、 、 、 、 、 |
C.滴加 溶液后显血红色的溶液中: 溶液后显血红色的溶液中: 、 、 、 、 、 、 |
D. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2023-10-15更新
|
604次组卷
|
3卷引用:重庆市育才中学2023-2024学年高二上学期10月月考化学试题



