名校
解题方法
1 . 下列实验方案设计、现象与结论均正确的是
选项 | 目的 | 方案设计 | 现象与结论 |
A | 比较B元素和C元素的非金属性强弱 | 向 硼酸溶液中加入 硼酸溶液中加入 碳酸氢钠溶液 碳酸氢钠溶液 | 若无明显变化,说明非金属性: |
B | 检验 固体是否变质 固体是否变质 | 取少量固体溶于水,滴加少量 ,再滴入KSCN溶液,振荡,观察溶液颜色变化 ,再滴入KSCN溶液,振荡,观察溶液颜色变化 | 若溶液变红,说明样品已变质 |
C | 证明蔗糖是否水解 | 向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的 悬浊液 悬浊液 | 若无砖红色沉淀,说明蔗糖未发生水解 |
D | 探究不同价态硫元素之间的转化 | 向 和 和 混合溶液中,加入大量浓硫酸 混合溶液中,加入大量浓硫酸 | 若溶液中出现淡黄色沉淀,则说明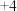 价和 价和 价硫可归中 价硫可归中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 下列离子方程式书写正确的是
A.FeCl3溶液腐蚀铜片制电路板: |
B.少量CO2通入NaClO溶液中: |
C.SO2通入 溶液中: 溶液中: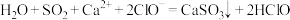 |
D.海带灰浸出液中滴加几滴硫酸酸化的过氧化氢溶液: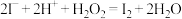 |
您最近一年使用:0次
名校
3 . 下列各组离子在水溶液中一定能大量共存的是
A. 、 、 、 、 、 、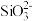 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
2023-05-15更新
|
209次组卷
|
2卷引用: 重庆市第一中学校2022-2023学年高一下学期期中考试化学试题
名校
4 . 已知A、B、C、D为原子序数依次增大的短周期主族元素,A与D同主族,B与C同周期,且C与D的原子序数之和为20。E为地壳中含量最高的过渡元素。甲、乙分别为元素E、A的单质,丙、丁为A、E分别与B形成的二元化合物,它们之间的转化关系如图(反应条件已略去)。下列说法错误的是
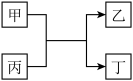

| A.A、B形成的一种化合物具有漂白性 |
| B.D的离子半径小于C的离子半径 |
| C.C的单质能与丙反应置换出B的单质 |
| D.将反应后的固体混合物溶于稀盐酸中,再滴加KSCN溶液,溶液一定呈红色 |
您最近一年使用:0次
2023-05-15更新
|
890次组卷
|
4卷引用: 重庆市第一中学校2022-2023学年高一下学期期中考试化学试题
名校
5 . 下列物质的性质与用途不具有对应关系是
| A.CO具有还原性,可用于冶炼铁 | B.KNO3具有氧化性,可用于制黑火药 |
| C.Na2CO3溶液显碱性,可用于除油污 | D.FeCl3溶液显酸性,可用于刻蚀电路板上的铜 |
您最近一年使用:0次
6 . 铁是人体必需的微量元素。某研究小组通过设计实验以检验菠菜中是否含有铁元素,其实验流程如图所示,下列说法错误的是

已知:固体1的主要成分是 。
。

已知:固体1的主要成分是
 。
。| A.上述实验流程中操作①②都是过滤 |
| B.向溶液2中加入HNO3后再滴入KSCN溶液无现象,说明菠菜中的铁元素不是以水溶性物质存在的 |
| C.向溶液3中滴加KSCN溶液后变红,说明菠菜中存在三价的铁元素 |
D.反应③的离子方程式为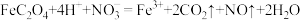 |
您最近一年使用:0次
2023-04-11更新
|
985次组卷
|
6卷引用:重庆市第八中学校2023-2024学年高三上学期入学测试化学试题
重庆市第八中学校2023-2024学年高三上学期入学测试化学试题(已下线)押题卷化学(五)(已下线)题型35 微型成套装置实验流程山东省淄博市张店区2022-2023学年高一下学期5月期中考试化学试题(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)陕西省咸阳市实验中学2023-2024学年高三下学期适应训练(一)化学试题
名校
7 . 铁红( )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
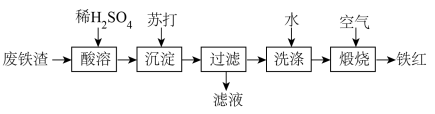
请回答下列问题:
(1)苏打的化学式为_______ ;沉淀的化学式为_______ ;“滤液”中主要溶质的化学式为_______
(2)要检测“酸溶”后,溶液中是否含有 所用的试剂是
所用的试剂是_______ ;若溶液中检测不到 的原因是
的原因是_______ ;
(3)“酸溶”时, 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为_______
(4)实验室过滤所需的玻璃仪器有_______
(5)煅烧的化学方程式为_______
 )可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含
)可用于油漆、油墨、橡胶等工业中,可作为玻璃、宝石、金属的抛光剂等。某课外活动小组用废铁渣(含 和少量
和少量 )制取铁红,所设计的流程如下:
)制取铁红,所设计的流程如下:
请回答下列问题:
(1)苏打的化学式为
(2)要检测“酸溶”后,溶液中是否含有
 所用的试剂是
所用的试剂是 的原因是
的原因是(3)“酸溶”时,
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为(4)实验室过滤所需的玻璃仪器有
(5)煅烧的化学方程式为
您最近一年使用:0次
2023-02-11更新
|
374次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题
名校
解题方法
8 . 某课外活动小组探究某食品包装袋中还原性铁粉是否变质,分别取少量样品溶于盐酸,然后进行下列实验。下列说法正确的是
A.若滴加 溶液,无红褐色沉淀产生,说明铁粉未变质 溶液,无红褐色沉淀产生,说明铁粉未变质 |
B.若滴加 溶液,溶液变红,说明铁粉变质 溶液,溶液变红,说明铁粉变质 |
C.若先滴加氯水,再滴加 溶液,溶液变红,说明铁粉全部变质 溶液,溶液变红,说明铁粉全部变质 |
D.若滴加 溶液,无白色沉淀产生,说明铁粉全部变质 溶液,无白色沉淀产生,说明铁粉全部变质 |
您最近一年使用:0次
2023-02-11更新
|
341次组卷
|
3卷引用:重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题
重庆市南开中学校2022-2023学年高一上学期期末联合检测化学试题(已下线)第14讲 铁的氢氧化物和铁盐、亚铁盐-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)云南省普洱市西盟佤族自治县第一中学2022-2023学年高一下学期4月月考化学试题
名校
解题方法
9 . 硫酸亚铁铵晶体,又称摩尔盐,是分析化学中重要的基准物质,其化学式可表示为
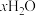 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
已知:①
②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是


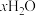 。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。
。为测定其结晶水含量并进一步探究其在惰性气体氛围中的热分解反应过程,现取一定质量的摩尔盐晶体做热重分析,绘制出如下的热重曲线。已知:①

②摩尔盐在580℃下完全分解,得到红棕色固体
则下列说法正确的是

A.用 溶液检验摩尔盐中的金属阳离子 溶液检验摩尔盐中的金属阳离子 |
B. |
| C.用湿润的红色石蕊试纸检验205~420℃间分解产生的气体,试纸变蓝 |
D.0~580℃发生的化学方程式为: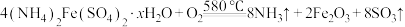 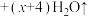 |
您最近一年使用:0次
2023-02-09更新
|
1155次组卷
|
3卷引用:重庆市南开中学校2023届高三下学期第六次质量检测化学试题
重庆市南开中学校2023届高三下学期第六次质量检测化学试题(已下线)专题卷08 无机物的性质与用途-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)黑龙江省大庆铁人中学2023-2024学年高一下学期开学考试化学试题
名校
10 . 某研究性学习小组拟配制FeI2溶液并探究相关性质。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是_____ 。
②用托盘天平称量,需要称取FeI2_____ g。
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度_____ 。(填“偏大”或“偏小”)
④久置的FeI2溶液容易变质,检测其是否变质的试剂为_____ 。
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
①为______ (填“CCl4”或“苯”)。
②上层呈______ 色。
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为______ 。
Ⅰ.配制240mL0.2mol·L-1FeI2溶液
(1)配制FeI2溶液除烧杯、量筒、胶头滴管外,
①还需要的玻璃仪器是
②用托盘天平称量,需要称取FeI2
③定容时,若仰视容量瓶刻度线会使配制的FeI2溶液浓度
④久置的FeI2溶液容易变质,检测其是否变质的试剂为
Ⅱ.探究Fe2+与I-的还原性强弱
取10mL上述FeI2溶液,向其中滴加少量新制的氯水,振荡后发现溶液呈黄色。
同学们对产生黄色的原因提出假设:
假设1:只有I-被少量Cl2氧化成I2溶解在溶液中,碘水为黄色,还原性:I->Fe2+;
假设2:只有Fe2+被少量Cl2氧化成Fe3+,FeCl3溶液为黄色,还原性:Fe2+>I-。
(2)设计方案,验证假设
| 实验方案 | 预期现象 | 结论 |
| 向反应后的溶液中加入适量______,振荡,静置,分层,观察下层液体颜色,在上层溶液中加入KSCN溶液,观察上层颜色 | 下层呈紫红色 | 假设1正确 |
| ______ | 假设2正确 |
②上层呈
最终实验现象证实:假设1正确。
③若向20mL上述FeI2溶液通入112mL(标准状况)Cl2,反应的离子方程式为
您最近一年使用:0次



