1 . 下列有关物质的应用与性质相一致的是
| A.SO2可用作漂白剂,原因是具有还原性 |
| B.FeCl3溶液可用于制印刷电路板,原因是能氧化Cu |
| C.Cl2可制漂白粉,原因是能与NaOH反应 |
| D.Al(OH)3可用于治疗胃酸过多,原因是碱性强 |
您最近一年使用:0次
13-14高一下·重庆·单元测试
名校
2 . (原创)下列现象或事实可用同一原理解释的是
| A.氯水和二氧化硫使品红溶液褪色 |
| B.亚硫酸钠和水玻璃长期暴露在空气中变质 |
| C.稀硝酸和三氯化铁溶液使KI-淀粉试纸变蓝 |
| D.浓盐酸和浓硫酸长期暴露在空气中浓度变小 |
您最近一年使用:0次
2016-12-09更新
|
622次组卷
|
3卷引用:2013-2014重庆市重庆一中高一下学期定时练习化学试卷
(已下线)2013-2014重庆市重庆一中高一下学期定时练习化学试卷重庆市第一中学2019-2020学年高一下学期期末考试化学试题2020届高三化学无机化学二轮专题复习——铁盐及亚铁盐的性质【精编24题】
解题方法
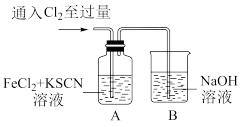
3 . 甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)B中反应的离子方程式是____ 。
(2)A中溶液变红的原因是____ 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_____ 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为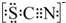
①甲同学认为SCN—中碳元素没有被氧化,理由是_________ 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是__________ 。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____ 。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______ mol。
| 操作 | 现象 |
 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为
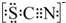
①甲同学认为SCN—中碳元素没有被氧化,理由是
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是
您最近一年使用:0次
2016-12-09更新
|
1374次组卷
|
6卷引用:2014-2015学年重庆市第一中学高二下学期期末化学试卷
2014-2015学年重庆市第一中学高二下学期期末化学试卷(已下线)2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(已下线)2013-2014北京市东城区高三二模理综化学试卷2015届北京市清华大学附属中学高三4月综合测(四)化学试卷2017届江西省九江第一中学高三7月暑期阶段性测试化学试题湖南省茶陵县第三中学2020届高三第三次月考化学试题
名校
4 . 某一化工厂以废铁屑为原料制备FeCl3溶液,用作印刷电路铜板腐蚀剂,并对溶液B进行电解处理的实验流程如图:
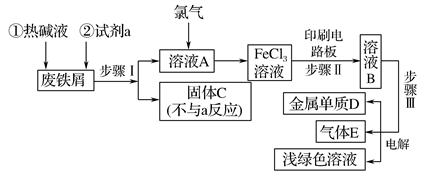
(1)试剂a应选用________ (填写名称);
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、________ (填写仪器名称);
(3)写出步骤Ⅱ中主要反应的化学方程式____________________ ;
(4)实验室制取气体E的离子方程式是________________________ ,欲对气体E进行干燥和吸收,需选用下列装置中的________ (填写序号);
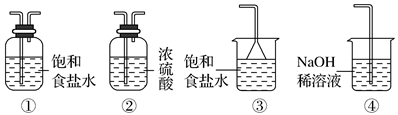
(5)如何用化学方法检验气体E?______________________________ 。

(1)试剂a应选用
(2)步骤Ⅰ用到的主要玻璃仪器有漏斗、
(3)写出步骤Ⅱ中主要反应的化学方程式
(4)实验室制取气体E的离子方程式是

(5)如何用化学方法检验气体E?
您最近一年使用:0次
2016-12-09更新
|
890次组卷
|
5卷引用:重庆市南开中学2019届高三上学期第一次月考化学试题
重庆市南开中学2019届高三上学期第一次月考化学试题(已下线)2014年高考化学苏教版总复习 10-4 化学实验方案设计与评价练习卷2018版化学(苏教版)高考总复习题型冲关:无机化学工艺流程吉林省靖宇县一中2020届高三上学期9月月考化学试题福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题
名校
5 . 下列有关实验的叙述中正确的是( )
| A.向溴水和碘水中分别加入少量CCl4,振荡后静置,下层的颜色都比上层深 |
| B.用过量的NaOH溶液除去FeCl2溶液中的FeCl3 |
| C.用托盘天平准确称取0.400 0 g食盐,配成500 mL浓度为0.020 0 mol·L-1的食盐水 |
| D.某气体能使品红溶液褪色,则该气体一定是SO2 |
您最近一年使用:0次
6 . 某研究小组利用如图装置探究温度对CO还原Fe2O3的影响(固定装置略)
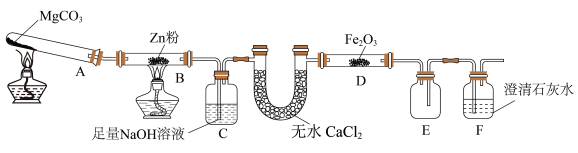
(1)MgCO3的分解产物为_______ 。
(2)装置C的作用是_______ ,处理尾气的方法为_______ 。
(3)将研究小组分为两组,按图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。(Fe2+遇K3[Fe(CN)6]溶液会生成蓝色沉淀)
①乙组得到的黑色粉末是_______ 。
②甲组步骤1中反应的离子方程式为_______ 。
③乙组步骤4中,溶液变红的原因为_______ ;溶液褪色可能的原因为_______ 。
④从实验安全考虑,题图装置还可采取的改进措施是_______ 。

(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。(Fe2+遇K3[Fe(CN)6]溶液会生成蓝色沉淀)
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变红的原因为
④从实验安全考虑,题图装置还可采取的改进措施是
您最近一年使用:0次
2016-12-09更新
|
1216次组卷
|
5卷引用:2013年全国普通高等学校招生统一考试理科综合能力测试化学(重庆卷)
2011·重庆·一模
7 . 为证明化学反应有一定的限度,进行如下探究活动:
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为_________________ ,探究活动Ⅱ的实验现象为______________
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
②写出实验操作“步骤—"中反应的离子方程式:_______________________________ 。
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液作指示剂,再用c mol/L KI标准溶液 滴定,达到滴定终点时的现象是_________________________ 。
②重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则FeCl3稀溶液物质的量浓度为________ mol/L。
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______ (填“偏高”或“偏低,,或“不变”)。
I.取5m1 0.1mol/L的KI溶液,滴加“滴FeCl3稀溶液(已知:2Fe3++2I-=I2+2Fe2+)
Ⅱ.继续加入2ml CCl4振荡
Ⅲ.取萃取后的上层清液,滴加KSCN溶液。
(1)探究活动I的实验现象为
(2)探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+
猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6](黄色)溶液检验Fe3+的灵敏度比用KSCN更高。
结合新信息。现设计以下实验方案验证猜想:
①请完成下表
| 实验操作 | 现象和结论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若 |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若乙醚层呈血红色,则 |
②写出实验操作“步骤—"中反应的离子方程式:
Ⅳ.为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作:
①移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液作指示剂,再用c mol/L KI标准溶液 滴定,达到滴定终点时的现象是
②重复滴定三次,平均耗用c mol/L KI标准溶液V mL,则FeCl3稀溶液物质的量浓度为
③若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
您最近一年使用:0次
真题
解题方法
8 . 金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。
(1) 元素在周期表中位置是
元素在周期表中位置是_______ ,其原子结构示意图_______ ;
(2) 与最活跃的非金属元素A形成化合物D,D的电子式为
与最活跃的非金属元素A形成化合物D,D的电子式为_______ ;
(3)配平用钙线氧脱磷的化学方程式:
___ P +___ FeO +____ CaO
____ Ca3(PO4)2+____ Fe;
(4)将钙线试样溶于稀盐酸,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测Mn+的方法是_______ (用离子方程式表达);
(5)取1.6g钙线试样,与水充分反应,生成224mLH2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3_______ g。
 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数) 。
。(1)
 元素在周期表中位置是
元素在周期表中位置是(2)
 与最活跃的非金属元素A形成化合物D,D的电子式为
与最活跃的非金属元素A形成化合物D,D的电子式为(3)配平用钙线氧脱磷的化学方程式:

(4)将钙线试样溶于稀盐酸,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则检测Mn+的方法是
(5)取1.6g钙线试样,与水充分反应,生成224mLH2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3
您最近一年使用:0次
2016-12-09更新
|
89次组卷
|
3卷引用:2010年普通高等学校招生全国统一考试理综化学部分(重庆卷)
9 . 有NaCl、KSCN、NaOH、AgNO3四种溶液,只用一种试剂就把它们鉴别开来,这种试剂是
| A.盐酸 | B.Na2CO3溶液 | C.氯水 | D.FeCl3溶液 |
您最近一年使用:0次
2016-11-02更新
|
826次组卷
|
11卷引用:重庆市缙云教育联盟2021-2022学年高一上学期期末考试化学试题
重庆市缙云教育联盟2021-2022学年高一上学期期末考试化学试题(已下线)2011-2012学年广东省兴中学高二下学期期中学业水平考试化学试卷(已下线)2013-2014学年山西省大同市第一中学高一上学期期末考试化学试卷2015-2016学年宁夏育才中学高一上期末考试化学试卷2016-2017学年江苏省如东中学高二上10月阶段测化学卷【全国百强校】宁夏育才中学2017-2018学年高一下学期会考模拟(期末)考试化学试题甘南藏族自治州合作第一中学2019-2020学年高一上学期期末考试化学试题福建省福建师范大学第二附属中学2019-2020学年高一上学期期末考试化学试题吉林省辽源市友好学校第七十届2020-2021学年高一上学期期末联考化学试题广东省中山市2020-2021学年高一上学期期末考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高一上学期12月月考化学试题
10 . 硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
| A.Na+、Fe3+、K+、ClO﹣都可在该物质的溶液中大量共存 |
| B.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 |
C.向0.1 mol·L-1该物质的溶液中逐滴滴加0.1 mol·L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如下图所示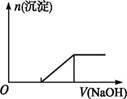 |
| D.向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42- 完全沉淀的离子方程式为:Fe2++2SO42﹣+2Ba2++2OH﹣=2BaSO4↓+Fe(OH)2↓ |
您最近一年使用:0次
2016-09-30更新
|
260次组卷
|
2卷引用:2017届重庆市育才中学高三上学期入学考试化学试卷



