1 . 下列实验“操作和现象”与“结论”对应关系正确的是
选项 | 操作和现象 | 结论 |
A. | 向某溶液中加入少量新制氯水后再加几滴 | 该溶液中一定含有 |
B. | 某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有 |
C. | 向某溶液加入稀硝酸和 | 该溶液中一定没有 |
D. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 按要求书写化学方程式或离子方程式。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为___________ 。
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为___________ 。
(3)浓硫酸和铜反应,相应的化学方程式为___________ 。
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为___________ 。
(5)SO2能使氯水褪色,相应的离子方程式为___________ 。
(1)除去氯化亚铁溶液中的氯化铁杂质,相应的离子方程式为
(2)工业上用FeCl3溶液腐蚀铜线路板,相应的离子方程式为
(3)浓硫酸和铜反应,相应的化学方程式为
(4)Fe(OH)2在空气中被氧化,相应的化学方程式为
(5)SO2能使氯水褪色,相应的离子方程式为
您最近一年使用:0次
3 . 三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O(M=491g/mol)是一种感光剂和高效的污水处理剂。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:
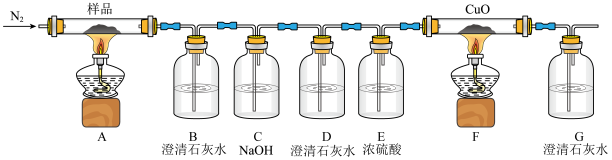
(1)C中NaOH溶液的作用为___________ ;D中澄清石灰水作用为___________ 。
(2)证明有CO产生的现象为___________ 。
(3)该装置还存在的缺陷是___________ 。
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:
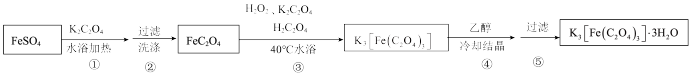
研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为___________ 。
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、 构成;
构成;
乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:___________ 。
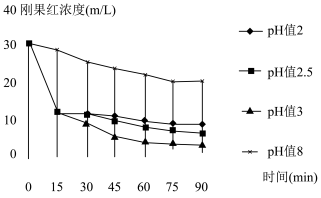
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=___________ 。
(7)关于制备流程,下列说法正确的是___________。
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O
①写出Fe2+与酸性KMnO4溶液反应的离子方程式:___________ 。
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为___________ 。
I.某研究小组同学查阅资料发现K3[Fe(C2O4)3]·3H2O加热后会分解产生CO和CO2,于是设计了如下实验进行验证。请回答:

(1)C中NaOH溶液的作用为
(2)证明有CO产生的现象为
(3)该装置还存在的缺陷是
II.制备K3[Fe(C2O4)3]·3H2O的途径如下,请回答下列问题:

研究小组通过查阅资料得知:
a.K3[Fe(C2O4)3]·3H2O对光敏感,易溶于水,难溶于乙醇;
b.很多草酸盐(例如CaC2O4、BaC2O4)难溶于水,但能溶解于稀硝酸。
(4)步骤③中,控制水浴温度不能超过40℃的原因为
(5)研究小组的同学对K3[Fe(C2O4)3]组成有两种看法,分别为:
甲同学:K3[Fe(C2O4)3]由K+、Fe3+、
 构成;
构成;乙同学:K3[Fe(C2O4)3]由K+、[Fe(C2O4)3]3-构成。
请设计实验,验证哪位同学的说法是正确的:
(6)K3[Fe(C2O4)3]联合H2O2体系可用于降解染料,一定浓度的该混合溶液,在不同pH条件下降解刚果红的效率如图所示,在实际应用过程中,应选择pH=

(7)关于制备流程,下列说法正确的是___________。
| A.步骤①为复分解反应,步骤③为氧化还原反应 |
| B.步骤②判断沉淀是否洗涤干净,可以取少量最后一次洗涤液,加入氯化钡溶液,观察是否有白色沉淀产生 |
| C.步骤④,加入乙醇目的在于降低K3[Fe(C2O4)3]的溶解度,使其结晶析出 |
| D.步骤④⑤可以在日光下进行 |
(8)制得的K3[Fe(C2O4)3]·3H2O含少量FeC2O4·2H2O,为测定其纯度,进行如下实验:
步骤I:称取5.000g三草酸合铁酸钾晶体,配制成1.000L溶液,固体完全溶解。
步骤II:取20.00mL溶液,与0.1000molL-酸性KMnO4溶液反应,消耗2.46mL。
步骤III:另取20.00mL溶液,加入过量铜粉,过滤,洗涤,将滤液和洗涤液合并。
步骤IV:将合并液与0.1000mol/L酸性KMnO4溶液反应,消耗2.86mL。
已知
 与
与 的反应为(未配平):
的反应为(未配平): +
+ +H+→CO2↑+Mn2++H2O
+H+→CO2↑+Mn2++H2O①写出Fe2+与酸性KMnO4溶液反应的离子方程式:
②研究小组制得的K3[Fe(C2O4)3]·3H2O纯度为
您最近一年使用:0次
4 . 下列关于物质或离子检验的叙述正确的是
| A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+ |
| B.气体通过无水CuSO4,粉末变蓝,证明原气体中含有水蒸气 |
| C.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解时,可确定有Cl-存在 |
| D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2 |
您最近一年使用:0次
名校
5 . 铁及其化合物在日常生产生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)所含铁元素只有还原性的物质是___________。
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,___________ 。
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有___________ (填化学性质)。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:___________
______Fe(OH)3+_______ClO-+_______=_______FeO +_______Cl-+_______
+_______Cl-+_______
(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是___________ ,操作I用到的玻璃仪器有烧杯、玻璃棒和___________ 。
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为___________ 。
③上述流程中操作Ⅲ包括:蒸发浓缩、___________ 、过滤、洗涤。
(1)所含铁元素只有还原性的物质是___________。
| A.Fe | B.FeCl2 | C.FeCl3 | D.Fe2O3 |
(2)当人体缺铁时,往往需要吃补铁保健品。人体能够吸收的是+2价的铁,但是+2价的铁很容易被氧化。
①如何检验某固体补铁剂中铁元素已被氧化?写出操作过程、现象及结论。
答:研细后用盐酸溶解,
②服用维生素C,可使食物中的三价铁离子转化为二价铁离子。由此可推知,维生素C具有
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂。湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、C1O-、OH-、FeO
 、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:
、Cl-、H2O。写出并配平湿法制高铁酸钾的离子反应方程式:______Fe(OH)3+_______ClO-+_______=_______FeO
 +_______Cl-+_______
+_______Cl-+_______(4)工业上用氯化铁腐蚀铜箔、制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁晶体,准备采用下列步骤:

回答下列问题:
①试剂a是
②滤液X、Z中都有同一种溶质,它们转化为溶液W的离子方程式为
③上述流程中操作Ⅲ包括:蒸发浓缩、
您最近一年使用:0次
名校
6 . I.某化学兴趣小组用如图装置制备 并探究其性质。
并探究其性质。
i. 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii. 有较强的还原性
有较强的还原性
(1)装置A中a的作用是_____________________________ ;
(2)上述装置中存在一处缺陷,会干扰 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是_________________ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________________ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因____________________________ 、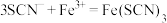 。
。
②某同学对褪色原因提出假设:
假设1: 被
被 氧化为更高价态;
氧化为更高价态;
假设2: 被
被 氧化为更高价态。
氧化为更高价态。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入____________________________ ,若出现____________________________ 现象,则说明假设2成立。
II.有两组化学兴趣小组同学对、 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:
(5)甲组同学探究溶液 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为______________________________ 。 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验: 与
与 反应的离子方程式为
反应的离子方程式为______________________________ 。
为了探究白色沉淀产生的原因,同学们查阅资料得知:
i. 是难溶于水的白色固体;
是难溶于水的白色固体;
ii. 的化学性质与
的化学性质与 相似;
相似;
iii.
填写实验方案:
②步骤2的空格中填写的数据为___________________ 。
③ 与
与 反应的离子方程式为
反应的离子方程式为____________________________________ 。
 并探究其性质。
并探究其性质。
i.
 酸性条件下与
酸性条件下与 迅速反应生成S和
迅速反应生成S和
ii.
 有较强的还原性
有较强的还原性(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰
 和
和 性质的探究,改进的方法是
性质的探究,改进的方法是(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出该反应的离子方程式
,写出该反应的离子方程式(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
①用离子方程式表示C中溶液变红色的原因
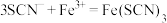 。
。②某同学对褪色原因提出假设:
假设1:
 被
被 氧化为更高价态;
氧化为更高价态;假设2:
 被
被 氧化为更高价态。
氧化为更高价态。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,加入
II.有两组化学兴趣小组同学对、
 、
、 、
、 的性质及其之间的反应进行探究。回答下列问题:
的性质及其之间的反应进行探究。回答下列问题:(5)甲组同学探究溶液
 对
对 稳定性的影响,得到如图所示结果,则增强
稳定性的影响,得到如图所示结果,则增强 稳定性的措施为
稳定性的措施为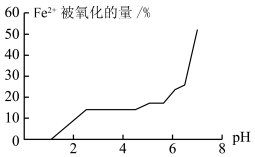
 与
与 的反应,进行如图所示实验:
的反应,进行如图所示实验:
 与
与 反应的离子方程式为
反应的离子方程式为为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.
 是难溶于水的白色固体;
是难溶于水的白色固体;ii.
 的化学性质与
的化学性质与 相似;
相似;iii.

填写实验方案:
实验方案 | 实验现象 |
步骤1:取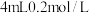 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴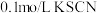 溶液 溶液 | 无明显现象 |
步骤2:取 的 的 溶液,向其中滴加3滴 溶液,向其中滴加3滴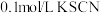 溶液 溶液 | 产生白色沉淀 |
③
 与
与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
2024-01-13更新
|
157次组卷
|
4卷引用:福建省厦门第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
7 . 室温下,下列实验探究方案能达到探究目的的是
| 选项 | 探究方案 | 探究目的 |
| A | 向苯酚钠溶液中通入CO2,观察现象 | 探究碳酸和苯酚的酸性强弱 |
| B | 用pH计分别测定等体积的CH3COOH溶液和ClCH2COOH溶液的pH | 探究键的极性对羧酸酸性的影响 |
| C | 向圆底烧瓶中加入2.0gNaOH、15mL无水乙醇、碎瓷片和5mL1-溴丁烷,微热,将产生的气体通入酸性KMnO4溶液,观察现象 | 探究1-溴丁烷的消去产物 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,观察溶液颜色变化 | 探究H2O2与Fe3+氧化性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
8 . 电子工业常用过量的 FeCl3 溶液腐蚀绝缘板上的铜箔来制造电路板。利用腐蚀废液 可制铁红,过程如图:
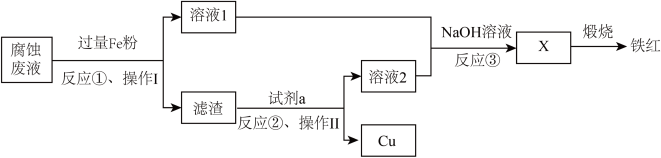
(1)反应①的离子方程式有___________ 。
(2)试剂 a 可以是___________。
(3)操作Ⅱ为___________ 。
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是___________ 。
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为___________ , 则 Fe3O4 的物质的量为___________ mol。

(1)反应①的离子方程式有
(2)试剂 a 可以是___________。
| A.HCl | B.H2SO4 | C.KOH 溶液 | D.Na2CO3 溶液 |
(3)操作Ⅱ为
(4)检验溶液 1 中是否含有 Fe3+ 的试剂是
(5)经检验铁红中有 Fe3O4,取 100 g 产品,用足量稀硫酸溶解,逐滴加入 0.100 mol·L-1高锰酸钾溶液 40.0 mL 至恰好反应完全,反应的离子方程式为
您最近一年使用:0次
名校
解题方法
9 . 某实验小组在实验室进行 Fe(Ⅱ)与 Fe(Ⅲ)相互转化的实验:
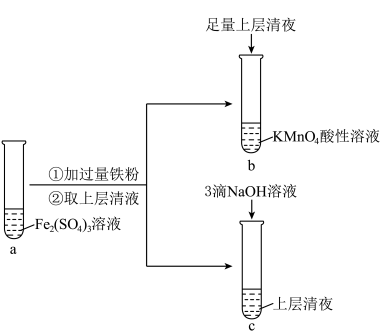
(1)向试管a 中加入过量铁粉的离子方程式是___________ 。
(2)检验试管a 的溶液中含有Fe3+的实验方案为:在试管中加入少量a 中溶液,_________________ (填操作和现象),说明其中含有Fe3+。
(3)试管b 中的实验现象是___________ 。
(4)试管c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________ 。

(1)向试管a 中加入过量铁粉的离子方程式是
(2)检验试管a 的溶液中含有Fe3+的实验方案为:在试管中加入少量a 中溶液,
(3)试管b 中的实验现象是
(4)试管c 中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 下列实验与结论相匹配的是
| 选项 | 实验 | 结论 |
| A | 向某溶液中滴加盐酸酸化的氯化钡溶液,产生白色沉淀 | 该溶液中一定有 |
| B | 将饱和 FeCl3 溶液滴入 NaOH 溶液中 | 可制得 Fe(OH)3 胶体 |
| C | 向某溶液中滴加稀盐酸产生无色无味气体 | 溶液中一定有 |
| D | 向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加 KSCN 溶液 2~3 滴,溶液呈红色 | 红砖中含有氧化铁 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 溶液,溶液变为红色
溶液,溶液变为红色
 溶液,无明显现象,再加入
溶液,无明显现象,再加入 溶液,产生白色沉淀
溶液,产生白色沉淀


