名校
1 . 下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比)化学反应的产物并不改变的是
| A.Li和O2 | B.NaOH和CO2 | C.Fe和稀硝酸 | D.木炭(C)和CuO |
您最近半年使用:0次
2024-03-12更新
|
227次组卷
|
4卷引用:湖北省云学名校联盟2023-2024学年高一下学期3月联考化学试卷
2 . 有一质量为11.76g的Fe、CuO、Fe2O3混合固体,完全溶解在200mL2mol/L稀盐酸中,然后向溶液中加铁粉,剩余固体质量与加入铁粉质量的关系如图所示。下列说法正确的是


| A.0~m1阶段发生反应为Fe+2H+=Fe2++H2↑ |
B.混合固体中 的质量为0.01mol 的质量为0.01mol |
| C.5.04~m2阶段发生反应为2Fe3++Fe=3Fe2+ |
| D.图中m2=5.6 |
您最近半年使用:0次
3 . 用如图所示的装置分别进行如下实验,各组物质反应后,小灯泡的亮度明显减弱的是
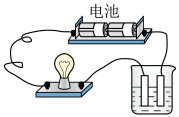

| A.向氢氧化铁胶体中通入氯化氢至不再有丁达尔效应 |
B.向 溶液中加入少量铁粉 溶液中加入少量铁粉 |
C.向 溶液中加入少量 溶液中加入少量 粉末 粉末 |
| D.向NaOH溶液中通入少量氯气 |
您最近半年使用:0次
4 . 钛白粉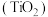 作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含
作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含 及少量的
及少量的 )为原料生产钛白粉的工艺流程如图:
)为原料生产钛白粉的工艺流程如图:
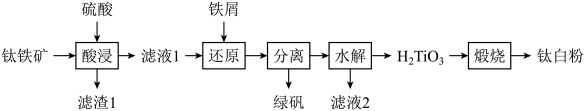
回答下列问题:
(1) 中铁的化合价是
中铁的化合价是___________ 。
(2)“酸浸”是用硫酸在温度为 下溶煮钛铁矿,“滤液1”的主要成分中含有
下溶煮钛铁矿,“滤液1”的主要成分中含有 ,则“酸浸”中主要发生的反应方程式为
,则“酸浸”中主要发生的反应方程式为___________ 。
(3)“滤渣1”的主要成分有___________ 。
(4)“还原”中加入过量铁屑的目的是___________ 。硫酸亚铁晶体的溶解度如表所示,其中绿矾 容易被氧化,则“操作Ⅱ”包括真空加热浓缩、
容易被氧化,则“操作Ⅱ”包括真空加热浓缩、___________ 、___________ 、洗涤、干燥。
(5)工业上将钛白粉与焦炭、氯气共热生成 和一种可燃气体,反应的化学方程式为
和一种可燃气体,反应的化学方程式为___________ ,最后在氯气氛围和加热的条件下用金属镁还原 制取性能优越的金属钛。
制取性能优越的金属钛。
(6)取 经煅烧至恒重后固体质量为
经煅烧至恒重后固体质量为 ,则
,则
___________ 。
 作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含
作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含 及少量的
及少量的 )为原料生产钛白粉的工艺流程如图:
)为原料生产钛白粉的工艺流程如图:
回答下列问题:
(1)
 中铁的化合价是
中铁的化合价是(2)“酸浸”是用硫酸在温度为
 下溶煮钛铁矿,“滤液1”的主要成分中含有
下溶煮钛铁矿,“滤液1”的主要成分中含有 ,则“酸浸”中主要发生的反应方程式为
,则“酸浸”中主要发生的反应方程式为(3)“滤渣1”的主要成分有
(4)“还原”中加入过量铁屑的目的是
 容易被氧化,则“操作Ⅱ”包括真空加热浓缩、
容易被氧化,则“操作Ⅱ”包括真空加热浓缩、| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 |
| 析出晶体 |  | 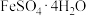 |  | |||||||
 和一种可燃气体,反应的化学方程式为
和一种可燃气体,反应的化学方程式为 制取性能优越的金属钛。
制取性能优越的金属钛。(6)取
 经煅烧至恒重后固体质量为
经煅烧至恒重后固体质量为 ,则
,则
您最近半年使用:0次
解题方法
5 . 硫酸是一种具有高腐蚀性的强矿物酸,浓硫酸是指质量分数大于等于70%的硫酸溶液,又称“坏水”,下列关于浓硫酸的性质叙述中,正确的是
| A.炽热的碳与浓硫酸反应,浓硫酸表现强氧化性和酸性 |
| B.浓硫酸使蔗糖炭化,浓硫酸表现吸水性 |
| C.胆矾晶体上滴加浓硫酸,变成白色固体,浓硫酸表现脱水性 |
| D.热的浓硫酸溶液与过量的铁粉反应,至少涉及三个氧化还原反应 |
您最近半年使用:0次
6 . 以黄铜矿(主要成分为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4•7H2O)。其主要工艺流程如图所示:

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
(1)已知CuFeS2中金属元素均为+2价,则S元素的价态为_____ ,在反应Ⅰ中通入O2的主要目的是将Fe2+氧化成Fe3+,写出O2将Fe2+氧化成Fe3+的离子方程式_____ 。
(2)反应Ⅱ中加入的试剂a为CuO固体,其目的是消耗溶液中的H+,使溶液的pH升高到某一数值m,试根据上述表格中提供的相关数据,推导m的取值范围_____ (用“<”或“≤”表示)。
(3)反应Ⅳ中加入的试剂c为_____ (填写试剂名称)。
(4)反应Ⅲ、Ⅴ中加入的试剂b为铁粉,其目的分别为_____ 。
(5)操作X的名称为_____ ,如何检验“滤液”中是否存在Fe3+_____ 。

已知:部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如表所示:
| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
(2)反应Ⅱ中加入的试剂a为CuO固体,其目的是消耗溶液中的H+,使溶液的pH升高到某一数值m,试根据上述表格中提供的相关数据,推导m的取值范围
(3)反应Ⅳ中加入的试剂c为
(4)反应Ⅲ、Ⅴ中加入的试剂b为铁粉,其目的分别为
(5)操作X的名称为
您最近半年使用:0次
名校
解题方法
7 . 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
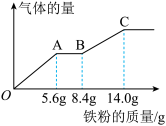

| A.OA段产生的是NO,AB段发生的反应为Fe+2Fe3+=3Fe2+ |
| B.第二份溶液从反应开始至结束,所得气体总体积在标况下为3.36L |
| C.BC段反应为Fe+2H+=Fe2++H2↑ |
D.C点SO 浓度为2.5mol·L-1 浓度为2.5mol·L-1 |
您最近半年使用:0次
2023-04-28更新
|
177次组卷
|
2卷引用:湖北省恩施州高中教育联盟2022-2023学年高一下学期期中考试化学试题
名校
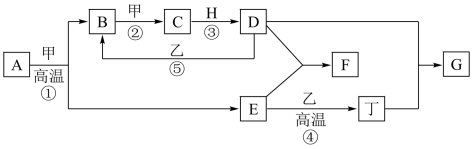
8 . 几种中学常见的单质及化合物的相互转化关系如图(部分反应物或产物已省略):
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应⑤中乙转化为一种常见的温室气体。试根据上述信息,回答下列问题:
(1)A的化学式为______ 。
(2)工业上用A为原料来制备D,写出反应②的化学方程式______ 。
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式______ 。
(4)写出反应⑤的化学方程式______ 。
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。M中化学键的类型为_____ (填“离子键、极性键或非极性键”)试写出M在酸性环境下将G氧化为F的离子方程式______ 。
②A是黄铁矿的主要成分,由两种元素组成,其原子个数比为l︰2,元素质量之比为7︰8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,反应⑤中乙转化为一种常见的温室气体。试根据上述信息,回答下列问题:
(1)A的化学式为
(2)工业上用A为原料来制备D,写出反应②的化学方程式
(3)F与丁单质反应也可以得到G,试写出该反应的离子方程式
(4)写出反应⑤的化学方程式
(5)化合物M与H组成元素相同,可以将G转化为F,且不引进新杂质。M中化学键的类型为
您最近半年使用:0次
2023-04-24更新
|
245次组卷
|
3卷引用: 湖北省仙桃中学2022-2023学年高一上学期10月月考化学试题
解题方法
9 . 将铁片加入到 1 L 0.5 mol/L FeCl3 溶液中, 当Fe2+和 Fe3+的浓度相等时, 消耗铁片的物质的量为
| A.0.1 mol | B.0.2 mol | C.0.3 mol | D.0.4 mol |
您最近半年使用:0次
名校
解题方法
10 . 下列实验过程能达到实验目的的是
| 选项 | 实验目的 | 实验过程 |
| A | 比较Fe3+和I2的氧化性强弱 | 向淀粉碘化钾溶液中滴入氯化铁溶液,观察溶液颜色 |
| B | 鉴别NaHCO3与Na2CO3溶液 | 用小试管分别取少量溶液,然后滴加澄清石灰水观察是否沉淀 |
| C | 比较金属镁和铝的活泼性强弱 | 分别向两只盛有等体积等浓度的NaOH溶液的烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
| D | 探究铁在氯气中的燃烧产物 | 将装 有过量铁粉的燃烧匙烧至红热,伸入盛有氯气的集气瓶。将反应后的固体倒入水中,滴加KSCN溶液,观察溶液颜色 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-10-14更新
|
274次组卷
|
4卷引用:湖北省襄阳市襄州一中2022-2023学年高一上学期12月月考化学试题
湖北省襄阳市襄州一中2022-2023学年高一上学期12月月考化学试题(已下线)【2022】【高一上】【期末考】【杭四下沙】【高中化学】【徐外兰收集】广东省广州市西关外国语学校2022-2023学年高一上学期期末考试化学试题浙江省宁波市效实中学2023-2024学年高一上学期期末化学模拟卷



