2014高三·全国·专题练习
名校
解题方法
1 . 某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为____________________________________________________ 。
(2)装置C的作用是__________________________ ,处理尾气的方法为_____________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
①乙组得到的黑色粉末是____________ 。
②甲组步骤1中反应的离子方程式为_________________________________________ 。
③乙组步骤4中,溶液变血红的原因为_______________________________________ ;溶液褪色可能的原因及其验证方法为________________________________________ 。
④从实验安全考虑,上图装置还可采取的改进措施是__________________________ 。

(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变血红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变血红,后褪色 |
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变血红的原因为
④从实验安全考虑,上图装置还可采取的改进措施是
您最近一年使用:0次
2023-07-06更新
|
666次组卷
|
12卷引用:2016届广西桂林市第十八中学高三第一次月考化学试卷
2016届广西桂林市第十八中学高三第一次月考化学试卷(已下线)2014届高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷2015届广东省广州市十三中高三上学期期中理综化学试卷贵州省习水县一中2018-2019学年高一上学期12月份考试化学试题云南省玉溪市新平彝族傣族自治县第三中学2019-2020学年高一上学期期中考试化学试题云南省永平县第二中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修一第三章《金属及其化合物》测试卷2贵州省惠水县第一高级中学2019-2020学年高一上学期期末考试化学试题(已下线)第2讲 离子反应和离子方程式(已下线)第6讲 铁及其重要化合物(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)江西省宜春市百树学校2023-2024学年高三上学期暑期阶段测试化学试卷
解题方法
2 . 下列指定反应的离子方程式书写正确的是
A.四氧化三铁溶于足量稀硝酸:3Fe3O4+28H++ =9Fe3++NO↑+14H2O =9Fe3++NO↑+14H2O |
| B.工业上生产漂白粉的原理:Cl2+2OH-=Cl-+ClO-+H2O |
C.向硫酸铵溶液中滴入少量氢氧化钠溶液: +OH-=NH3·H2O +OH-=NH3·H2O |
D.向酸性高锰酸钾溶液中滴入少量H2O2溶液:2 +6H++7H2O2=2Mn2++6O2↑+10H2O +6H++7H2O2=2Mn2++6O2↑+10H2O |
您最近一年使用:0次
2020-11-16更新
|
478次组卷
|
4卷引用:云贵川桂四省2021届高三上学期联合考试理综化学试题
3 . 根据图示一氧化碳还原铁的氧化物的实验装置,完成下列问题:

(1)判断硬质玻璃管中已开始发生反应的现象是__ 。
(2)反应过程中发生的现象是__ 。
(3)在A处点燃,可见淡蓝色火焰的原因是__ 。
(4)实验结束时应注意的操作是__ 。(填编号)
①先停止通入CO
②先熄灭酒精灯,并继续通入CO
③熄灭酒精灯,同时停止通入CO
④先熄灭酒精灯,继续通入CO,并继续点燃排出的CO气体

(1)判断硬质玻璃管中已开始发生反应的现象是
(2)反应过程中发生的现象是
(3)在A处点燃,可见淡蓝色火焰的原因是
(4)实验结束时应注意的操作是
①先停止通入CO
②先熄灭酒精灯,并继续通入CO
③熄灭酒精灯,同时停止通入CO
④先熄灭酒精灯,继续通入CO,并继续点燃排出的CO气体
您最近一年使用:0次
13-14高二上·黑龙江牡丹江·期末
名校
4 . 在火星上工作的美国“勇气号”“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水。以下叙述正确的是
| A.分别还原amolFe2O3所需H2、Al、CO的物质的量之比为3:2:3 |
| B.检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C.铝热剂就是单指Fe2O3粉末和铝粉的混合物 |
| D.明矾属于硫酸盐,含结晶水,属于混合物 |
您最近一年使用:0次
2019-05-09更新
|
299次组卷
|
15卷引用:广西灵山县第二中学2018届高三上学期开学考试化学试题
广西灵山县第二中学2018届高三上学期开学考试化学试题(已下线)2012-2013学年黑龙江省牡丹江一中高二上学期期末化学试卷(已下线)2014届安徽六校教育研究会高三第一次联考化学试卷河南省周口市中英文学校2018届高三上学期开学摸底考试化学试题甘肃省武威市第六中学2018届高三上学期第二次阶段性过关考试化学试题江西省临川区第一中学2018届高三上学期第二次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题1湖南省永州市祁阳县高考补习学校2018届高三上学期第二次月考化学试题上海市交通大学附属中学2017-2018学年高二上学期第一次月考化学试题2陕西省西安市第八十三中学高三年级2017-2018学年第三阶段考试化学试题云南省玉溪市通海县第二中学2019届高三9月月考化学试题【全国百强校】河北省邢台市第一中学2018-2019学年高一下学期期中考试化学试题辽宁省本溪市2019-2020学年高一下学期寒假验收考试化学试题(已下线)专题07 铁及其化合物(核心素养卷)——【新教材精创】2019-2020学年高中化学新教材知识讲学课后-8.1.1 金属矿物 海水资源的开发利用-人教2019必修第二册
名校
5 . 物质A-J间的转化关系如图所示,A、C为金属氧化物,其中A 为红棕色粉末,B、D是生活中常见金属单质,F、J是难溶于水的白色化合物,G、J受热后容易分解。

(1)A 的化学式是________________ ;
(2)I→J 反应的离子方程式是_______________________________ ;
(3)F转化为G的过程中观察到的现象是__________________________ ,反应的化学方程式是___________________________ ;
(4)检验E 中主要阳离子的方法________________________________ ;

(1)A 的化学式是
(2)I→J 反应的离子方程式是
(3)F转化为G的过程中观察到的现象是
(4)检验E 中主要阳离子的方法
您最近一年使用:0次
名校
6 . 下列离子方程式正确的是( )
| A.将氨水滴入到FeCl3溶液中:Fe3++3OH-===Fe(OH)3↓ |
| B.向氯化亚铁溶液中通入Cl2:Fe2++Cl2===Fe3++2Cl- |
| C.向FeCl3溶液中加入铁粉:Fe+Fe3+===2Fe2+ |
| D.氧化铁与盐酸反应:Fe2O3+6H+===2Fe3++3H2O |
您最近一年使用:0次
2018-01-07更新
|
252次组卷
|
2卷引用:广西陆川县中学2017-2018学年高一12月月考化学试题
名校
7 . 将下列四种化合物溶于稀盐酸,滴加硫氰化钾溶液,没有颜色变化,再加氯水即呈现红色的是( )
| A.FeO | B.Fe2O3 | C.Fe3O4 | D.Fe2(SO4)3 |
您最近一年使用:0次
2018-01-07更新
|
657次组卷
|
12卷引用:广西陆川县中学2017-2018学年高一12月月考化学试题
广西陆川县中学2017-2018学年高一12月月考化学试题黑龙江省大庆中学2017-2018学年高一上学期期末化学试题陕西省延安市实验中学大学区校际联盟2017-2018学年高一上学期期末考试化学试题(A)湖北省仙桃市汉江中学2017-2018学年高一上学期期末考试化学试题广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题云南省通海三中2018-2019学年高一6月份考试化学试题湖南省常德市2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第三章《金属及其化合物》测试卷湖南省娄底市第一中学2019-2020学年高一上学期期末考试化学试题广东省湛江市2018-2019学年高一上学期期末考试化学试题 天津市静海区四校2021-2022学年高一上学期12月阶段性检测化学试题上海市延安中学2022-2023学年高二上学期10月阶段测试化学试题
8 . 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液的化学方程式:__________________________ 。
(2)锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为_________ (用化学式表示)。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________ 。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:__________ 。
(5)某混合物 ,含有
,含有 、
、 和
和 ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:

据此回答下列问题:
①写出固体 的化学式:
的化学式:
__________ ;
②写出D与稀硫酸反应的化学方程式:___________________________________________ ;
写出反应①的离子方程式:_________________________________________ 。
(1)单质铝溶于氢氧化钠溶液的化学方程式:
(2)锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:
(5)某混合物
 ,含有
,含有 、
、 和
和 ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
据此回答下列问题:
①写出固体
 的化学式:
的化学式:
②写出D与稀硫酸反应的化学方程式:
写出反应①的离子方程式:
您最近一年使用:0次
2017-08-31更新
|
202次组卷
|
2卷引用:广西灵山县第二中学2018届高三上学期开学考试化学试题
名校
解题方法
9 . 下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。
(1)写出B的化学式:______________ C的化学式:____________________ 。
(2)写出D与I溶液发生反应的离子方程式:_________________ 。
(3)写出L→M的现象是:________________________ 。
(4)从G与J反应后的混合物中得到M的操作方法叫做___________________ 。

(1)写出B的化学式:
(2)写出D与I溶液发生反应的离子方程式:
(3)写出L→M的现象是:
(4)从G与J反应后的混合物中得到M的操作方法叫做
您最近一年使用:0次
名校
解题方法
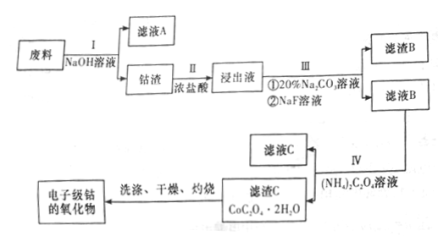
10 . 电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。现从废料(含Co3O4、Al、Si、Li2O、Fe2O3等物质)中提纯电子级钴的氧化物,其工业制取流程如下:
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
(1)废料在处理前要粉碎,其主要目的是(回答两个方面)___________ ;
步骤I得到的滤液A中的溶质为___________ (填化学式)。
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为_________ 。
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为___________ ;滤渣B的主要成分为____________ 。
(4)步骤I、III、IV中均用到的分离提纯方法为_______ ,在实验室中完成该操作用到的玻璃仪器是__ 。
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
290℃~320℃时若生成两种气体,则发生反应的化学方程式为___________ ,400℃~500℃所得固体的化学式为__________ 。
已知:
①物质的溶解性:LiF难溶于水,Li2CO3微溶于水;②钴元素常见的化合价为+ 2和+ 3;
③部分金属离子形成氢氧化物沉淀的pH见下表。
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
步骤I得到的滤液A中的溶质为
(2)步骤II中有黄绿色气体生成,有关含钴化合物发生反应的离子方程式为
(3)步骤III中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH的取值范围为
(4)步骤I、III、IV中均用到的分离提纯方法为
(5)5.49gCoC2O4·2H2O(其相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,其热重分析如下表。
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.25 |
| 400~500 | 2.41 |
您最近一年使用:0次



