名校
解题方法
1 . 以某含钴废料(主要成分为 ,含有少量铁的氧化物、
,含有少量铁的氧化物、 和NiO)为原料制备碳酸钴和黄钠铁矾
和NiO)为原料制备碳酸钴和黄钠铁矾 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是

 ,含有少量铁的氧化物、
,含有少量铁的氧化物、 和NiO)为原料制备碳酸钴和黄钠铁矾
和NiO)为原料制备碳酸钴和黄钠铁矾 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是
A.还原性: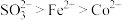 |
B.可用 溶液检验“氧化”是否完全 溶液检验“氧化”是否完全 |
C.“调pH”时反应的离子方程式: |
D.“沉钴”时若用 代替 代替 ,将有 ,将有 放出污染环境 放出污染环境 |
您最近一年使用:0次
2023-06-02更新
|
234次组卷
|
2卷引用:山东省烟台招远市2023届高三5月摸底考试化学试题
解题方法
2 . 利用锶渣(主要成分 ,含少量
,含少量 、
、 、
、 、
、 杂质),工业上制备超细碳酸锶的工艺如图所示:
杂质),工业上制备超细碳酸锶的工艺如图所示:

已知:“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。下列说法错误的是
 ,含少量
,含少量 、
、 、
、 、
、 杂质),工业上制备超细碳酸锶的工艺如图所示:
杂质),工业上制备超细碳酸锶的工艺如图所示:
已知:“高温煅烧”得到的主要产物为锶的硫化物和一种可燃性气体。下列说法错误的是
A.“高温煅烧”过程中,产生可燃性气体与参加反应的 物质的量之比大于4∶1 物质的量之比大于4∶1 |
B.气体2通入 溶液产生黑色沉淀 溶液产生黑色沉淀 |
| C.“除镁钙”时控制温度95℃~100℃是为了降低氢氧化钙的溶解度,保证除钙效果 |
D.“沉锶”的离子反应方程式为 |
您最近一年使用:0次
3 . 钛铁矿主要成分为钛酸亚铁( ),含少量
),含少量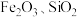 等杂质,工业上由钛铁矿制备
等杂质,工业上由钛铁矿制备 的流程如下。下列说法错误的是
的流程如下。下列说法错误的是

 ),含少量
),含少量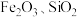 等杂质,工业上由钛铁矿制备
等杂质,工业上由钛铁矿制备 的流程如下。下列说法错误的是
的流程如下。下列说法错误的是
A.“反应釜”通入空气的主要作用是将 氧化成 氧化成 |
B.“矿渣”的主要成分是 |
C.“酸解”可能发生反应: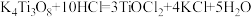 |
| D.“水解”所得物质X为盐酸,可循环利用 |
您最近一年使用:0次
解题方法
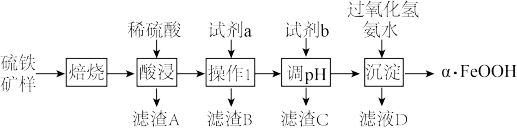
4 . 生产软磁铁氧体的主要原料是α-FeOOH,以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备α-FeOOH的工艺流程如下,相关数据见下表。下列说法错误的是

| 物质 |  |  |  |
| 开始沉淀pH(25℃) | 1.9 | 7.6 | 4.0 |
| 沉淀完全pH(25℃) | 3.2 | 9.7 | 5.2 |
| A.“焙烧”的产物之一可用于工业制硫酸 |
| B.“试剂a”可以为FeS,主要目的是除去过量硫酸 |
| C.“试剂b”可以为氨水,调pH的范围为5.2~7.6 |
D.“沉淀”时,pH过高或者过低均不利于生成 |
您最近一年使用:0次
名校
解题方法
5 . 用铁泥(主要成分为Fe2O3,还含有少量FeO和Fe)制备纳米Fe3O4的流程如下。下列说法正确的是
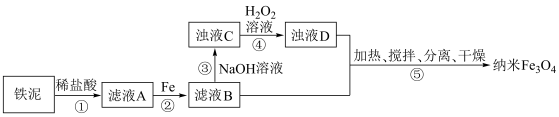

| A.步骤①发生的反应均为氧化还原反应 |
| B.步骤②中发生的反应为2Fe3++Fe = 3Fe2+、Fe+2H+ = Fe2++H2↑ |
| C.步骤④中使用过量的H2O2有利于提高纳米Fe3O4产率 |
| D.纳米Fe3O4能产生丁达尔效应 |
您最近一年使用:0次
2023-05-16更新
|
413次组卷
|
2卷引用:山东省烟台市2022-2023学年高一上学期期末考试化学试题
6 . 用硫酸渣(主要成分为Fe2O3、SiO2)制备铁基颜料铁黄(FeOOH)的一种工艺流程如图。
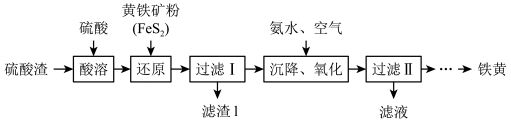
已知:“还原”时,发生反应FeS2+14Fe3++8H2O=2 +15Fe2++16H+;FeS2与H2SO4、NaOH不反应。回答下列有关问题。
+15Fe2++16H+;FeS2与H2SO4、NaOH不反应。回答下列有关问题。
(1)“酸溶”时,为了加快反应速率可以采取的措施___________ (写出一点即可)。
(2)“还原”时,氧化产物与还原产物质的物质的量之比为___________ 。
(3)“过滤I”所得滤液中存在的阳离子主要有________ ,滤渣I的成分为SiO2、FeS2,为了从滤渣I中回收FeS2循环利用,可采取的操作方法为________ ,发生反应的离子方程式为________ 。
(4)“沉降、氧化”时,每生成1mol铁黄(FeOOH)消耗标准状况下O2的体积为________ L。

已知:“还原”时,发生反应FeS2+14Fe3++8H2O=2
 +15Fe2++16H+;FeS2与H2SO4、NaOH不反应。回答下列有关问题。
+15Fe2++16H+;FeS2与H2SO4、NaOH不反应。回答下列有关问题。(1)“酸溶”时,为了加快反应速率可以采取的措施
(2)“还原”时,氧化产物与还原产物质的物质的量之比为
(3)“过滤I”所得滤液中存在的阳离子主要有
(4)“沉降、氧化”时,每生成1mol铁黄(FeOOH)消耗标准状况下O2的体积为
您最近一年使用:0次
7 . 以电解金属锰阳极渣(主要成分为 ,杂质为Pb、Fe、Ca、Mg元素的化合物)和黄铁矿
,杂质为Pb、Fe、Ca、Mg元素的化合物)和黄铁矿 (杂质为
(杂质为 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:

已知: ,
,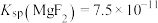 。
。
回答下列问题:
(1)为提高酸浸效果,可采取的措施有______ (写出两项)。
(2)“酸浸”过程中没有S单质生成,滤渣①的主要成分为(填化学式)______ ; 参与反应的离子方程式为
参与反应的离子方程式为________ 。
(3)向氧化过滤后的溶液中加入HF以除去溶液中钙元素和镁元素,除钙前滤液中( 浓度为
浓度为 mol⋅L
mol⋅L ,当溶液中
,当溶液中 mol⋅L
mol⋅L 时,除钙率为
时,除钙率为______ 。
(4)将“碱化”步骤所得含少量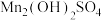 的
的 固体加去离子水打成浆,通空气氧化过程溶液pH随时间变化如图所示,pH先基本不变后迅速下降的原因为
固体加去离子水打成浆,通空气氧化过程溶液pH随时间变化如图所示,pH先基本不变后迅速下降的原因为____________ 。

(5)向滤液④中加入氧化钙,可得到在上述流程中循环利用的物质是____________ ;“一系列操作”包括____________ 。
 ,杂质为Pb、Fe、Ca、Mg元素的化合物)和黄铁矿
,杂质为Pb、Fe、Ca、Mg元素的化合物)和黄铁矿 (杂质为
(杂质为 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
已知:
 ,
,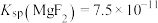 。
。回答下列问题:
(1)为提高酸浸效果,可采取的措施有
(2)“酸浸”过程中没有S单质生成,滤渣①的主要成分为(填化学式)
 参与反应的离子方程式为
参与反应的离子方程式为(3)向氧化过滤后的溶液中加入HF以除去溶液中钙元素和镁元素,除钙前滤液中(
 浓度为
浓度为 mol⋅L
mol⋅L ,当溶液中
,当溶液中 mol⋅L
mol⋅L 时,除钙率为
时,除钙率为(4)将“碱化”步骤所得含少量
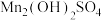 的
的 固体加去离子水打成浆,通空气氧化过程溶液pH随时间变化如图所示,pH先基本不变后迅速下降的原因为
固体加去离子水打成浆,通空气氧化过程溶液pH随时间变化如图所示,pH先基本不变后迅速下降的原因为
(5)向滤液④中加入氧化钙,可得到在上述流程中循环利用的物质是
您最近一年使用:0次
8 . 湿法炼锌的净化钴渣中含有Zn、Co、Cu和Fe的单质及 ,利用过硫酸钠氧化水解法制备
,利用过硫酸钠氧化水解法制备 ,同时分别回收锌、铜和铁元素的工艺流程如下,可能用到的数据见下表。
,同时分别回收锌、铜和铁元素的工艺流程如下,可能用到的数据见下表。

下列说法错误的是
 ,利用过硫酸钠氧化水解法制备
,利用过硫酸钠氧化水解法制备 ,同时分别回收锌、铜和铁元素的工艺流程如下,可能用到的数据见下表。
,同时分别回收锌、铜和铁元素的工艺流程如下,可能用到的数据见下表。
 |  |  |  | |
| 开始沉淀pH | 1.9 | 4.2 | 6.2 | 7.7 |
| 沉淀完全pH | 3.2 | 6.7 | 8.2 | 9.2 |
| A.固体X主要成分是Cu,金属M为Zn |
B.根据流程可知: 的还原性弱于 的还原性弱于 |
| C.调pH的范围为3.2~7.7 |
D.“沉钴”反应的离子方程式为 |
您最近一年使用:0次
2023·黑龙江绥化·模拟预测
9 . 碳酸锂(Li2CO3)微溶于水 、稀酸, 其溶解度随温度的升高而降低,不溶于C2H5OH,医学上可用其治疗精神忧郁症。以钴酸锂废料(主要含有LiCoO2,难溶于水,还含有少量Al2O3)为原料制备Co(OH)2及Li2CO3的工艺流程如图所示。

回答下列问题:
(1)“酸浸还原”时得到的溶液中阴离子主要为 ,
, 的空间构型为
的空间构型为___________ ,LiCoO2发生反应的离子方程式为___________ 。
(2)“滤渣1”中含有少量 Co(OH)2,原因为___________ 。
(3)常温下[Ksp[Co(OH)2]=1.0×10−15,当c(Co2+ )= 10−5 mol·L−1时视作“沉钴”完全,此时溶液的pH=___________ ;Co(OH)2久置于空气中转化为棕色的Co(OH)3,化学方程式为 ___________ 。
(4)“沉锂”所得的溶液中主要含有硫酸钠,则试剂X为___________ (填化学式)溶液。
(5)“系列操作”为蒸发浓缩、___________ 、洗涤、 干燥,洗涤时所用到的玻璃仪器为烧杯、漏斗、___________ 。

回答下列问题:
(1)“酸浸还原”时得到的溶液中阴离子主要为
 ,
, 的空间构型为
的空间构型为(2)“滤渣1”中含有少量 Co(OH)2,原因为
(3)常温下[Ksp[Co(OH)2]=1.0×10−15,当c(Co2+ )= 10−5 mol·L−1时视作“沉钴”完全,此时溶液的pH=
(4)“沉锂”所得的溶液中主要含有硫酸钠,则试剂X为
(5)“系列操作”为蒸发浓缩、
您最近一年使用:0次
名校
10 . 工业上以铝土矿(主要成分为Al2O3,含少量Fe2O3、FeO、SiO2等杂质)为主要原料制备氧化铝,流程如下。
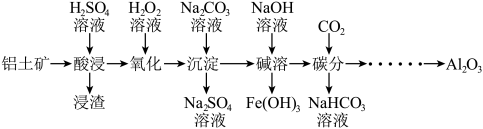
(1)酸浸:
①用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是___________ 。
②浸渣的主要成分为___________ (填化学式)。
(2)氧化:
①用 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为___________ 。
② 实际用量比理论上多的原因是
实际用量比理论上多的原因是___________ (用化学方程式解释)。
(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为___________ (填字母)。
A. 4.0左右 B. 5.0左右 C. 6.0左右
②检验Fe3+沉淀完全的实验方法为___________ 。
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为___________ (填名称)。
(5)碳分:向“碱溶”后的溶液中通入足量 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为___________ 。

(1)酸浸:
①用H2SO4溶液浸取铝土矿中的铝元素和铁元素,H2SO4溶液的用量不宜过量太多,其原因是
②浸渣的主要成分为
(2)氧化:
①用
 溶液将
溶液将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为②
 实际用量比理论上多的原因是
实际用量比理论上多的原因是(3)沉淀:用Na2CO3溶液调节pH,将Al3+、Fe3+转化为沉淀。溶液终点pH对铝、铁沉淀率的影响如图所示。

①为获得较高的铝、铁沉淀率,应控制溶液pH最佳为
A. 4.0左右 B. 5.0左右 C. 6.0左右
②检验Fe3+沉淀完全的实验方法为
(4)碱溶:用NaOH溶液溶解沉淀,分离出Fe(OH)3的实验操作为
(5)碳分:向“碱溶”后的溶液中通入足量
 气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
气体,生成Al(OH)3沉淀和NaHCO3,该反应的离子方程式为
您最近一年使用:0次
2023-05-05更新
|
585次组卷
|
3卷引用: 山东省青岛第五十八中学2022-2023学年高一下学期期末考试化学试题



