20-21高一·全国·课时练习
解题方法
1 . 固体A由四种元素组成的化合物,为探究固体A的组成,设计并完成如下实验:
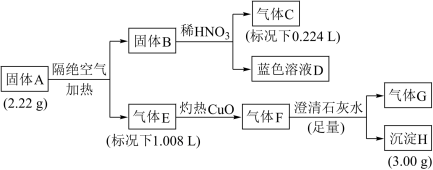
已知:固体B是一种单质,气体E、F都是G和另外一种气体组成。
请回答:
(1)组成A的四种元素是_____ ,气体E是____ 。
(2)固体A隔绝空气加热分解的化学方程式是______ 。
(3)蓝色溶液D和乙醇反应可获得固体A,同时还生成一种常见的温室气体,该反应的化学方程式为_____________________ 。

已知:固体B是一种单质,气体E、F都是G和另外一种气体组成。
请回答:
(1)组成A的四种元素是
(2)固体A隔绝空气加热分解的化学方程式是
(3)蓝色溶液D和乙醇反应可获得固体A,同时还生成一种常见的温室气体,该反应的化学方程式为
您最近一年使用:0次
2 . 加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。下图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。
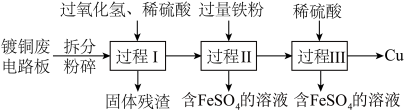
(1)上述流程中,为加快化学反应速率而采取的措施是______ 。
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是______ 。
(3)过程Ⅱ中,获得Cu的反应的离子方程式为______ 。
(4)过程Ⅲ的目的是______ 。

(1)上述流程中,为加快化学反应速率而采取的措施是
(2)过程Ⅰ中,Cu溶解,过氧化氢的作用是
(3)过程Ⅱ中,获得Cu的反应的离子方程式为
(4)过程Ⅲ的目的是
您最近一年使用:0次
2020-08-04更新
|
300次组卷
|
5卷引用:2020年北京市第一次普通高中学业水平合格性考试化学试题
3 . 氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:
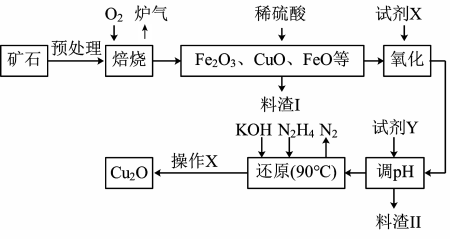
常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
(1)炉气中的有害气体成分是________ ,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为______ 。
(2)试剂X是H2O2溶液,当试剂X是___________ 时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是________ 。
(4)“还原”步骤中为提高N2H4转化率可采取的措施有_________ (填序号)。
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为_______________
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是____________ 。

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表:
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀 | 7.5 | 2.7 | 4.8 |
| 完全沉淀 | 9.0 | 3.7 | 6.4 |
(2)试剂X是H2O2溶液,当试剂X是
(3)加入试剂Y调pH时,pH的调控范围是
(4)“还原”步骤中为提高N2H4转化率可采取的措施有
a.不断搅拌,使N2H4和溶液充分接触 b.增大通入N2H4的流速
c.减少KOH的进入量 d.减小通入N2H4的流速
(5)写出用N2H4制备Cu2O的化学方程式为
(6)操作X包括烘干,其中烘干时要隔绝空气,其目的是
您最近一年使用:0次
名校
4 . Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______ .
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是______ .
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______ .简述你的理由______ .
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设______ 成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______ .
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液。
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明假设
(5)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
您最近一年使用:0次
2020-06-06更新
|
246次组卷
|
2卷引用:甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题
名校
解题方法
5 . 某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu(NO3)2的部分工艺流程如图所示:
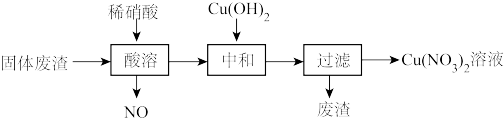
(1)Cu与稀硝酸反应的离子方程式为___ 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是___ ,若保持反应温度为70℃,欲加快反应速率可采取的措施为___ (写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为___ 。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为___ ,由Cu(NO3)2溶液制备Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、___ 、___ 。

(1)Cu与稀硝酸反应的离子方程式为
(2)酸溶时,反应温度不宜超过70℃,其主要原因是
(3)过滤后所得废渣的主要成分的化学式为
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 氯化亚铜(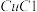 )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。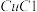 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量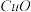 )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产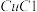 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:

(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式______________ 。
(2)步骤②中,亚硫酸铵要略保持过量,原因是___________ ,滤液中可循环利用的物质是__________ 。
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为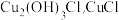 被氧化为
被氧化为 的化学方程式为
的化学方程式为______________________ 。
(4)用 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品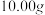 ,将其置于过量的
,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成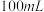 溶液,取溶液
溶液,取溶液 用
用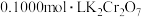 溶液进行滴定,反应中
溶液进行滴定,反应中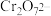 被还原成
被还原成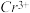 ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中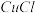 的质量分数
的质量分数__________________ 。
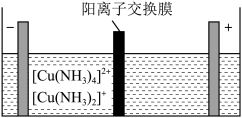
(5)制造印刷电路板产生的废液中含大量 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到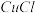 ,电解时阴极的电极反应式为
,电解时阴极的电极反应式为___________ ,生成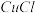 的离子方程式为
的离子方程式为________________________________ 。
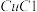 )在化工、印染、电镀等行业应用广泛。
)在化工、印染、电镀等行业应用广泛。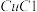 微溶于水,不溶于醇和稀酸,可溶于
微溶于水,不溶于醇和稀酸,可溶于 浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量
浓度较大的溶液,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量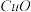 )为原料,采用硝酸铵氧化分解技术生产
)为原料,采用硝酸铵氧化分解技术生产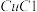 的工艺过程如图。回答下列问题:
的工艺过程如图。回答下列问题:
(1)步骤①中N元素被还原为最低价,写出此反应的离子方程式
(2)步骤②中,亚硫酸铵要略保持过量,原因是
(3)步骤⑤中,用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为
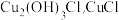 被氧化为
被氧化为 的化学方程式为
的化学方程式为(4)用
 溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品
溶液测定氯化亚铜样品纯度(假设杂质不参与反应),步骤如下:准确称取所制备的氯化亚铜样品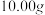 ,将其置于过量的
,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸配成
溶液中,待样品完全溶解后,加入适量稀硫酸配成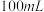 溶液,取溶液
溶液,取溶液 用
用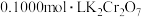 溶液进行滴定,反应中
溶液进行滴定,反应中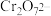 被还原成
被还原成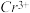 ,相关数据记录如表所示:该样品中
,相关数据记录如表所示:该样品中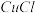 的质量分数
的质量分数| 实验编号 | 1 | 2 | 3 |
消耗 溶液的体积/mL 溶液的体积/mL | 14.98 | 16.03 | 15.02 |
 等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到
等离子,利用膜电解技术对此废液进行电解,电解装置如图所示。电解后的阴极液中加入适量盐酸并用水稀释可得到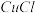 ,电解时阴极的电极反应式为
,电解时阴极的电极反应式为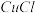 的离子方程式为
的离子方程式为
您最近一年使用:0次
2020-03-28更新
|
353次组卷
|
3卷引用:山东省实验中学2020届高三线上诊断测试化学试题
山东省实验中学2020届高三线上诊断测试化学试题(已下线)考点17 化工生产诸要素及流程图分析-2020年高考化学命题预测与模拟试题分类精编山东省六地市部分学校2020届高三下学期3月2日线上考试化学试题
解题方法
7 . 孔雀石的主要成分为Cu2(OH)2CO3(含少量FeO、Fe2O3、SiO2)。某小组同学在实验室以孔雀石为原料制备胆矾,并测定所得胆矾中结晶水的含量。实验步骤如下:
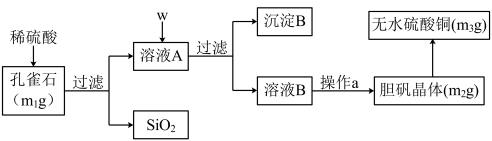
(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为________ 。
(2)按试剂加入顺序,w所代表的试剂依次为__________ 。沉淀B的成分为_______ 。
(3)a操作依次为:加热蒸发、_______ 、过滤、洗涤、__________ 。除烧杯、漏斗之外过滤还需要另一玻璃仪器,该仪器在此操作中的主要作用是_________ 。
(4)欲检验溶液A中Fe2+的试剂是___________ (选填序号)。如果测定Fe2+的含量,需要用容量瓶配制某标准溶液,请简述配制中“定容”的操作:_____ 。
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是_______________ 。
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为: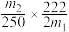 ,另一位同学不同意,其原因是
,另一位同学不同意,其原因是___________ 。

(提供试剂:NaOH溶液、 H2O2溶液、 CuO 、Na2CO3)
完成下列填空:
(1)孔雀石的主要成分与稀硫酸反应的离子方程式为
(2)按试剂加入顺序,w所代表的试剂依次为
(3)a操作依次为:加热蒸发、
(4)欲检验溶液A中Fe2+的试剂是
a NaOH(aq) b Na2CO3(aq) c 淀粉KI(aq) d 酸性KMnO4(aq)
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中,若测定结果的实验误差为1.5%,可能的原因是
a 加热温度过高 b 胆矾晶体的颗粒较大
c 加热后放在空气中冷却 d 加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中孔雀石的质量分数为:
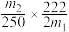 ,另一位同学不同意,其原因是
,另一位同学不同意,其原因是
您最近一年使用:0次
解题方法
8 . 铜是一种古老而又年轻的金属元素,铜及其化合物在生产生活中有着广泛的应用。
(1)古代留下来的青铜器表面呈绿色,原因是在潮湿的空气中,铜易发生腐蚀生成铜绿,有关反应的化学方程式为______ 。
(2)现代工业主要采用高温冶炼黄铜矿 ,也可表示为
,也可表示为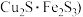 的方法获得铜。火法炼铜首先要焙烧黄铜矿:
的方法获得铜。火法炼铜首先要焙烧黄铜矿: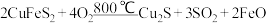 ,每转移0.6mol电子,有
,每转移0.6mol电子,有______ mol硫原子被氧化。写出火法炼铜由 得到Cu的总方程式
得到Cu的总方程式______ 。
(3) 可用于游泳池水的消毒,原因是
可用于游泳池水的消毒,原因是______ 。
(4)向 和
和 的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为
的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为______ (已知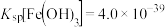 ,
,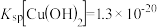 )。
)。
(5)利用Cu和 溶液的反应可制作印刷线路板,为了从含有
溶液的反应可制作印刷线路板,为了从含有 、
、 、
、 的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
方案1:向废液中加入过量铁粉,充分反应后过滤。在所得滤渣中加入足量盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为______ 。
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时Cu已全部析出,在电极上可直接回收铜。操作比方案1简便,但方案2也有不足之处,主要表现为______ 。
(1)古代留下来的青铜器表面呈绿色,原因是在潮湿的空气中,铜易发生腐蚀生成铜绿,有关反应的化学方程式为
(2)现代工业主要采用高温冶炼黄铜矿
 ,也可表示为
,也可表示为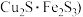 的方法获得铜。火法炼铜首先要焙烧黄铜矿:
的方法获得铜。火法炼铜首先要焙烧黄铜矿: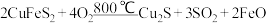 ,每转移0.6mol电子,有
,每转移0.6mol电子,有 得到Cu的总方程式
得到Cu的总方程式(3)
 可用于游泳池水的消毒,原因是
可用于游泳池水的消毒,原因是(4)向
 和
和 的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为
的混合溶液中加入CuO粉末会产生新的沉淀,该沉淀的主要成分的化学式为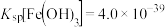 ,
,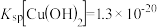 )。
)。(5)利用Cu和
 溶液的反应可制作印刷线路板,为了从含有
溶液的反应可制作印刷线路板,为了从含有 、
、 、
、 的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:
的废液中回收Cu,某化学兴趣小组的同学设计了以下两种实验方案:方案1:向废液中加入过量铁粉,充分反应后过滤。在所得滤渣中加入足量盐酸,充分反应后,再过滤即得到铜。方案1中涉及的四种阳离子的氧化性由强到弱的顺序为
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时Cu已全部析出,在电极上可直接回收铜。操作比方案1简便,但方案2也有不足之处,主要表现为
您最近一年使用:0次
解题方法
9 . 实验室制备四水甲酸铜[Cu(HCOO)2∙4H2O]晶体实验步骤如下。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是______ 。
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到_____ (写实验现象),说明温度过高。
c.相关的化学方程式______ 。
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式______ 。
b.趁热过滤中,必须趁热的原因是______ 。
c.用乙醇洗涤晶体的目的______ 。
(1)碱式碳酸铜的制备:
a.步骤i是将一定量胆矾和碳酸氢钠固体一起放到研钵中研磨,其目的是
b.步骤ii是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到
c.相关的化学方程式
(2)四水甲酸铜晶体的制备:将碱式碳酸铜固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,乘热过滤除去少量不溶性杂质,然后蒸发冷却过滤,在用少量无水乙醇洗涤晶体2—3次晾干,得到产品。
a.相关的化学方程式
b.趁热过滤中,必须趁热的原因是
c.用乙醇洗涤晶体的目的
您最近一年使用:0次
10 . 某小组同学用如下装置电解食盐水,并对电解产物进行探究。
资料显示:
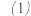 经检验,b极产生的气体是
经检验,b极产生的气体是 ,b极附近溶液的pH
,b极附近溶液的pH______ 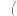 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变” ;铜丝a应与电源的
;铜丝a应与电源的______  填“正”或“负”
填“正”或“负” 极相连。
极相连。
 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______ 。
 ①橙黄色沉淀中含有
①橙黄色沉淀中含有 ,则CuCl转化为
,则CuCl转化为 的原因是
的原因是______  用方程式表示
用方程式表示 ;
;
②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是______ 。
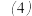 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有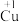 :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加
 至过量,应观察到的现象是
至过量,应观察到的现象是______ 。
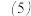 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为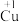 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解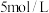 NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______ 。
| 实验装置 | 电解质溶液 | 实验现象 | |
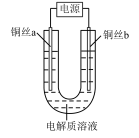 | 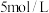 NaCl溶液 NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
| ①氯化亚铜(CuCl)为白色粉末,微溶于水; ②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的  ; ;③  水溶液中不稳定,酸性条件下易歧化为 水溶液中不稳定,酸性条件下易歧化为 和Cu; 和Cu;④氢氧化铜可以溶于浓NaOH得到蓝色溶液. |
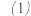 经检验,b极产生的气体是
经检验,b极产生的气体是 ,b极附近溶液的pH
,b极附近溶液的pH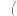 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变” ;铜丝a应与电源的
;铜丝a应与电源的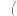 填“正”或“负”
填“正”或“负” 极相连。
极相连。 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是 ①橙黄色沉淀中含有
①橙黄色沉淀中含有 ,则CuCl转化为
,则CuCl转化为 的原因是
的原因是 用方程式表示
用方程式表示 ;
;②结合离子在溶液中的运动规律,解释“a极附近沉淀自下而上”变为橙黄色原因是
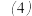 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有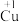 :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加
 至过量,应观察到的现象是
至过量,应观察到的现象是 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为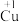 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解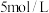 NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:
您最近一年使用:0次



