名校
解题方法
1 . 氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
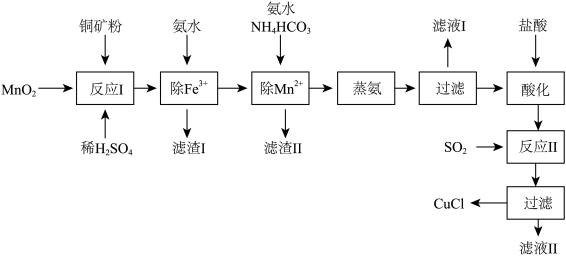
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________ 。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________ 。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
由表中信息可知蒸氨的条件应选_______ (填序号),请用平衡移动原理解释选择该条件的原因是_________________________ 。
(4)反应Ⅱ的离子方程式___________________________ 。
(5)实验证明通过如图装置也可获得CuCl,现象为
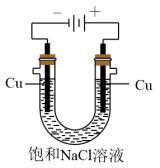
阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________ 。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________ 。(填序号)
a.容易脱水变成红色的Cu2O b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15 d.易被氧化成Cu(OH)2

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3
 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 100 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 100 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式
(5)实验证明通过如图装置也可获得CuCl,现象为

阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法
a.容易脱水变成红色的Cu2O b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15 d.易被氧化成Cu(OH)2
您最近一年使用:0次
2018-05-29更新
|
1024次组卷
|
4卷引用:【全国百强校】广西南宁市第三中学2018届高三第二次模拟考试理综化学试题
2023高三·全国·专题练习
2 . 某小组同学取含有少量CuO杂质的Cu2O样品进行如下实验,以测定氧化亚铜的纯度。
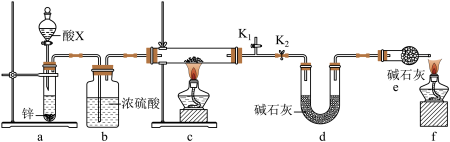
(1)装置a中所加的酸X是___________ (填化学式)。
(2)通过测定下列物理量,能达到实验目的的是___________(填字母)。
(3)熄灭酒精灯之后,仍需通一段时间H2至硬质玻璃管冷却,原因是___________ 。

(1)装置a中所加的酸X是
(2)通过测定下列物理量,能达到实验目的的是___________(填字母)。
| A.反应前后装置a的质量 |
| B.充分反应后装置c所得固体的质量 |
| C.反应前后装置d的质量 |
| D.反应前后装置e的质量 |
(3)熄灭酒精灯之后,仍需通一段时间H2至硬质玻璃管冷却,原因是
您最近一年使用:0次
3 . 已知:①Cu2O在酸性条件下能迅速发生反应:Cu2O+2H+=Cu+Cu2++H2O;②氮的氧化物能与红热的铜反应。某小组设计实验探究NO和Cu反应的氧化产物,装置如图所示(部分夹持装置未画出)。
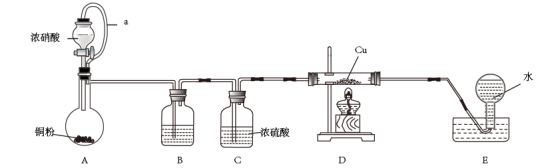
请回答下列问题:
(1)装置A中盛放铜粉的仪器名称为_______ ,a管的作用是_______ ,该装置中发生反应的离子方程式为_______ 。
(2)装置B中试剂为_______ ,装置E的作用是_______ 。
(3)实验开始时,先打开A中分液漏斗活塞,过一会儿,点燃D处酒精灯,这样操作的目的是_______ ,当Cu充分反应,实验结束时,下列操作中应首先进行的操作是_______ (填序号)。
①停止滴加浓硝酸 ②熄灭酒精灯 ③从E装置中取出导气管
(4)为了探究氧化产物是否含有Cu2O,取少量完全反应后的产物,进行如下实验:
(甲)加入足量的稀硝酸,观察是否完全溶解
(乙)加入足量的稀硫酸,观察是否完全溶解
(丙)加入足量的浓硝酸,观察是否完全溶解
(丁)在加热条件下通入乙醇蒸气,观察固体是否变为红色
其中,能达到实验目的的是_______ (填代号)。
(5)若氧化产物为CuO和Cu2O的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL标准状况下NO气体,则混合物中CuO和Cu2O的物质的量之比为_______ 。

请回答下列问题:
(1)装置A中盛放铜粉的仪器名称为
(2)装置B中试剂为
(3)实验开始时,先打开A中分液漏斗活塞,过一会儿,点燃D处酒精灯,这样操作的目的是
①停止滴加浓硝酸 ②熄灭酒精灯 ③从E装置中取出导气管
(4)为了探究氧化产物是否含有Cu2O,取少量完全反应后的产物,进行如下实验:
(甲)加入足量的稀硝酸,观察是否完全溶解
(乙)加入足量的稀硫酸,观察是否完全溶解
(丙)加入足量的浓硝酸,观察是否完全溶解
(丁)在加热条件下通入乙醇蒸气,观察固体是否变为红色
其中,能达到实验目的的是
(5)若氧化产物为CuO和Cu2O的混合物,为测定其组成,取混合物5.92g与足量稀硝酸反应,测得生成448mL标准状况下NO气体,则混合物中CuO和Cu2O的物质的量之比为
您最近一年使用:0次
4 . 铜器久置,表面会生成一层绿色固体,为了解铜在空气中的腐蚀情况,某化学兴趣小组收集家中铜器表面的绿色固体进行探究。查阅相关资料后,猜想该绿色物质可能是铜的碳酸盐。
该小组同学利用下图装置进行实验(部分夹持仪器略)。
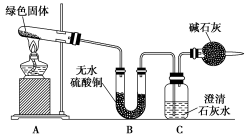
①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是________________________________________________ 。
(2)加热后试管中剩余的黑色物质是_________________________________________________ 。
(3)假设该绿色物质是一种纯净物,则其化学式可能是______________ ,加热分解的化学方程式为_______________________________________________________________________________________ 。
(4)上述实验步骤③中的反应的离子方程式为________________________________________ 。
(5)实验装置最后的干燥管的作用是___________________________________________________ 。
(6)如果将B、C两装置对调,能否达到实验目的______ (填“能”或“不能”),为什么?_____________________________________________________________________________________________________________ 。
该小组同学利用下图装置进行实验(部分夹持仪器略)。

①对试管内的绿色固体进行加热,至完全分解,观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸,观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
请回答下列问题:
(1)绿色固体中含有的元素是
(2)加热后试管中剩余的黑色物质是
(3)假设该绿色物质是一种纯净物,则其化学式可能是
(4)上述实验步骤③中的反应的离子方程式为
(5)实验装置最后的干燥管的作用是
(6)如果将B、C两装置对调,能否达到实验目的
您最近一年使用:0次
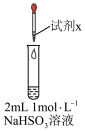
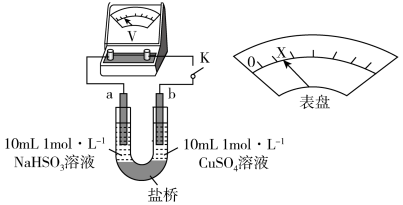
5 . 实验小组对NaHSO3溶液分别与CuCl2、CuSO4溶液的反应进行探究。
已知:Cu+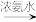 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)
(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为___________ 。
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设a不合理,实验证据是___________ 。
②实验表明假设b合理,实验I反应的离子方程式有___________ 、 。
。
(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-___________ 。
下述实验III证实了假设合理,装置如下图。___________ (补全实验操作及现象)。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和 。
。
①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是___________ 。___________ 。
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:___________ 。
| 实验 | 装置 | 试剂x | 操作及现象 |
| I |
| 1 mol/LCuCl2溶液 | 加入2mLCuCl2溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅 |
| II | 1 mol/LCuSO4溶液 | 加入2mL CuSO4溶液,得到绿色溶液,3分钟未见明显变化 |
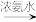 [Cu(NH3)2]+(无色溶液)
[Cu(NH3)2]+(无色溶液) [Cu(NH3)4]2+(深蓝色溶液)
[Cu(NH3)4]2+(深蓝色溶液)(1)推测实验I产生的无色气体为SO2,实验证实推测正确:用蘸有碘水的淀粉试纸接近试管口,观察到蓝色褪去。反应的离子方程式为
(2)对实验I产生SO2的原因进行分析,提出假设:
假设a:Cu2+水解使溶液中c(H+)增大;
假设b:Cl-存在时,Cu2+与
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设a不合理,实验证据是
②实验表明假设b合理,实验I反应的离子方程式有
 。
。(3)对比实验I、II,根据半反应就物质的氧化性还原性提出假设:Cl-
下述实验III证实了假设合理,装置如下图。
(4)将实验I的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和
 。
。①通过实验IV证实红色沉淀中含有Cu+和Cu2+。
实验IV:证实红色沉淀中含有Cu+的实验证据是
②有同学认为实验IV不足以证实红色沉淀中含有Cu2+,设计实验IV的对比实验Ⅴ,证实了Cu2+的存在。实验V的方案和现象是:
您最近一年使用:0次
6 . 某中学同学在做铜与浓硫酸(装置如图)的反应实验时,发现有如下的反应现象:加热初期,铜丝表面变黑;继续加热,有大量气泡产生,品红溶液褪色,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成;再加热,试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多;冷却,静置,将试管中液体倒入另一支盛水试管中,管壁发汤,溶液略带蓝色,将灰白色固体倒入水中,形成蓝色溶液。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的______ 性,NaOH溶液的作用是______ 。
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:______ 。
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:______ 。
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:______ 。溶液的蓝色变浅,灰白色沉淀增多,这现象体现浓硫酸的______ 性。
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有______ 。
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:______ 。
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。

(1)资料:聚四氯乙烯受热分解产生氯化氢,[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,两者混合则成绿色,铜的化合物中CuO、CuS、Cu2S都为黑色,其中CuO溶于盐酸;CuS、Cu2S不溶于稀盐酸,但溶于浓盐酸。该反应中,品红溶液褪色,体现SO2的
该中学同学分成几个小组分别对上述现象探究:
(2)甲组同学查相关文献资料获知:在较低温度(100℃)下,浓硫酸氧化性相对较弱,生成的黑色沉淀为Cu2S,溶液变蓝,但没有气泡产生。请根据文献资料写出反应的化学方程式:
(3)乙组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 现象 | ||
| I组 | 取灼烧后的铜丝 | 溶液变蓝 |
| Ⅱ组 | 直接取其铜丝(表面有聚四氯乙烯薄膜) | 溶液变成墨绿色 |
(4)丙组同学对白雾的成分经检验为H2SO4,请设计实验证明该白雾为硫酸:
(5)丁组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:
滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,溶液呈略黄色[CuCln]2-n(n=1~4)。写出CuS与浓盐酸反应的离子方程式:
最后,丁组同学经过实验论证证明黑色沉淀中除了有CuS、Cu2S,还有S等。
您最近一年使用:0次
7 . 某实验小组对 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。
已知:Ⅰ.
Ⅱ.
回答下列问题:
(1)推测实验Ⅰ中的无色气体为 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到___________ ,将品红试纸在烘箱中低温烘干又观察到___________ 。
(2)推测实验Ⅰ中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ 。
(3)对比实验Ⅰ、Ⅱ,提出假设, 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实物Ⅰ反应的离子方程式为___________ 和 。
。
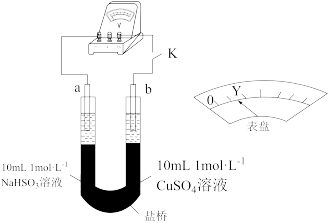
②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管___________ (补全实验操作及现象)。
(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。
实验Ⅲ:
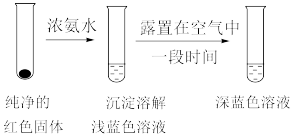
①甲同学认为红色沉淀中含有 ,他判断的理由是
,他判断的理由是___________ 。
②乙同学认为实验Ⅲ不足以证实红色沉淀中含有 ,理由是
,理由是___________ 。
 溶液分别与
溶液分别与 、
、 溶液的反应进行探究。
溶液的反应进行探究。| 实验 | 装置 | 试剂a | 操作及现象 |
| I |   溶液 溶液 |  溶液 溶液 | 加入 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 溶液,得到绿色溶液,30s时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
| Ⅱ |  溶液 溶液 | 加入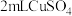 溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
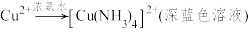
Ⅱ.

回答下列问题:
(1)推测实验Ⅰ中的无色气体为
 ,实验验证:用湿润的品红试纸接近试管口,视察到
,实验验证:用湿润的品红试纸接近试管口,视察到(2)推测实验Ⅰ中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验Ⅰ完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
(3)对比实验Ⅰ、Ⅱ,提出假设,
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实物Ⅰ反应的离子方程式为
 。
。②用以下实验来验证假设合理,装置如图所示。实验方案:闭合K,电压表的指针偏转至“Y”处;向U形管

(4)将实验Ⅱ的溶液静置24h或加热后,得到红色沉淀。经检验,红色沉淀中含有
 、
、 和
和 。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有
。甲、乙两位同学通过实验Ⅲ验证把红色沉淀中含有 和
和 。
。实验Ⅲ:
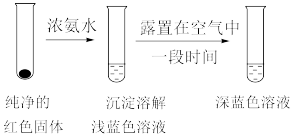
①甲同学认为红色沉淀中含有
 ,他判断的理由是
,他判断的理由是②乙同学认为实验Ⅲ不足以证实红色沉淀中含有
 ,理由是
,理由是
您最近一年使用:0次
解题方法
8 . 最近我国有人报道,将0.1 mol· L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol· L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得浑浊。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数____ ,写出平衡常数表达式______ 。
(2)金属铜和浑浊现象均出现在蛋壳外,这意味着____ 。
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式______ 。
(4)请对此实验结果作一简短评论____ 。
(1)设此装置中发生的是铜离子和硫离子直接相遇的反应,已知
 (Cu2+/Cu)和
(Cu2+/Cu)和 (S/S2-)分别为0.345 V和-0.476V, nF
(S/S2-)分别为0.345 V和-0.476V, nF =RTlnK,
=RTlnK, 表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数
表示反应的标准电动势,n为该反应得失电子数。计算25°C下硫离子和铜离子反应得到铜的反应平衡常数(2)金属铜和浑浊现象均出现在蛋壳外,这意味着
(3)该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式
(4)请对此实验结果作一简短评论
您最近一年使用:0次
9 . 胆矾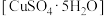 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
(1)B装置中 的作用是
的作用是___________ 。
(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有___________ 气体产生,写出B中发生反应的离子方程式___________ 。
(3)推测D中收集到的气体是___________ ,其检验方法为___________ 。
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。
(5)结合上述实验现象,写出胆矾在 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式____ 。
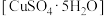 可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在
可做游泳池的消毒剂,其在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在 时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
时隔绝空气加热A,至胆矾分解完全,确定分解产物的成分(试剂均足量)。
(1)B装置中
 的作用是
的作用是(2)实验中,观察到B中有白色沉淀生成,C中无明显变化,可确定产物中一定有
(3)推测D中收集到的气体是
(4)A中固体完全分解后变为红色粉末,某同学设计实验验证固体残留物仅为
 ,而不含
,而不含 ,请帮他完成表中内容。已知:
,请帮他完成表中内容。已知: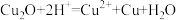 (试剂,仪器和用品自选)。
(试剂,仪器和用品自选)。| 实验步骤 | 实验预期 | 实验结论 |
准确称取 红色固体,加入足量 红色固体,加入足量 | 固体残留物仅为 |
 时隔绝空气加热完全分解的化学方程式
时隔绝空气加热完全分解的化学方程式
您最近一年使用:0次
解题方法
10 . 铝、铁、铜是生活中常见的金属。
(1)铝、铁、铜三种金属都能作导线,是因为它们都具有________ 。
(2)铝在空气中不易被锈蚀,是因为_____________ (用化学方程式表示)。
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、____ 共同作用的结果。
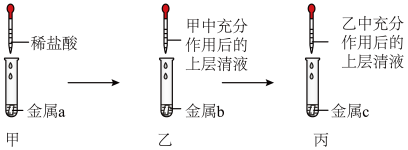
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为______ 时可以验证三种金属活动性强弱,丙试管中反应的化学方程式为________________ 若金属a、b、c依次为铁、铝、铜时,则无法比较___ 和___ 的活动性强弱。

(1)铝、铁、铜三种金属都能作导线,是因为它们都具有
(2)铝在空气中不易被锈蚀,是因为
(3)铜锈的主要成分为碱式碳酸铜[Cu2(OH)2CO3],由此我们可以得到铜生锈是铜和氧气、水、
(4)某同学用如图所示装置,设计实验验证铝、铁、铜三种金属活动性强弱。(每步反应金属均有剩余)
若甲试管中无明显现象,乙试管中的金属b为
您最近一年使用:0次
2020-08-06更新
|
76次组卷
|
2卷引用:开学考试化学试卷03——2020年秋季高一新生入学分班考试化学试卷(全国通用)