解题方法
1 . 氯苯在液氨溶液中可以与氨基钠反应生成苯胺。某研究小组提出了三种可能的机理。经过一系列实验,最终确定该反应按“机理3”进行。
机理1: 机理2:
机理2:
机理3:
A.增加 浓度,反应速率明显变快 浓度,反应速率明显变快 |
| B.存在带负电荷的中间体 |
C.可以发生反应: |
D. 的反应活性:Br>I>Cl>F 的反应活性:Br>I>Cl>F |
您最近一年使用:0次
名校
2 . 一种利用含钴废料(主要成分为 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是
 ,还含有少量
,还含有少量 、
、 、
、 等杂质)制备
等杂质)制备 的工艺流程如下。下列说法错误的是
的工艺流程如下。下列说法错误的是
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 8.5 | 2.2 | 3.4 | 7.8 |
| 完全沉淀[c(金属离子)≤1×10-5mol/L]的pH | 10.0 | 3.0 | 4.5 | 9.4 |
A.“酸浸”时可用 代替 代替 |
B.“调pH”的范围为4.5~7.8,滤液中残留的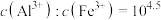 |
| C.气体X可在“调pH”操作单元回收利用 |
D.“高温焙烧”时的化学方程式: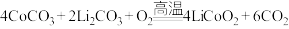 |
您最近一年使用:0次
名校
解题方法
3 . 某温度下,利用 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。
反应I.


反应II.


回答下列问题:
(1)升高温度时,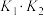 的值将
的值将___________ (填“增大”“减小”或“不变”)。
(2)恒压条件下发生反应I和II,平衡后再充入惰性气体,反应II平衡将___________ 移动(填“正向”“逆向”或“不”)。
(3)阿伦尼乌斯公式为 (其中
(其中 为速率常数,A和R为常数,
为速率常数,A和R为常数, 为反应的活化能,e为自然对数的底,T为温度),反应I的速率方程为
为反应的活化能,e为自然对数的底,T为温度),反应I的速率方程为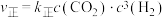 ,
,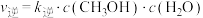 ,增大体系的压强,
,增大体系的压强,
___________ (填“增大”“减小”或“不变”);图中 、
、 是反应I正逆反应
是反应I正逆反应 的图像,表示正反应的
的图像,表示正反应的 关系的是
关系的是___________ (填“ ”或“
”或“ ”)。
”)。

(4)将 和
和 充入密闭容器发生反应I和II,并达到平衡状态。相同温度下,在不同压强下测得
充入密闭容器发生反应I和II,并达到平衡状态。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 的选择性
的选择性 和
和 的选择
的选择 随压强变化曲线如图所示。图中表示
随压强变化曲线如图所示。图中表示 的平衡转化率的曲线是
的平衡转化率的曲线是___________ (填“m”“n”或“p”),A点时 的转化率为
的转化率为___________ 。

(5)在恒压密闭容器中充入 、
、 ,分别在
,分别在 和
和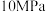 下反应。分析温度对平衡体系中
下反应。分析温度对平衡体系中 、
、 、
、 的影响,设这三种气体物质的量分数之和为1,
的影响,设这三种气体物质的量分数之和为1, 和
和 的物质的量分数(%)与温度变化关系如图:
的物质的量分数(%)与温度变化关系如图:

①表示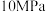 时CO的物质的量分数随温度变化关系的曲线是
时CO的物质的量分数随温度变化关系的曲线是___________ (填标号)。
② ,b、d曲线基本重合的原因
,b、d曲线基本重合的原因___________ 。
③590℃时,反应I的 为
为___________ 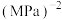 (保留2位有效数字)。
(保留2位有效数字)。
 生产甲醇主要涉及以下反应。
生产甲醇主要涉及以下反应。反应I.



反应II.



回答下列问题:
(1)升高温度时,
 的值将
的值将(2)恒压条件下发生反应I和II,平衡后再充入惰性气体,反应II平衡将
(3)阿伦尼乌斯公式为
 (其中
(其中 为速率常数,A和R为常数,
为速率常数,A和R为常数, 为反应的活化能,e为自然对数的底,T为温度),反应I的速率方程为
为反应的活化能,e为自然对数的底,T为温度),反应I的速率方程为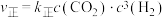 ,
,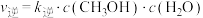 ,增大体系的压强,
,增大体系的压强,
 、
、 是反应I正逆反应
是反应I正逆反应 的图像,表示正反应的
的图像,表示正反应的 关系的是
关系的是 ”或“
”或“ ”)。
”)。
(4)将
 和
和 充入密闭容器发生反应I和II,并达到平衡状态。相同温度下,在不同压强下测得
充入密闭容器发生反应I和II,并达到平衡状态。相同温度下,在不同压强下测得 的平衡转化率、
的平衡转化率、 的选择性
的选择性 和
和 的选择
的选择 随压强变化曲线如图所示。图中表示
随压强变化曲线如图所示。图中表示 的平衡转化率的曲线是
的平衡转化率的曲线是 的转化率为
的转化率为
(5)在恒压密闭容器中充入
 、
、 ,分别在
,分别在 和
和 下反应。分析温度对平衡体系中
下反应。分析温度对平衡体系中 、
、 、
、 的影响,设这三种气体物质的量分数之和为1,
的影响,设这三种气体物质的量分数之和为1, 和
和 的物质的量分数(%)与温度变化关系如图:
的物质的量分数(%)与温度变化关系如图:
①表示
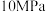 时CO的物质的量分数随温度变化关系的曲线是
时CO的物质的量分数随温度变化关系的曲线是②
 ,b、d曲线基本重合的原因
,b、d曲线基本重合的原因③590℃时,反应I的
 为
为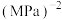 (保留2位有效数字)。
(保留2位有效数字)。
您最近一年使用:0次
2024-02-24更新
|
553次组卷
|
2卷引用:山东省日照市校际联合2023-2024学年高三上学期1月期末考试化学试题
解题方法
4 . 二氧化硫及氮氧化物是大气的主要污染物,为防治环境污染,科研人员做了大量研究。回答下列问题:
(1)氨气催化还原是消除NO的一种方法。
已知:
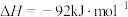

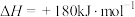

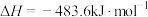
则理论上,每消耗标准状况下22.4L 催化还原NO生成
催化还原NO生成 和
和 时,吸收或释放的能量为
时,吸收或释放的能量为___________  。
。
(2)利用如下装置可有效消除含NO废气、含 废气,同时制备化工产品次磷酸
废气,同时制备化工产品次磷酸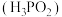 ,实现能量资源综合利用。
,实现能量资源综合利用。 溶液酸性
溶液酸性___________ (填“增强”或“减弱”),多孔石墨b的电极反应式为___________ 。
②乙装置电池反应的化学方程式为___________ 。
③丙装置产品室获得 的原因是
的原因是___________ 。
(3)库伦测硫仪可用于检测煤燃烧释放出的气体中 的含量,进而计算出煤中硫的含量,原理如图所示。检测前,电解质溶液中
的含量,进而计算出煤中硫的含量,原理如图所示。检测前,电解质溶液中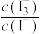 保持定值时,电解池不工作;将待测气体通入电解池后,
保持定值时,电解池不工作;将待测气体通入电解池后, 溶解并将
溶解并将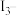 还原,测硫仪便立即工作使
还原,测硫仪便立即工作使 又恢复到原定值,测定结束。
又恢复到原定值,测定结束。 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为___________ 。
②对mg煤样品进行检测时,电解消耗的电荷量为xC,该煤样品中硫元素的含量为___________ (已知电路中每转移1mol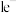 消耗的电荷量为96500C)
消耗的电荷量为96500C)
(1)氨气催化还原是消除NO的一种方法。
已知:

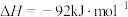

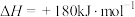

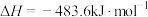
则理论上,每消耗标准状况下22.4L
 催化还原NO生成
催化还原NO生成 和
和 时,吸收或释放的能量为
时,吸收或释放的能量为 。
。(2)利用如下装置可有效消除含NO废气、含
 废气,同时制备化工产品次磷酸
废气,同时制备化工产品次磷酸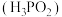 ,实现能量资源综合利用。
,实现能量资源综合利用。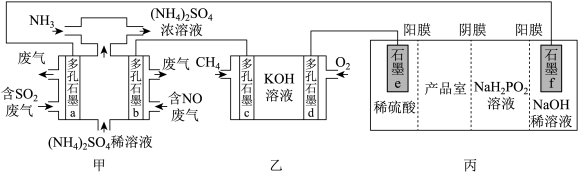
 溶液酸性
溶液酸性②乙装置电池反应的化学方程式为
③丙装置产品室获得
 的原因是
的原因是(3)库伦测硫仪可用于检测煤燃烧释放出的气体中
 的含量,进而计算出煤中硫的含量,原理如图所示。检测前,电解质溶液中
的含量,进而计算出煤中硫的含量,原理如图所示。检测前,电解质溶液中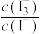 保持定值时,电解池不工作;将待测气体通入电解池后,
保持定值时,电解池不工作;将待测气体通入电解池后, 溶解并将
溶解并将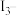 还原,测硫仪便立即工作使
还原,测硫仪便立即工作使 又恢复到原定值,测定结束。
又恢复到原定值,测定结束。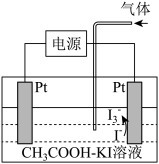
 在电解池中发生反应的离子方程式为
在电解池中发生反应的离子方程式为②对mg煤样品进行检测时,电解消耗的电荷量为xC,该煤样品中硫元素的含量为
 消耗的电荷量为96500C)
消耗的电荷量为96500C)
您最近一年使用:0次
2023高三·全国·专题练习
名校
解题方法
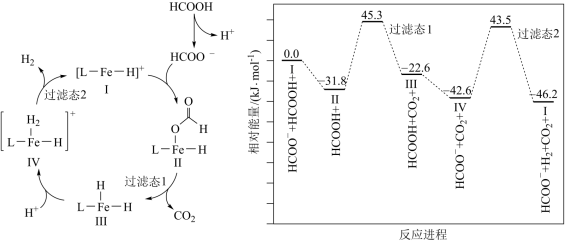
5 . 铁的配合物离子(用[L﹣Fe﹣H]+表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是

下列说法错误的是
A.该过程的总反应为HCOOH CO2↑+H2↑ CO2↑+H2↑ |
| B.H+浓度过大或者过小,均导致反应速率升高 |
| C.该催化循环中Fe元素的化合价发生了变化 |
| D.该过程的总反应速率由Ⅳ→Ⅰ步骤决定 |
您最近一年使用:0次
名校
解题方法
6 . 氢气是一种理想的绿色能源,有科学家预言,氢能将成为人类的主要能源。已知以水为原料通过下列途径均可制得氢气。
(i)太阳光催化分解水:
(ii)焦炭与水反应:
(iii)甲烷与水反应:
(1)反应i中主要的能量转化为___________ ;你认为通过此途径进行 工业化生产的最突出优点是
工业化生产的最突出优点是___________ 。
(2)相同温度压强下,若分别以i、ii反应生成 ,反应ii比i要少吸收
,反应ii比i要少吸收___________ kJ热量;你认为ii反应需要吸热较小的原因可能是___________ (从 角度考虑)。
角度考虑)。
(3)①写出反应的化学平衡常数的表达式:
___________
②一定温度下,iii反应中使用催化剂后,下列物理量能保持不变的有___________ 。
A.焓变 B.反应活化能
B.反应活化能 C.活化分子百分比 D.平衡常数
C.活化分子百分比 D.平衡常数
(4)①利用上述热化学方程式,推测反应
___________  ;
;
②键能也可以用于估算化学反应的反应热( )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:
已知白磷的标准燃烧热为-2378kJ/mol,白磷( )的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中
)的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中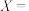
___________ 。

(i)太阳光催化分解水:

(ii)焦炭与水反应:

(iii)甲烷与水反应:

(1)反应i中主要的能量转化为
 工业化生产的最突出优点是
工业化生产的最突出优点是(2)相同温度压强下,若分别以i、ii反应生成
 ,反应ii比i要少吸收
,反应ii比i要少吸收 角度考虑)。
角度考虑)。(3)①写出反应的化学平衡常数的表达式:

②一定温度下,iii反应中使用催化剂后,下列物理量能保持不变的有
A.焓变
 B.反应活化能
B.反应活化能 C.活化分子百分比 D.平衡常数
C.活化分子百分比 D.平衡常数
(4)①利用上述热化学方程式,推测反应

 ;
;②键能也可以用于估算化学反应的反应热(
 )。下表是部分化学键的键能数据:
)。下表是部分化学键的键能数据:| 化学键 | P-P | P-O | O=O | P=O |
键能( ) ) | 172 | 335 | 498 | X |
 )的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中
)的结构为正四面体,白磷完全燃烧的产物结构如图所示,则上表中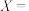

您最近一年使用:0次
2023-11-21更新
|
324次组卷
|
4卷引用:山东省威海市乳山市银滩高级中学2023-2024学年高二上学期1月模块考试化学试题
解题方法
7 . CH3OH是一种绿色燃料,可由CO或CO2制备。工业上制备CH3OH发生如下反应:反应1:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
反应2:CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol
请回答:
(1)CO(g)+2H2(g) CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=___________ kJ/mol。
(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。___________ (填“a”“b”或“c”)。
②随着温度升高,a、b、c三条曲线接近重合的原因是___________ 。
③P点对应的反应2的平衡常数Kp=___________ 。
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是___________ 。__________
 CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.5kJ/mol反应2:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH=+41.2kJ/mol
CO(g)+H2O(g) ΔH=+41.2kJ/mol请回答:
(1)CO(g)+2H2(g)
 CH3OH(g),该反应的ΔH=
CH3OH(g),该反应的ΔH=(2)将CO2和H2按1︰3通入密闭容器中发生反应1和反应2,改变反应温度,分别测得1MPa、3MPa、5MPa下CO2的平衡转化率(α)以及3MPa时生成CH3OH、CO选择性(S)的变化如图甲(选择性为目标产物在总产物中的比率)。

②随着温度升高,a、b、c三条曲线接近重合的原因是
③P点对应的反应2的平衡常数Kp=
④分子筛膜反应器可提高反应1的平衡转化率,原理如图乙所示。分子筛膜反应器可提高转化率的原因是


您最近一年使用:0次
2023-08-25更新
|
458次组卷
|
4卷引用:2024届山东省泰安肥城市高考仿真模拟(一)化学试题
2024届山东省泰安肥城市高考仿真模拟(一)化学试题(已下线)专题10 化学反应原理综合题(浙江专用)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)浙江省 A9 协作体2023-2024学年高三上学期返校联考化学试题(已下线)原理综合题
名校
解题方法
8 . 氨性硫代硫酸盐浸金是一种高效的黄金浸取工艺。
(1)金可在硫代硫酸钠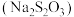 溶液中缓慢溶解:
溶液中缓慢溶解: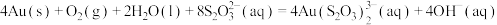 。
。
① 含Au
含Au 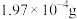 金矿中,加入
金矿中,加入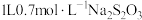 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为___________  。
。
②为提高金的浸出速率,可采取的措施为___________ 。
(2) 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
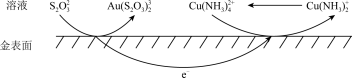
①负极的电极反应式为___________ 。
②正极可能的催化过程如下:
a.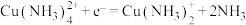
b.___________
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是___________ 。

(3)为研究浸金过程 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向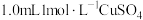 溶液中加入
溶液中加入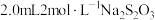 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
ⅰ.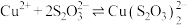 (绿色)
(绿色) 
ⅱ.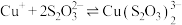 (无色)
(无色) 
ⅲ.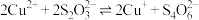

由实验现象可推测:反应ⅰ的速率___________ 反应ⅲ的速率(填“>”或“<”)、
___________  。
。
(4)若采用 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是___________ 。
(1)金可在硫代硫酸钠
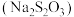 溶液中缓慢溶解:
溶液中缓慢溶解: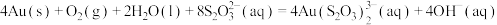 。
。①
 含Au
含Au 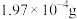 金矿中,加入
金矿中,加入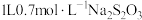 溶液,10小时后,金的浸出率为0.1%,则浸出过程
溶液,10小时后,金的浸出率为0.1%,则浸出过程 的平均消耗速率为
的平均消耗速率为 。
。②为提高金的浸出速率,可采取的措施为
(2)
 可催化金在
可催化金在 溶液中的溶解,其电化学催化腐蚀过程如图所示。
溶液中的溶解,其电化学催化腐蚀过程如图所示。
①负极的电极反应式为
②正极可能的催化过程如下:
a.
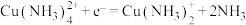
b.
③反应温度对金的浸出率影响如图所示。分析50℃时金浸出率最高的原因是

(3)为研究浸金过程
 与
与 的反应,进行如下实验:向
的反应,进行如下实验:向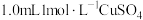 溶液中加入
溶液中加入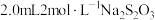 溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:
溶液,溶液从蓝色变为绿色,后逐渐变浅至无色。体系中涉及的反应如下:ⅰ.
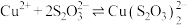 (绿色)
(绿色) 
ⅱ.
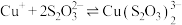 (无色)
(无色) 
ⅲ.
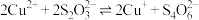

由实验现象可推测:反应ⅰ的速率

 。
。(4)若采用
 催化硫代硫酸盐浸金,催化效果较
催化硫代硫酸盐浸金,催化效果较 差的原因是
差的原因是
您最近一年使用:0次
2023-08-05更新
|
271次组卷
|
5卷引用:山东省泰安第一中学新校区2023-2024学年高二上学期期末模拟考试化学试题
名校
9 . 十九大报告指出:“坚持全民共治、源头防治,持续实施大气污染防治行动,打赢蓝天保卫战 ”,因此研究
”,因此研究 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。
(1)汽车尾气中的 和
和 在一定条件下可发生如下反应:
在一定条件下可发生如下反应:
反应a:
反应b:
① 的燃烧热为
的燃烧热为 ,则
,则
_______ 。
②某科研小组尝试利用固体表面催化工艺进行 的分解。若用
的分解。若用 和
和 分别表示
分别表示 、
、 、
、 和固体催化剂,在固体催化剂表面分解
和固体催化剂,在固体催化剂表面分解 的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
的过程如图所示。从吸附到解吸的过程中,能量状态最低的是_______ (填字母序号)。 、
、 转化的影响。将
转化的影响。将 和
和 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图
的转化率),结果如图 所示。若低于
所示。若低于 ,图
,图 中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为
中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为_______ ; 点是否为对应温度下的平衡脱氮率,说明其理由
点是否为对应温度下的平衡脱氮率,说明其理由_______ 。 作为还原剂脱硝
作为还原剂脱硝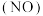 ,脱硝机理如图
,脱硝机理如图 ,则总反应的化学方程式为
,则总反应的化学方程式为_______ 。 温度时在容积为2L的恒容密闭容器中发生反应:
温度时在容积为2L的恒容密闭容器中发生反应:
 ,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中
,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中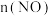 、
、 如下表:
如下表:
 温度时
温度时 =
=______ L∙mol−1。
②若将容器的温度改变为 时其
时其 ,则
,则
_______ (填“ ”“
”“ ”或“
”或“ ”)
”) 。
。
 ”,因此研究
”,因此研究 等大气污染物的处理方法具有重要意义。
等大气污染物的处理方法具有重要意义。(1)汽车尾气中的
 和
和 在一定条件下可发生如下反应:
在一定条件下可发生如下反应:反应a:

反应b:

①
 的燃烧热为
的燃烧热为 ,则
,则
②某科研小组尝试利用固体表面催化工艺进行
 的分解。若用
的分解。若用 和
和 分别表示
分别表示 、
、 、
、 和固体催化剂,在固体催化剂表面分解
和固体催化剂,在固体催化剂表面分解 的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
 、
、 转化的影响。将
转化的影响。将 和
和 以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中
以一定的流速通过两种不同的催化剂进行反应,相同时间内测量逸出气体中 的含量,从而确定尾气脱氮率(脱氮率即
的含量,从而确定尾气脱氮率(脱氮率即 的转化率),结果如图
的转化率),结果如图 所示。若低于
所示。若低于 ,图
,图 中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为
中曲线Ⅰ脱氮率随温度升高而变化不大的主要原因为 点是否为对应温度下的平衡脱氮率,说明其理由
点是否为对应温度下的平衡脱氮率,说明其理由
 作为还原剂脱硝
作为还原剂脱硝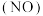 ,脱硝机理如图
,脱硝机理如图 ,则总反应的化学方程式为
,则总反应的化学方程式为
 温度时在容积为2L的恒容密闭容器中发生反应:
温度时在容积为2L的恒容密闭容器中发生反应:
 ,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中
,实验测得:υ(正)=υ(NO)消耗=2υ(O2)消耗=k(正)c2(NO)c(O2),υ(逆)=υ(NO2)消耗=k(逆)c2(NO2),k(正)、k(逆)为速率常数只受温度影响。不同时刻测得容器中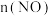 、
、 如下表:
如下表:时间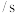 |  |  |  |  |  |
 |  | 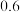 | 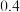 |  |  |
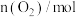 | 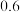 | 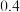 |  |  |  |
 温度时
温度时 =
=②若将容器的温度改变为
 时其
时其 ,则
,则
 ”“
”“ ”或“
”或“ ”)
”) 。
。
您最近一年使用:0次
名校
解题方法
10 . 氢能是极具发展潜力的清洁能源,2021年我国制氢量位居世界第一。请回答:
(1)298K时,1 g 燃烧生成
燃烧生成 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为______ 。
(2)工业上,常用 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:
I.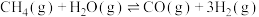
II.
①已知: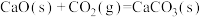
 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是______ 。
②下列操作中,能提高 平衡转化率的是
平衡转化率的是______ (填标号)。
A.加催化剂 B.增加 用量
用量
C.移除 D.恒温恒压,通入惰性气体
D.恒温恒压,通入惰性气体
③500℃、恒压( )条件下,1 mol
)条件下,1 mol  和1 mol
和1 mol  反应达平衡时,
反应达平衡时, 的转化率为0.5,
的转化率为0.5, 的物质的量为0.25 mol,则反应II的平衡常数
的物质的量为0.25 mol,则反应II的平衡常数
______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇: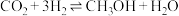 。
。
恒压下, 和
和 的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的
的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的
______ 0,甲醇的产率P点高于T点的原因为______ 。 配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 ,则M元素为
,则M元素为______ (填元素符号):在该化合物中,M离子的价电子排布式为______ 。
(1)298K时,1 g
 燃烧生成
燃烧生成 放热121 kJ,1 mol
放热121 kJ,1 mol  蒸发吸热44kJ,表示
蒸发吸热44kJ,表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为(2)工业上,常用
 与
与 重整制备
重整制备 。500℃时,主要发生下列反应:
。500℃时,主要发生下列反应:I.
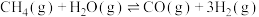
II.

①已知:
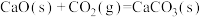
 。向重整反应体系中加入适量多孔CaO,其优点是
。向重整反应体系中加入适量多孔CaO,其优点是②下列操作中,能提高
 平衡转化率的是
平衡转化率的是A.加催化剂 B.增加
 用量
用量 C.移除
 D.恒温恒压,通入惰性气体
D.恒温恒压,通入惰性气体③500℃、恒压(
 )条件下,1 mol
)条件下,1 mol  和1 mol
和1 mol  反应达平衡时,
反应达平衡时, 的转化率为0.5,
的转化率为0.5, 的物质的量为0.25 mol,则反应II的平衡常数
的物质的量为0.25 mol,则反应II的平衡常数
(3)实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点。可用氢气和二氧化碳在催化剂作用下合成甲醇:
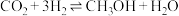 。
。恒压下,
 和
和 的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的
的起始物质的量之比为1∶3时,该反应甲醇的平衡产率随温度的变化如图所示。该反应的

 配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为
配体:四面体中心为硼原子,顶点均为氢原子。若其摩尔质量为 ,则M元素为
,则M元素为
您最近一年使用:0次
2023-03-05更新
|
1044次组卷
|
4卷引用:2024届山东师范大学附属中学高三下学期高考考前模拟化学试题



