解题方法
1 . 含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为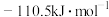 、
、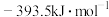 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为___________ 。
(2) 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为___________ 。
(3)汽车尾气中的 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
(4) 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: 、
、 表示,则
表示,则
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的v(逆)___________ z点对应的v(正)。
③若w点的时间为5min,则 的平均反应速率为
的平均反应速率为___________  。此温度下的化学平衡常数为
。此温度下的化学平衡常数为___________ 。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成
 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为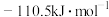 、
、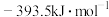 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为(2)
 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示: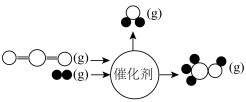
| 化学键 |
|
|
|
|
|
键能/( ) ) | 438 | 326 | 802 | 464 | 414 |
(3)汽车尾气中的
 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。A.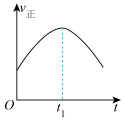 | B.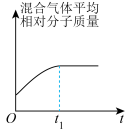 |
C.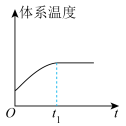 | D.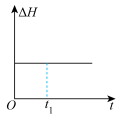 |
 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: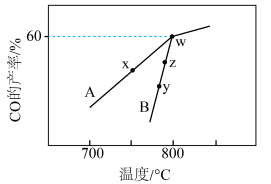
 、
、 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的v(逆)
③若w点的时间为5min,则
 的平均反应速率为
的平均反应速率为 。此温度下的化学平衡常数为
。此温度下的化学平衡常数为
您最近一年使用:0次
名校
2 .  是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。
I二氧化硫在 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。
(1)二氧化硫在 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
①
②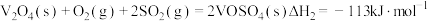
③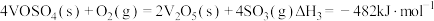
则
_______ 。
(2)硫酸生产中, 催化氧化生成
催化氧化生成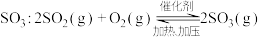 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题: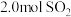 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为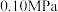 。该反应的平衡常数等于
。该反应的平衡常数等于_______ 。
②平衡状态由A变到B时,平衡常数
_______  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率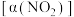 。部分实验结果如图所示:
。部分实验结果如图所示:_______ 。
(4)若A点对应实验中,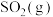 的起始浓度为
的起始浓度为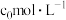 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率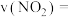
_______  。
。
(5)图中C、D两点对应的实验温度分别为 和
和 ,通过计算判断:
,通过计算判断:
_______  (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。
Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除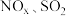 ,同时又变废为宝。
,同时又变废为宝。
(6)写出 转化的电极反应方程式:
转化的电极反应方程式: _______ 。
 。
。 的稀硫酸中,
的稀硫酸中,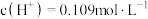 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:_______ (结果保留三位有效数字)。
 是大气的主要污染物。研究消除
是大气的主要污染物。研究消除 的方法和机理一直是环境专家不断追求的目标。
的方法和机理一直是环境专家不断追求的目标。I二氧化硫在
 作用下的催化氧化是工业上生产硫酸的主要反应。
作用下的催化氧化是工业上生产硫酸的主要反应。(1)二氧化硫在
 催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:
催化下氧化是工业上生产硫酸的主要反应,其催化反应的机理如下:①

②
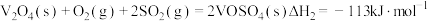
③
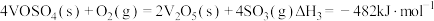
则

(2)硫酸生产中,
 催化氧化生成
催化氧化生成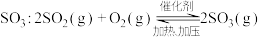 。某温度下,
。某温度下, 的平衡转化率(
的平衡转化率( )与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
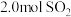 和
和 置于10L密闭容器中,反应达平衡后,体系总压强为
置于10L密闭容器中,反应达平衡后,体系总压强为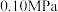 。该反应的平衡常数等于
。该反应的平衡常数等于②平衡状态由A变到B时,平衡常数

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。Ⅱ.二氧化硫在一定条件下可以发生如下反应:
 。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比
。在固定体积的密闭容器中,使用某种催化剂,改变原料气配比 进行多组实验(各组实验的温度可能相同,也可能不同),测定
进行多组实验(各组实验的温度可能相同,也可能不同),测定 的平衡转化率
的平衡转化率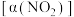 。部分实验结果如图所示:
。部分实验结果如图所示: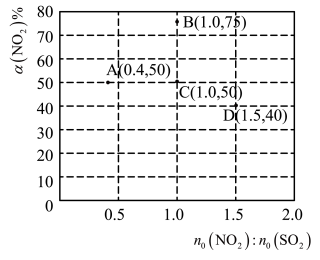
(4)若A点对应实验中,
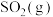 的起始浓度为
的起始浓度为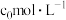 ,经过
,经过 达到平衡状态,则该时段化学反应速率
达到平衡状态,则该时段化学反应速率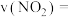
 。
。(5)图中C、D两点对应的实验温度分别为
 和
和 ,通过计算判断:
,通过计算判断:
 (填或“<” “=”或“<”)。
(填或“<” “=”或“<”)。Ⅲ.东南大学化工团队在酸性的条件下,以电化学原理消除
 ,同时又变废为宝。
,同时又变废为宝。(6)写出
 转化的电极反应方程式:
转化的电极反应方程式: 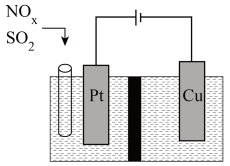

 。
。 的稀硫酸中,
的稀硫酸中,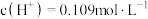 ,求硫酸第二步电离的电离常数:
,求硫酸第二步电离的电离常数:
您最近一年使用:0次
名校
3 . 氯、溴、碘及其化合物在自然界广泛存在且具有重要应用。氯、溴主要存在于海水中,工业常通过电解 饱和溶液制备
饱和溶液制备 ,
, 可用于制取漂白粉、氯化氢(H—H、Cl—Cl、H—Cl的键能分别为
可用于制取漂白粉、氯化氢(H—H、Cl—Cl、H—Cl的键能分别为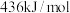 、
、 、
、 )。卤水中
)。卤水中 可通过
可通过 氧化、
氧化、 溶液吸收,
溶液吸收, 能发生水解反应。锂碘电池可供电心脏起搏器,一种
能发生水解反应。锂碘电池可供电心脏起搏器,一种 二次电池正极界面反应机理如图所示。下列化学反应表示错误的是
二次电池正极界面反应机理如图所示。下列化学反应表示错误的是
 饱和溶液制备
饱和溶液制备 ,
, 可用于制取漂白粉、氯化氢(H—H、Cl—Cl、H—Cl的键能分别为
可用于制取漂白粉、氯化氢(H—H、Cl—Cl、H—Cl的键能分别为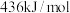 、
、 、
、 )。卤水中
)。卤水中 可通过
可通过 氧化、
氧化、 溶液吸收,
溶液吸收, 能发生水解反应。锂碘电池可供电心脏起搏器,一种
能发生水解反应。锂碘电池可供电心脏起搏器,一种 二次电池正极界面反应机理如图所示。下列化学反应表示错误的是
二次电池正极界面反应机理如图所示。下列化学反应表示错误的是
A. 用 用 溶液吸收: 溶液吸收: |
B. 电池正极放电时的电极反应有: 电池正极放电时的电极反应有: |
C. 与 与 反应: 反应: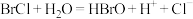 |
D.氯气制氯化氢: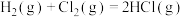  |
您最近一年使用:0次
解题方法
4 . 二甲醚 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下:
 .
.

 .
.

 .
.

回答下列问题:
(1)
___________ 。
(2)向初始温度为T℃的某恒容绝热容器中投入2mol 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。
①下列叙述能说明反应 已经达到平衡的是
已经达到平衡的是___________ (填选项字母)。
a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c. 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率
d. 的体积分数不再发生变化
的体积分数不再发生变化
②相同条件下,若向该容器中加入 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
___________ 1(填“>”“=”或“<”)。
③在催化剂条件下反应 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为___________ (填“第一步”或“第二步”),判断的理由是___________ 。
(3)向压强恒定为p kPa的某密闭容器中按 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。
①图中能表示 随温度变化的曲线是
随温度变化的曲线是___________ (填“ ”或“
”或“ ”),原因为
”),原因为___________ 。
② K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为___________ (保留3位有效数字); K时反应
K时反应 的压强平衡常数
的压强平衡常数
___________  (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
 既是一种有机燃料,又是一种重要的有机化工原料。利用
既是一种有机燃料,又是一种重要的有机化工原料。利用 催化氢化制备二甲醚的反应原理如下:
催化氢化制备二甲醚的反应原理如下: .
.

 .
.

 .
.

回答下列问题:
(1)

(2)向初始温度为T℃的某恒容绝热容器中投入2mol
 只发生反应
只发生反应 ,平衡时
,平衡时 的转化率为
的转化率为 。
。①下列叙述能说明反应
 已经达到平衡的是
已经达到平衡的是a.混合气体密度不再发生变化
b.容器内压强不再发生变化
c.
 的消耗速率等于
的消耗速率等于 的消耗速率
的消耗速率d.
 的体积分数不再发生变化
的体积分数不再发生变化②相同条件下,若向该容器中加入
 和
和 各1mol,平衡时
各1mol,平衡时 的转化率为
的转化率为 。则
。则
③在催化剂条件下反应
 的反应过程如图甲所示,“*”表示吸附在催化剂上。
的反应过程如图甲所示,“*”表示吸附在催化剂上。
该催化过程的决速步骤为
(3)向压强恒定为p kPa的某密闭容器中按
 投入
投入 和
和 ,发生
,发生 催化氢化制备二甲醚系列反应
催化氢化制备二甲醚系列反应 和
和 。
。 平衡转化率
平衡转化率 随温度的变化情况如图乙。
随温度的变化情况如图乙。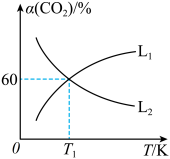
①图中能表示
 随温度变化的曲线是
随温度变化的曲线是 ”或“
”或“ ”),原因为
”),原因为②
 K时,
K时, 的平衡体积分数为10%。则平衡时
的平衡体积分数为10%。则平衡时 的体积分数为
的体积分数为 K时反应
K时反应 的压强平衡常数
的压强平衡常数
 (用含p的代数式表示,列出计算式即可)。
(用含p的代数式表示,列出计算式即可)。
您最近一年使用:0次
7日内更新
|
64次组卷
|
4卷引用:河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题
河南省青桐鸣联考2023-2024学年高二下学期3月月考化学试题2024届陕西省安康市汉滨区高三下学期联考模拟预测(四)理综试题-高中化学(已下线)押题卷01(14+4题型)-2024高考化学考点必杀300题(新高考通用)(已下线)压轴题13?化学反应原理综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
名校
解题方法
5 . 乙炔是合成橡胶、合成纤维和塑料的单体。下列说法错误的是
A.乙炔的空间填充模型为 |
| B.乙炔中所含σ键和π键的数目之比为3:2 |
| C.乙炔和苯具有相同的实验式 |
D.已知反应C2H2(g)+ O2(g)=2CO2(g)+H2O(1) ΔH<0,则该反应反应物的键能总和大于生成物的键能总和 O2(g)=2CO2(g)+H2O(1) ΔH<0,则该反应反应物的键能总和大于生成物的键能总和 |
您最近一年使用:0次
6 . 按要求回答下列问题:
(1)下列变化属于吸热反应的是______ (填序号)。
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤ 固体溶于水
固体溶于水
(2)强酸与强碱的稀溶液发生中和反应生成1mol 时的反应热
时的反应热 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为______ 。(结果保留小数点后一位)
(3)已知1g 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为______ ,试写出该反应的热化学方程式为______ 。
(4)试比较反应热的大小:
①



则
______  (填“>”或“<”,下同)。
(填“>”或“<”,下同)。
②已知常温时红磷比白磷稳定。
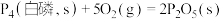

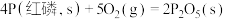

则
______  。
。
(5)已知:25℃、101kPa时,
①

②

③
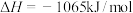
则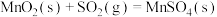

______ 。
(1)下列变化属于吸热反应的是
①钠与冷水的反应 ②氢氧化钡晶体与氯化铵固体的反应 ③蓝矾失水变为白色粉末 ④干冰升华
⑤
 固体溶于水
固体溶于水(2)强酸与强碱的稀溶液发生中和反应生成1mol
 时的反应热
时的反应热 。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为
。若用一定浓度的稀硫酸与含10gNaOH的稀碱溶液完全反应,反应放出的热量为(3)已知1g
 完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为
完全燃烧生成液态水时放出热量142.9kJ,则氢气的燃烧热为(4)试比较反应热的大小:
①




则

 (填“>”或“<”,下同)。
(填“>”或“<”,下同)。②已知常温时红磷比白磷稳定。
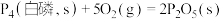

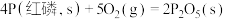

则

 。
。(5)已知:25℃、101kPa时,
①


②


③

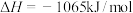
则
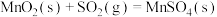

您最近一年使用:0次
7日内更新
|
116次组卷
|
2卷引用:云南省临沧市沧源佤族自治县民族中学2022-2023学年高二上学期第一次月考化学试题
解答题-原理综合题
|
适中(0.65)
|
解题方法
7 . 二氧化碳在工业生产中的综合利用是实现碳中和的重要研究课题。回答下列问题:
(1)合成尿素
已知合成尿素反应为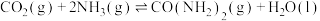
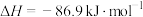 。合成机理及能量变化如图所示(TS表示过渡态):
。合成机理及能量变化如图所示(TS表示过渡态): ,则
,则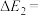
_________  。
。
②在TK时,向恒容密闭容器中充入等体积的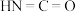 (g)和
(g)和 (g),发生反应。平衡时
(g),发生反应。平衡时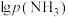 与
与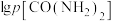 的关系如图所示,其中p为物质的分压(单位为kPa)。
的关系如图所示,其中p为物质的分压(单位为kPa)。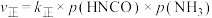 ,
,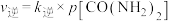 ,则
,则
_________  。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时,
。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时, 的体积分数
的体积分数_________ (填“增大”、“不变”或“减小”)。
(2)合成甲醇
一定温度下,将 (g)和
(g)和 (g)按
(g)按 充入恒容密闭容器中,初始压强
充入恒容密闭容器中,初始压强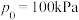 ,发生以下反应:
,发生以下反应:
ⅰ.
ⅱ.
ⅲ.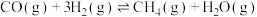
实验测得反应经25min达平衡,此时 ,压强
,压强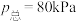 且
且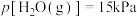 ,则
,则
①平衡时, 的平均分压变化率为
的平均分压变化率为_________  ,
, 转化率为
转化率为_________ 。
②反应ⅱ的压强平衡常数
__________ (以平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)合成尿素
已知合成尿素反应为
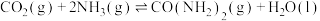
 。合成机理及能量变化如图所示(TS表示过渡态):
。合成机理及能量变化如图所示(TS表示过渡态):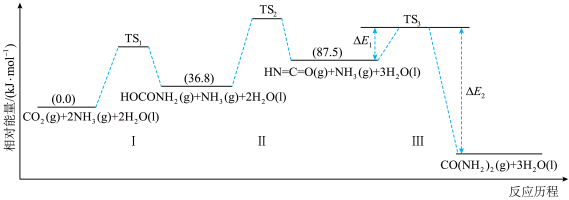
 ,则
,则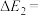
 。
。②在TK时,向恒容密闭容器中充入等体积的
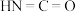 (g)和
(g)和 (g),发生反应。平衡时
(g),发生反应。平衡时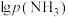 与
与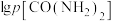 的关系如图所示,其中p为物质的分压(单位为kPa)。
的关系如图所示,其中p为物质的分压(单位为kPa)。
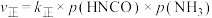 ,
,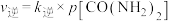 ,则
,则
 。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时,
。M点时继续向该容器中充入少量等体积两种反应物,再次达平衡时, 的体积分数
的体积分数(2)合成甲醇
一定温度下,将
 (g)和
(g)和 (g)按
(g)按 充入恒容密闭容器中,初始压强
充入恒容密闭容器中,初始压强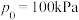 ,发生以下反应:
,发生以下反应:ⅰ.

ⅱ.

ⅲ.
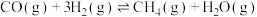
实验测得反应经25min达平衡,此时
 ,压强
,压强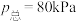 且
且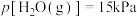 ,则
,则①平衡时,
 的平均分压变化率为
的平均分压变化率为 ,
, 转化率为
转化率为②反应ⅱ的压强平衡常数

您最近一年使用:0次
解题方法
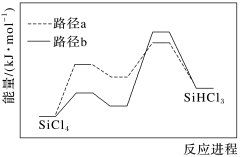
8 . 高纯硅用途广泛,SiHCl3是制备高纯硅的主要原料,制备SiHCl3主要有以下工艺。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是___________ (填“a”或“b”)。 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是___________ (填字母)。
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g) 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1
ⅱ.2SiHCl3(g) SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2
ⅲ.SiHCl3(g)+H2(g) Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3
ⅳ.SiCl4(g)+Si(s)+2H2(g) 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4
(3)ΔH4=___________ (写出代数式)。
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。___________ (填序号)。
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=___________ MPa-1(已知压强平衡常数的表达式为各气体物质的平衡分压替代物质的量浓度,气体的分压等于其物质的量分数乘以总压强)。
Ⅰ.热氢化法:在1200~1400 ℃、0.2~0.4 MPa条件下,H2和SiCl4在热氢化炉内反应。
(1)已知热氢化法制SiHCl3有两种反应路径,反应进程如图所示,该过程更优的路径是
 SiHCl3(g)+H2(g) ΔH<0。
SiHCl3(g)+H2(g) ΔH<0。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.HCl、SiHCl3和H2的物质的量浓度之比为3∶1∶1
B.向体系中充入HCl,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分SiHCl3,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应:
ⅰ.3SiCl4(g)+Si(s)+2H2(g)
 4SiHCl3(g) ΔH1
4SiHCl3(g) ΔH1ⅱ.2SiHCl3(g)
 SiH2Cl2(g)+SiCl4(g) ΔH2
SiH2Cl2(g)+SiCl4(g) ΔH2ⅲ.SiHCl3(g)+H2(g)
 Si(s)+3HCl(g) ΔH3
Si(s)+3HCl(g) ΔH3ⅳ.SiCl4(g)+Si(s)+2H2(g)
 2SiH2Cl2(g) ΔH4
2SiH2Cl2(g) ΔH4(3)ΔH4=
(4)已知反应ⅰ和反应ⅳ的压强平衡常数的负对数随着温度的变化如图所示。
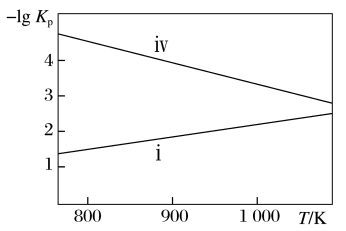
②某温度下,保持压强为12 MPa的某恒压密闭容器中,起始时加入足量Si,通入8 mol SiCl4和6 mol H2,假设只发生反应ⅰ和反应 ⅳ,反应达到平衡后,测得SiCl4转化率为50%,n(SiHCl3)∶n(SiH2Cl2)=2∶1,该温度下的反应ⅰ压强平衡常数Kp=
您最近一年使用:0次
9 . ①H2O(l)=H2(g)+ O2(g) ΔH=+285.8kJ·mol-1
O2(g) ΔH=+285.8kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110.5kJ·mol-1
O2(g)=CO(g) ΔH=-110.5kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是___________ 。(填序号)
(2)H2的燃烧热为___________ 。
(3)燃烧10gH2生成液态水,放出的热量为___________ 。
 O2(g) ΔH=+285.8kJ·mol-1
O2(g) ΔH=+285.8kJ·mol-1②H2(g)+
 O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1③C(s)+
 O2(g)=CO(g) ΔH=-110.5kJ·mol-1
O2(g)=CO(g) ΔH=-110.5kJ·mol-1④C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧10gH2生成液态水,放出的热量为
您最近一年使用:0次
10 . 在25℃、101 kPa下,1g液态甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧热的热化学方程式:___________ 。
您最近一年使用:0次