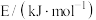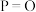1 . 25℃、101kPa时,C3H8和H2组成的混合气体3mol完全燃烧生成CO2气体和液态水共放出2791.6kJ的热量,C3H8、H2的燃烧热分别是2220kJ·mol-1、285.8kJ·mol-1。则混合气体中C3H8、H2的物质的量之比为
| A.1∶2 | B.2∶1 | C.2∶3 | D.3∶1 |
您最近一年使用:0次
2 . 二氧化碳( )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,低碳烯烃 作为基础化工原料,是 加氢转化的主要产品之一、
加氢转化的主要产品之一、
请回答:
(1)以合成 为例,其合成反应为:
为例,其合成反应为:

①已知 的燃烧热为
的燃烧热为 ;
;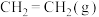 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
___________ (请用 、
、 、
、 表示)
表示)
②该反应在较低温度时能自发进行,可能原因为___________ 。
③在体积为V L的恒容密闭容器中,以 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为___________ , 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为___________ 。 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:
第一步: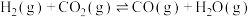

第二步: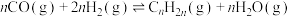

第二步的机理及可能的副反应如图: 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
①下列说法不正确的是___________ 。
A.第一步反应中,在催化剂表面, 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化
B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生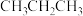 等副产品
等副产品
②在其他条件恒定的情况下,适当降低原料气的流速, 的转化率将
的转化率将___________ (填“增大”或“减小”),原因为___________ ;产物中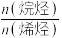 将
将___________ ,原因为___________ 。(结合反应机理中的步骤来回答)
 )的高值化利用是解决全球气候变暖和能源短缺问题的重要举措,
)的高值化利用是解决全球气候变暖和能源短缺问题的重要举措, 加氢转化的主要产品之一、
加氢转化的主要产品之一、请回答:
(1)以合成
 为例,其合成反应为:
为例,其合成反应为:

①已知
 的燃烧热为
的燃烧热为 ;
;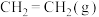 的燃烧热为
的燃烧热为 ;
; 的热效应为
的热效应为 ,则
,则
 、
、 、
、 表示)
表示)②该反应在较低温度时能自发进行,可能原因为
③在体积为V L的恒容密闭容器中,以
 的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为
的投料比发生上述反应,不同温度下平衡时的四种气态物质的物质的量如图所示,a曲线代表的物质为 温度下该反应的平衡常数
温度下该反应的平衡常数 为
为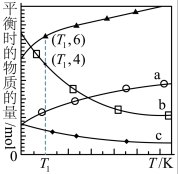
 加氢制低碳烯烃主要包含以下两步反应:
加氢制低碳烯烃主要包含以下两步反应:第一步:
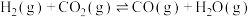

第二步:
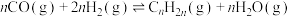

第二步的机理及可能的副反应如图:
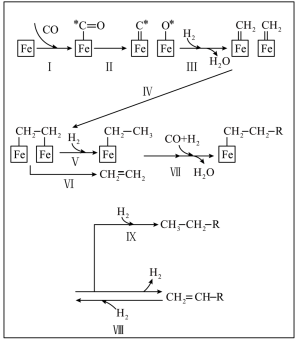
 的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol
的第一电离能为1330kJ/mol,第一电子亲和能(基态的气态分子得到一个电子形成-1价气态阴离子时所放出的能量)为3665kJ/mol①下列说法不正确的是
A.第一步反应中,在催化剂表面,
 倾向于通过给出电子的方式进行活化
倾向于通过给出电子的方式进行活化B.Fe基催化剂的反应活性位点间不宜相距太远,否则不利于碳链的增长
C.Fe基催化剂对C原子吸附能力越强,越有利提高短链烯烃的比例
D.该过程中可能产生
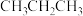 等副产品
等副产品②在其他条件恒定的情况下,适当降低原料气的流速,
 的转化率将
的转化率将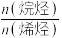 将
将
您最近一年使用:0次
名校
3 . Ⅰ.设 为分压平衡常数(用分压代替浓度,气体分压
为分压平衡常数(用分压代替浓度,气体分压 总压
总压 该组分的物质的量分数),50℃、101kPa下,将足量的
该组分的物质的量分数),50℃、101kPa下,将足量的 、
、 置于一个密闭容器中,再充入已除去
置于一个密闭容器中,再充入已除去 的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为
的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为 。
。
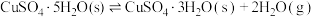
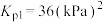
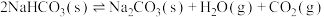

(1)①平衡时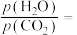
___________ ,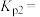
___________ 。
②平衡后,用总压为101kPa的潮湿空气[其中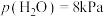 、
、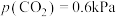 ]替换容器中的气体,50℃下达到新平衡。容器内,
]替换容器中的气体,50℃下达到新平衡。容器内, 质量将
质量将___________ (填“增加”“减少”或“不变”)。
Ⅱ.反应中产生的 可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。
可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是___________ 。
Ⅲ. 还可以通过催化加氢制甲醇,其总反应可表示为:
还可以通过催化加氢制甲醇,其总反应可表示为: 。向另一恒容密闭容器中按
。向另一恒容密闭容器中按 和
和 物质的量的比为
物质的量的比为 投料,在有催化剂的密闭容器中进行以下反应:
投料,在有催化剂的密闭容器中进行以下反应:
主反应:
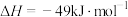
副反应:

测得 平衡转化率、和CO选择性[转化的
平衡转化率、和CO选择性[转化的 中生成或CO的百分比,如:选择性
中生成或CO的百分比,如:选择性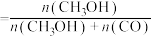 ]随温度、压强变化情况分别如图2、图3所示:
]随温度、压强变化情况分别如图2、图3所示: 的平衡转化率增大,而
的平衡转化率增大,而 的选择性降低。分析其原因:
的选择性降低。分析其原因:___________ 。
②图3中,温度 时,三条曲线几乎交于一点,分析其原因:
时,三条曲线几乎交于一点,分析其原因:___________ 。
(4)合成的甲醇可利用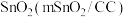 和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。
和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。___________ 。
②若有1mol 通过质子交换膜时,则该装置生成
通过质子交换膜时,则该装置生成 和HCOOH共计
和HCOOH共计___________ mol。
 为分压平衡常数(用分压代替浓度,气体分压
为分压平衡常数(用分压代替浓度,气体分压 总压
总压 该组分的物质的量分数),50℃、101kPa下,将足量的
该组分的物质的量分数),50℃、101kPa下,将足量的 、
、 置于一个密闭容器中,再充入已除去
置于一个密闭容器中,再充入已除去 的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为
的干燥空气。假设只发生如下反应,已知达平衡时两者分解的物质的量比为 。
。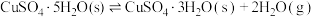
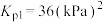
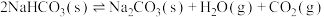

(1)①平衡时
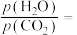
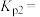
②平衡后,用总压为101kPa的潮湿空气[其中
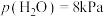 、
、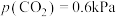 ]替换容器中的气体,50℃下达到新平衡。容器内,
]替换容器中的气体,50℃下达到新平衡。容器内, 质量将
质量将Ⅱ.反应中产生的
 可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。
可以以Bi为电极,在酸性水溶液中实现电催化还原,两种途径的反应机理如图1所示,其中TS表示过渡态、数字表示微粒的相对总能量。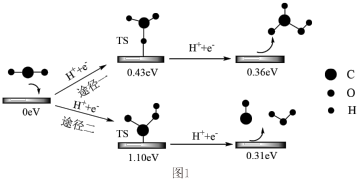
 电还原的选择性以途径一为主,理由是
电还原的选择性以途径一为主,理由是Ⅲ.
 还可以通过催化加氢制甲醇,其总反应可表示为:
还可以通过催化加氢制甲醇,其总反应可表示为: 。向另一恒容密闭容器中按
。向另一恒容密闭容器中按 和
和 物质的量的比为
物质的量的比为 投料,在有催化剂的密闭容器中进行以下反应:
投料,在有催化剂的密闭容器中进行以下反应:主反应:

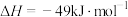
副反应:


测得
 平衡转化率、和CO选择性[转化的
平衡转化率、和CO选择性[转化的 中生成或CO的百分比,如:选择性
中生成或CO的百分比,如:选择性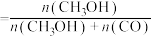 ]随温度、压强变化情况分别如图2、图3所示:
]随温度、压强变化情况分别如图2、图3所示: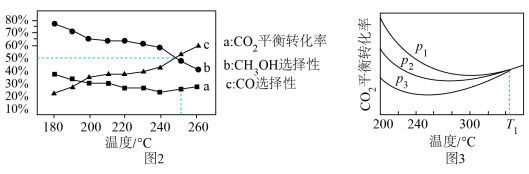
 的平衡转化率增大,而
的平衡转化率增大,而 的选择性降低。分析其原因:
的选择性降低。分析其原因:②图3中,温度
 时,三条曲线几乎交于一点,分析其原因:
时,三条曲线几乎交于一点,分析其原因:(4)合成的甲醇可利用
 和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。
和CuO纳米片(CuONS/CF)作催化电极,进一步制备甲酸(甲酸盐),其电化学装置的工作原理如下图所示。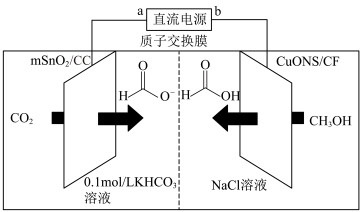
②若有1mol
 通过质子交换膜时,则该装置生成
通过质子交换膜时,则该装置生成 和HCOOH共计
和HCOOH共计
您最近一年使用:0次
4 . 甲基叔戊基醚(TAME,简写为T)常用作汽油添加剂,在催化剂作用下,通过甲醇与A(与B互为同分异构体)的液相反应制得,体系中主要发生反应i~iii.研究表明,用不同浓度的磷钼酸浸渍催化剂,浓度越大,催化剂活性越好。用1%、2%、3%的磷钼酸浸渍催化剂分别进行实验,得到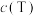 随时间t的变化曲线如图所示。下列有关说法不正确的是
随时间t的变化曲线如图所示。下列有关说法不正确的是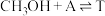

反应ii:
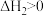
反应iii:
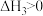
 随时间t的变化曲线如图所示。下列有关说法不正确的是
随时间t的变化曲线如图所示。下列有关说法不正确的是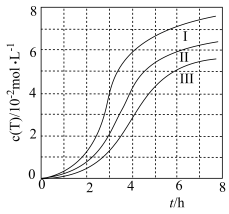
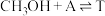

反应ii:

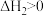
反应iii:

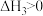
A. |
| B.三组实验中,在2~4h内,反应速率最快 |
C.用3%的磷钼酸浸渍时,在4~6h内,T的平均生成速率为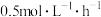 |
D.平衡后加入惰性溶剂四氢呋喃稀释, 减小 减小 |
您最近一年使用:0次
名校
解题方法
5 . 工业合成氮是人类科学技术的一项重大突破,目前已有三位科学家因其获得诺贝尔奖,已知反应为
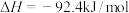 ,
,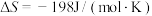 ,该反应的焓变和熵变随温度变化很小,可视为常数。
,该反应的焓变和熵变随温度变化很小,可视为常数。
查阅文献资料,化学键的键能如下表:
1.合成氨反应中若断裂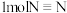 键则生成
键则生成_______ 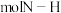 键,试推测N-H键的键能为
键,试推测N-H键的键能为_______  (保留到小数点后一位)
(保留到小数点后一位)
又已知: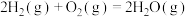
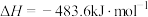 ,
,
2.氨气完全燃烧生成 和
和 的热化学方程式为:
的热化学方程式为:_______ 。
3.请通过计算判断常温(25℃)下,合成氨反应是否能够自发进行_______ ,室温下推动该反应自发进行的主要因素是_______ (填“焓变”或“熵变”)
4.在一定恒容密闭容器中,将一定量的氢气和氮气通入发生合成氨反应,下列情况可说明反应已经达到化学平衡状态的是 。
5.合成氨的平衡常数表达式
_______ 。若温度升高,K值将_______ (填写“升高”、“降低”或“不变”)

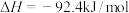 ,
,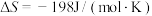 ,该反应的焓变和熵变随温度变化很小,可视为常数。
,该反应的焓变和熵变随温度变化很小,可视为常数。查阅文献资料,化学键的键能如下表:
化学键 |
|
|
| 436 | 946 |
1.合成氨反应中若断裂
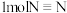 键则生成
键则生成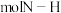 键,试推测N-H键的键能为
键,试推测N-H键的键能为 (保留到小数点后一位)
(保留到小数点后一位)又已知:
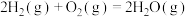
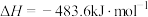 ,
,2.氨气完全燃烧生成
 和
和 的热化学方程式为:
的热化学方程式为:3.请通过计算判断常温(25℃)下,合成氨反应是否能够自发进行
4.在一定恒容密闭容器中,将一定量的氢气和氮气通入发生合成氨反应,下列情况可说明反应已经达到化学平衡状态的是 。
A.断裂 键的同时断裂 键的同时断裂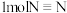 键 键 |
B.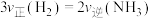 |
C. 、 、 和 和 的物质的量浓度之比为 的物质的量浓度之比为 |
| D.混合气体的平均摩尔质量不再改变 |

您最近一年使用:0次
名校
解题方法
6 . 填空题
(1)下表是部分化学键的键能参数:
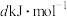 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
________ kJ·mol-1(用含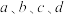 的代数式表示)
的代数式表示)
(2)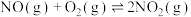 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:
①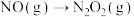
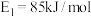
②
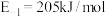
③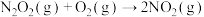
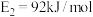
④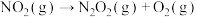
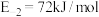
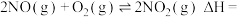
________ 。
(3)已知在 和
和 条件下,有如下反应:①
条件下,有如下反应:①
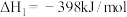
②
 ,若反应
,若反应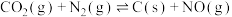 的活化能为
的活化能为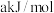 ,则反应
,则反应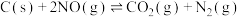 的活化能为
的活化能为________ 。
(4)已知充分燃烧乙炔 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量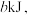 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为____________________ 。
(5)I.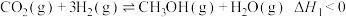
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的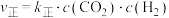 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为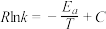 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
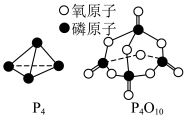
________  (用含
(用含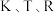 的代数式表示)。
的代数式表示)。
(1)下表是部分化学键的键能参数:
化学键 |
|
|
|
|
键能 |
|
|
|
|
 ,白磷及其完全燃烧的产物的结构如图所示,则表中
,白磷及其完全燃烧的产物的结构如图所示,则表中
 的代数式表示)
的代数式表示)(2)
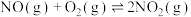 的反应机理和各基元反应的活化能为:
的反应机理和各基元反应的活化能为:①
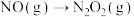
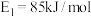
②

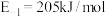
③
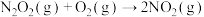
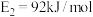
④
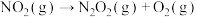
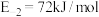
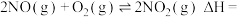
(3)已知在
 和
和 条件下,有如下反应:①
条件下,有如下反应:①
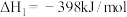
②

 ,若反应
,若反应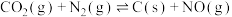 的活化能为
的活化能为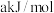 ,则反应
,则反应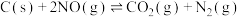 的活化能为
的活化能为(4)已知充分燃烧乙炔
 气体时,生成
气体时,生成 二氧化碳气体并生成液态水,放出热量
二氧化碳气体并生成液态水,放出热量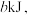 表示乙炔燃烧热的热化学方程式为
表示乙炔燃烧热的热化学方程式为(5)I.
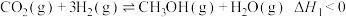
II.CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2>0
由实验测得该反应II的
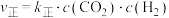 ,
, ,Arrhenius经验公式为
,Arrhenius经验公式为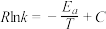 ,其中为
,其中为 活化能,
活化能, 为热力学温度,
为热力学温度, 、
、 、
、 为速率常数,
为速率常数, 和
和 为常数。则
为常数。则
 (用含
(用含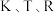 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
7 .  甲烷化反应可将
甲烷化反应可将 直接转化为能源气体,具有较高的学术研究价值和工业化前景。反应原理:
直接转化为能源气体,具有较高的学术研究价值和工业化前景。反应原理: (正反应为放热反应)。
(正反应为放热反应)。 时在容积为
时在容积为 的密闭容器中,加入
的密闭容器中,加入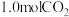 与
与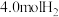 发生上述反应,记录数据如下表:
发生上述反应,记录数据如下表:
1.上述反应中,反应物总能量_______ 生成物总能量。
A.大于 B.小于 C.等于
2.能说明上述反应达到化学平衡状态的标志是_______ 。
A.
B.容器中气体总质量不再变化
C.容器中 与
与 的物质的量之和不再变化
的物质的量之和不再变化
3.上表中
_______ 。
4.分析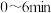 正反应速率的变化趋势并说明理由
正反应速率的变化趋势并说明理由_______ 。
 甲烷化反应可将
甲烷化反应可将 直接转化为能源气体,具有较高的学术研究价值和工业化前景。反应原理:
直接转化为能源气体,具有较高的学术研究价值和工业化前景。反应原理: (正反应为放热反应)。
(正反应为放热反应)。 时在容积为
时在容积为 的密闭容器中,加入
的密闭容器中,加入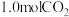 与
与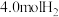 发生上述反应,记录数据如下表:
发生上述反应,记录数据如下表: 物质的量 时间  |
|
|
|
|
0 | 1.0 | 4.0 | 0 | 0 |
2 | 0.35 | 1.4 | 0.65 | 1.3 |
4 | 0.05 | x | 0.95 | 1.9 |
6 | 0.05 | x | 0.95 | 1.9 |
A.大于 B.小于 C.等于
2.能说明上述反应达到化学平衡状态的标志是
A.

B.容器中气体总质量不再变化
C.容器中
 与
与 的物质的量之和不再变化
的物质的量之和不再变化3.上表中

4.分析
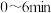 正反应速率的变化趋势并说明理由
正反应速率的变化趋势并说明理由
您最近一年使用:0次
名校
8 . 氮的单质及其化合物的综合利用是目前社会普遍关注的热点之一。
(1)基态N原子核外电子有___________ 种空间运动状态。
(2)已知工业合成氨反应:
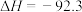 kJ/mol;合成氨反应在
kJ/mol;合成氨反应在___________ (填“高温”或“低温”)条件下更有利于自发进行。
(3)在恒温恒容条件下,投入等物质的量的 和
和 合成氨气,下列情况表明该反应达到平衡状态的是___________(填字母)。
合成氨气,下列情况表明该反应达到平衡状态的是___________(填字母)。
(4)在体积均为2 L的甲、乙两恒容密闭容器中分别通入1 mol 和3 mol
和3 mol ,分别在不同条件下达到平衡,测得
,分别在不同条件下达到平衡,测得 的物质的量与时间的关系如下图所示。
的物质的量与时间的关系如下图所示。___________ ,正反应速率a___________ (填“>”、“<”或“=”)b。
②在该条件下,乙的平衡常数为___________ (结果保留2位小数)。
(5)氨催化氧化是硝酸工业的基础,在钒催化作用下,只发生主反应 和副反应
和副反应 :
:
 .
.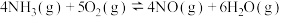

 .
.
 kJ/mol
kJ/mol
已知:
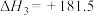 kJ/mol,则
kJ/mol,则
___________ kJ/mol。
(1)基态N原子核外电子有
(2)已知工业合成氨反应:

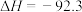 kJ/mol;合成氨反应在
kJ/mol;合成氨反应在(3)在恒温恒容条件下,投入等物质的量的
 和
和 合成氨气,下列情况表明该反应达到平衡状态的是___________(填字母)。
合成氨气,下列情况表明该反应达到平衡状态的是___________(填字母)。| A.混合气体的密度不随时间变化 | B. 的体积分数不随时间变化 的体积分数不随时间变化 |
| C.混合气体的总压强不随时间变化 | D. 的消耗速率与 的消耗速率与 的消耗速率之比为3∶2 的消耗速率之比为3∶2 |
 和3 mol
和3 mol ,分别在不同条件下达到平衡,测得
,分别在不同条件下达到平衡,测得 的物质的量与时间的关系如下图所示。
的物质的量与时间的关系如下图所示。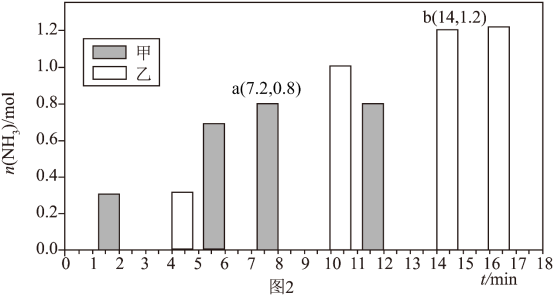
②在该条件下,乙的平衡常数为
(5)氨催化氧化是硝酸工业的基础,在钒催化作用下,只发生主反应
 和副反应
和副反应 :
: .
.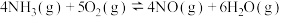

 .
.
 kJ/mol
kJ/mol已知:

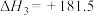 kJ/mol,则
kJ/mol,则
您最近一年使用:0次
名校
解题方法
9 . 为实现碳中和目标, 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。
Ⅰ. 的捕集
的捕集
用乙醇胺(简写为 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有:
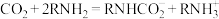

请回答:
(1)可以用测定溶液pH变化测定 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是___________ 。
(2)常温下用 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下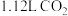 后,测得溶液中
后,测得溶液中 ,则
,则
___________ 。
Ⅱ. 的转化
的转化
二氧化碳可通过催化加氢制甲醇,
反应可表示为: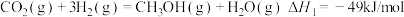 ①
①
同时发生反应: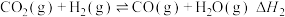 ②
②
(3)已知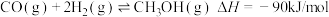 ;则
;则
___________ kJ/mol
(4)恒压密闭容器中,加入2mol 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。
(5)恒压下, 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线___________ 。 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为___________ 。
 的捕集和转化并实现资源再利用意义重大。
的捕集和转化并实现资源再利用意义重大。Ⅰ.
 的捕集
的捕集用乙醇胺(简写为
 )溶液能有效吸收
)溶液能有效吸收 ,相关反应有:
,相关反应有: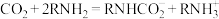

请回答:
(1)可以用测定溶液pH变化测定
 吸收速率,其原理(忽略电离速率,结合相关反应解释)是
吸收速率,其原理(忽略电离速率,结合相关反应解释)是(2)常温下用
 乙醇胺溶液吸收标准状况下
乙醇胺溶液吸收标准状况下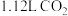 后,测得溶液中
后,测得溶液中 ,则
,则
Ⅱ.
 的转化
的转化二氧化碳可通过催化加氢制甲醇,
反应可表示为:
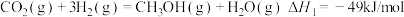 ①
①同时发生反应:
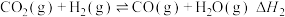 ②
②(3)已知
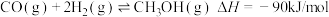 ;则
;则
(4)恒压密闭容器中,加入2mol
 和4mol
和4mol ,发生反应①和②,下列说法正确的是___________。
,发生反应①和②,下列说法正确的是___________。| A.容器内气体的平均摩尔质量不再变化,说明体系内反应达到平衡 |
B.温度升高, 的平衡转化率不一定下降 的平衡转化率不一定下降 |
C.及时将 与反应混合物分离,可提高反应①的速率和甲醇的产率 与反应混合物分离,可提高反应①的速率和甲醇的产率 |
D.平衡后将容器的容积压缩至一半,新平衡的 变小 变小 |
(5)恒压下,
 和
和 以物质的量比
以物质的量比 投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出
投料合成甲醇(假设只发生反应①),在有分子筛膜时甲醇的产率随温度的变化如图所示,其中分子筛膜能选择性分离出 。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线
。请在图中画出无分子筛膜时甲醇的平衡产率随温度的变化曲线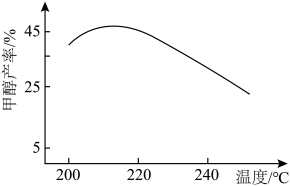
 通过电化学转化可用于生产其他有机物。
通过电化学转化可用于生产其他有机物。 能在酸性水溶液中通过电催化发生电解,生成
能在酸性水溶液中通过电催化发生电解,生成 。其阴极反应式为
。其阴极反应式为
您最近一年使用:0次
名校
解题方法
10 . 火箭发射时可以用肼( )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: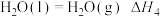 。
。
(1)由图可知,
______ (填“ ”或“
”或“ ”)0,理由为
”)0,理由为_____________ 。
(2)基态氮原子的电子排布式为______ 。
(3)0.1mol 分子中含有
分子中含有______ mol极性共价键, 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为______ 。
(4) 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为______ 。
(5)稳定性:
______ (填“ ”或“
”或“ ”)
”) 。
。
(6)由图可知,每转移0.2mol电子,消耗 的体积为
的体积为______ L(标准状况下)。
(7)表示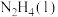 燃烧热的热化学方程式为
燃烧热的热化学方程式为______________ (焓变用含 和
和 的代数式表示)。
的代数式表示)。
 )作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题:
)作为燃料,其燃烧过程中的能量变化如图所示。回答下列问题: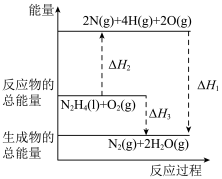
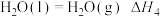 。
。(1)由图可知,

 ”或“
”或“ ”)0,理由为
”)0,理由为(2)基态氮原子的电子排布式为
(3)0.1mol
 分子中含有
分子中含有 分子中氮原子的杂化方式为
分子中氮原子的杂化方式为(4)
 分子中,
分子中, 键和
键和 键的数目之比为
键的数目之比为(5)稳定性:

 ”或“
”或“ ”)
”) 。
。(6)由图可知,每转移0.2mol电子,消耗
 的体积为
的体积为(7)表示
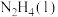 燃烧热的热化学方程式为
燃烧热的热化学方程式为 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次

 键
键 键
键