1 . 回答下列问题。
(1)甲醛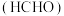 是一种重要的化工产品,可利用甲醇
是一种重要的化工产品,可利用甲醇 催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。___________ (填“吸热”或“放热”)反应。
(2)在 、
、 下,
下,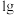 甲醇
甲醇 燃烧生成
燃烧生成 和液态水时放热
和液态水时放热 。则表示甲醇燃烧热的热化学方程式为:
。则表示甲醇燃烧热的热化学方程式为:___________ 。
(3)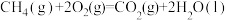
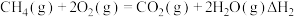 ;
;
则
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(4)已知拆开 键、
键、 键、
键、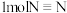 键分别需要的能量是
键分别需要的能量是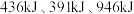 ,则
,则 与
与 反应生成
反应生成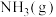 的热化学方程式为:
的热化学方程式为:___________ 。
(5)白磷与氧可发生如下反应: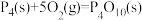 。已知断裂下列化学键需要吸收的能量分别为如图。
。已知断裂下列化学键需要吸收的能量分别为如图。

___________ 。
(6)肼可作为火箭发动机的燃料,与氧化剂 反应生成
反应生成 和水蒸气。
和水蒸气。
已知:① ;
;
②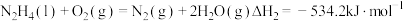 ;
;
写出肼和 反应的热化学方程式
反应的热化学方程式___________ 。
(1)甲醛
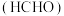 是一种重要的化工产品,可利用甲醇
是一种重要的化工产品,可利用甲醇 催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。
催化脱氢制备。甲醛与气态甲醇转化的能量关系如图所示。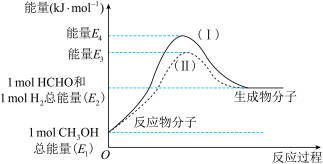
(2)在
 、
、 下,
下, 甲醇
甲醇 燃烧生成
燃烧生成 和液态水时放热
和液态水时放热 。则表示甲醇燃烧热的热化学方程式为:
。则表示甲醇燃烧热的热化学方程式为:(3)
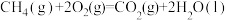
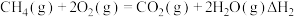 ;
;则

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(4)已知拆开
 键、
键、 键、
键、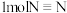 键分别需要的能量是
键分别需要的能量是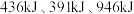 ,则
,则 与
与 反应生成
反应生成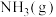 的热化学方程式为:
的热化学方程式为:(5)白磷与氧可发生如下反应:
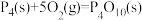 。已知断裂下列化学键需要吸收的能量分别为如图。
。已知断裂下列化学键需要吸收的能量分别为如图。| 化学键 |  |  | 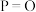 |  |  |
键能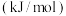 |  |  |  |  |  |
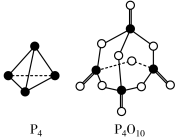

(6)肼可作为火箭发动机的燃料,与氧化剂
 反应生成
反应生成 和水蒸气。
和水蒸气。已知:①
 ;
;②
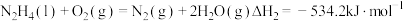 ;
;写出肼和
 反应的热化学方程式
反应的热化学方程式
您最近一年使用:0次
2 . 将CO2转化为有机碳酸酯CH3OCOOCH3(g)(DMC),可有效减少碳排放。CO2转化为DMC的总反应为3CO2(g)+6H2(g) CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
Ⅰ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) K1。
CH3OH(g)+H2O(g) K1。
Ⅱ.CO2(g)+2CH3OH(g) CH3OCOOCH3(g)+H2O(g) K2。
CH3OCOOCH3(g)+H2O(g) K2。
请回答下列问题:
(1)CH3OCOOCH3的名称为_______ ,1molCH3OH中含有的σ键类型为_______ 。
(2)反应的反应机理如图所示。_______ ,该物质还有另一个作用是提高DMC的平衡产率,结合反应机理图分析其中的原因:_______ 。
(3)一定温度范围内lgK-T的线性关系如图。_______ (填“>”或“<”)E逆。
②K总=K2时,该温度下K1=_______ 。某温度下,在5L恒容密闭容器中充入5molCO2和10molH2,发生反应Ⅰ、Ⅱ,反应经10min达到平衡,此时n(CH3OCOOCH3)=1mol,n(CH3OH)=1mol,则K2=_______ 。
 CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:
CH3OCOOCH3(g)+3H2O(g) K总,可通过I、Ⅱ两步反应完成:Ⅰ.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) K1。
CH3OH(g)+H2O(g) K1。Ⅱ.CO2(g)+2CH3OH(g)
 CH3OCOOCH3(g)+H2O(g) K2。
CH3OCOOCH3(g)+H2O(g) K2。请回答下列问题:
(1)CH3OCOOCH3的名称为
(2)反应的反应机理如图所示。
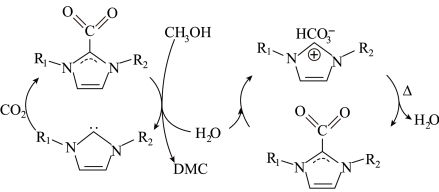
(3)一定温度范围内lgK-T的线性关系如图。
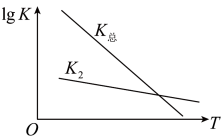
②K总=K2时,该温度下K1=
您最近一年使用:0次
3 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一、该重整反应体系主要涉及以下反应:
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=___________ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
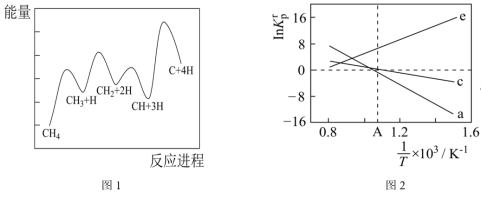
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分___________ 步进行,其中,第___________ 步的正反应活化能最大。 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。
①反应a、c、e中,属于吸热反应的有___________ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=___________ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:___________ 。
a) CH4(g)+CO2(g) ⇌ 2CO(g)+2H2(g) ∆H1
b) CO2(g)+H2(g) ⇌ CO(g)+H2O(g) ∆H2
c) CH4(g) ⇌ C(s)+2H2(g) ∆H3
d) 2CO(g) ⇌ CO2(g)+C(s) ∆H4
e) CO(g)+H2(g) ⇌ H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有___________。
| A.增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加 |
| B.移去部分C(s),反应c、d、e的平衡均向右移动 |
| C.加入反应a的催化剂,可提高CH4的平衡转化率 |
| D.降低反应温度,反应a~e的正、逆反应速率都减小 |
(3)一定条件下,CH4分解形成碳的反应历程如图1所示。该历程分
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图2所示。
(温度的倒数)的变化如图2所示。①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
解题方法
4 . 硅和碳及其化合物多是新型无机非金属材料。
(1)金刚石属于___________ 晶体,C₆₀属于___________ 晶体,它们都是碳元素的___________ 。
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以C₆₀为代表,结构如下图。
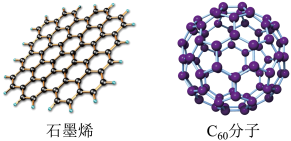
从石墨中剥离得到石墨烯需克服的作用是___________ ;在石墨烯中,每个六元环占有___________ 个C原子。
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):___________ 。
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与 Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:___________ 。
(5)已知化学键的键能数据如下表:
已知反应热:△H=反应物的总键能之和-生成物的总键能之和。则反应 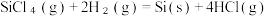 )的△H=
)的△H=___________ kJ/mol。
(1)金刚石属于
(2)石墨烯是只由一层碳原子所构成的平面薄膜,富勒烯以C₆₀为代表,结构如下图。

从石墨中剥离得到石墨烯需克服的作用是
(3)碳化硅(化学式:SiC)与晶体硅(化学式:Si)和金刚石(化学式:C)相比较,三者熔点从高到低的顺序(用化学式和“>”表示):
(4)氮化硅是一种高温陶瓷材料,已知氮化硅的晶体结构中,原子间都以单键相连,且N原子和N原子,Si原子与 Si原子不直接相连,同时每个原子都满足8电子稳定结构,请写出氮化硅的化学式:
(5)已知化学键的键能数据如下表:
| 化学键 | Si-Cl | H-H | H-Cl | Si-Si |
| 键能 kJ/mol | 360 | 436 | 431 | 176 |
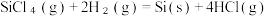 )的△H=
)的△H=
您最近一年使用:0次
名校
解题方法
5 . 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料。已知:
CH3OH(1)+O2(g)=CO(g)+2H2O(g) ΔH1=﹣443.64kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=﹣566.0kJ•mol﹣1
下列说法或热化学方程式正确的是
CH3OH(1)+O2(g)=CO(g)+2H2O(g) ΔH1=﹣443.64kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g) ΔH2=﹣566.0kJ•mol﹣1
下列说法或热化学方程式正确的是
| A.CO的燃烧热为﹣566.0kJ•mol﹣1 |
| B.2molCO和1molO2的总能量比2molCO2的总能量低 |
| C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ |
| D.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) ΔH=﹣1453.28kJ•mol﹣1 |
您最近一年使用:0次
名校
6 . 丙烯是重要的有机原料之一,可通过多种途径制备。回答下列问题:
Ⅰ.由丙烷直接脱氢法制备: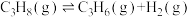

(1)已知键能: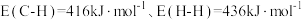 ;生成
;生成 碳碳
碳碳 键放出的能量为
键放出的能量为 ,则
,则
________  。
。
(2)在一定温度下,保持总压为 ,将
,将 和
和 的混合气体分别按
的混合气体分别按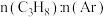 为
为 和
和 向密闭容器中投料,发生脱氢反应,测得
向密闭容器中投料,发生脱氢反应,测得 的转化率与时间的关系如图1所示(已知
的转化率与时间的关系如图1所示(已知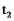 时反应处于平衡状态)。m点对应的投料方式为
时反应处于平衡状态)。m点对应的投料方式为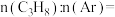
____ ,原因是_______________ 。 内,曲线
内,曲线_________ (填“ ”“
”“ ”)对应的平均反应速率最快。n点对应的平衡常数
”)对应的平均反应速率最快。n点对应的平衡常数
_____  (以分压表示,分压=总压×物质的量分数,保留一位小数)。
(以分压表示,分压=总压×物质的量分数,保留一位小数)。 ;
;
(3)在一定条件下,将物质的量之比为 的
的 和
和 匀速通入体积可变的反应容器中发生上述反应,使总压强恒定为
匀速通入体积可变的反应容器中发生上述反应,使总压强恒定为 。在不同温度下反应相同时间,测得丙烷和氧气的转化率与温度倒数
。在不同温度下反应相同时间,测得丙烷和氧气的转化率与温度倒数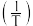 的关系如图2所示。
的关系如图2所示。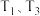 对应的点均处于平衡状态,保持其他条件不变,仅将容器更换为恒容的刚性容器,则图示点
对应的点均处于平衡状态,保持其他条件不变,仅将容器更换为恒容的刚性容器,则图示点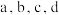 中,
中, 与
与 新的转化率点可能依次是
新的转化率点可能依次是________ (填代号);M点丙烷的分压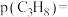
________  (保留两位有效数字)。
(保留两位有效数字)。
Ⅰ.由丙烷直接脱氢法制备:

(1)已知键能:
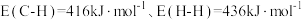 ;生成
;生成 碳碳
碳碳 键放出的能量为
键放出的能量为 ,则
,则
 。
。(2)在一定温度下,保持总压为
 ,将
,将 和
和 的混合气体分别按
的混合气体分别按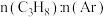 为
为 和
和 向密闭容器中投料,发生脱氢反应,测得
向密闭容器中投料,发生脱氢反应,测得 的转化率与时间的关系如图1所示(已知
的转化率与时间的关系如图1所示(已知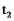 时反应处于平衡状态)。m点对应的投料方式为
时反应处于平衡状态)。m点对应的投料方式为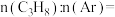
 内,曲线
内,曲线 ”“
”“ ”)对应的平均反应速率最快。n点对应的平衡常数
”)对应的平均反应速率最快。n点对应的平衡常数
 (以分压表示,分压=总压×物质的量分数,保留一位小数)。
(以分压表示,分压=总压×物质的量分数,保留一位小数)。
 ;
;
(3)在一定条件下,将物质的量之比为
 的
的 和
和 匀速通入体积可变的反应容器中发生上述反应,使总压强恒定为
匀速通入体积可变的反应容器中发生上述反应,使总压强恒定为 。在不同温度下反应相同时间,测得丙烷和氧气的转化率与温度倒数
。在不同温度下反应相同时间,测得丙烷和氧气的转化率与温度倒数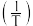 的关系如图2所示。
的关系如图2所示。
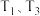 对应的点均处于平衡状态,保持其他条件不变,仅将容器更换为恒容的刚性容器,则图示点
对应的点均处于平衡状态,保持其他条件不变,仅将容器更换为恒容的刚性容器,则图示点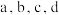 中,
中, 与
与 新的转化率点可能依次是
新的转化率点可能依次是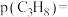
 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
名校
7 . 烯烃是一种应用广泛的化学原料。烯烃之间存在下列三个反应:
反应Ⅰ:

反应Ⅱ:
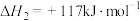
反应Ⅲ: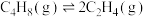

在压强为pkPa的恒压密闭容器中,反应达到平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。
反应Ⅰ:


反应Ⅱ:

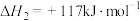
反应Ⅲ:
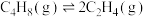

在压强为pkPa的恒压密闭容器中,反应达到平衡时,三种组分的物质的量分数x随温度T的变化关系如图所示。
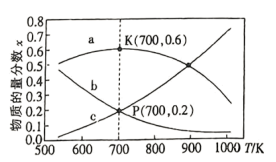
A.反应Ⅲ的 |
B.700K时反应Ⅱ的平衡常数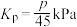 |
C.欲提高 的物质的量分数,需研发低温条件下活性好且耐高压的催化剂 的物质的量分数,需研发低温条件下活性好且耐高压的催化剂 |
| D.超过700K后曲线a下降的原因可能是随着温度升高反应Ⅰ逆向移动,反应Ⅱ正向移动 |
您最近一年使用:0次
2024-06-02更新
|
138次组卷
|
2卷引用:江西省九校联考2023-2024学年高三下学期3月月考化学试题
8 . Kvisle等人使用MgO=SiO2催化剂研究乙醇转化为1,3-丁二烯的反应机理如下。
②pA(g)+qB(g)⇌mC(g)+nD(g)
 100kPa
100kPa
回答下列问题:
(1)已知:在一定条件下,C2H5OH(g)、CH3CHO(g )⋅CH2=CH2 (g)和CH2=CHCH=CH2 (g)的燃烧热或摩尔燃烧焓(ΔH)分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1和d kJ⋅mol-1,则ΔH ₃=___________ kJ·mol-1,从体系能否自发进行的角度分析,反应Ⅰ在___________ (填“高温”或“低温”)下有利于其自发进行。
(2)向恒温恒容密闭容器中充入等物质的量的C2H5OH(g)和 N2,控制温度为T₁℃、起始压强为10 MPa下发生上述三个反应,反应进行 2 h 达到平衡,测得容器内压强为14 MPa,CH3CHO(g)、CH2=CH2 (g)和CH2=CHCH=CH2 (g)的压强满足以下关系。p(CH3CHO):p(CH2=CH2): p(CH2=CHCH=CH2)=1:3:2,,则1,3-丁二烯的产率为___________ ,反应Ⅲ的平衡常数 
___________
(3)在T2℃、15 MPa反应条件下,向 A、B、C三个容器中通入 分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。
分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。
①当反应进行到20 min时,三个容器中平均反应速率 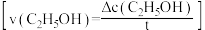 从大到小的顺序是
从大到小的顺序是___________ 。根据表格中数据可得出的结论是___________ 。
反应I: 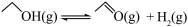 ΔH1=+48kJ/mol
ΔH1=+48kJ/mol
反应II:  ΔH2=-98kJ/mol
ΔH2=-98kJ/mol
反应III: 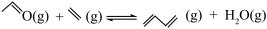 ΔH3
ΔH3
②pA(g)+qB(g)⇌mC(g)+nD(g)

 100kPa
100kPa回答下列问题:
(1)已知:在一定条件下,C2H5OH(g)、CH3CHO(g )⋅CH2=CH2 (g)和CH2=CHCH=CH2 (g)的燃烧热或摩尔燃烧焓(ΔH)分别为akJ⋅mol-1、bkJ⋅mol-1、ckJ⋅mol-1和d kJ⋅mol-1,则ΔH ₃=
(2)向恒温恒容密闭容器中充入等物质的量的C2H5OH(g)和 N2,控制温度为T₁℃、起始压强为10 MPa下发生上述三个反应,反应进行 2 h 达到平衡,测得容器内压强为14 MPa,CH3CHO(g)、CH2=CH2 (g)和CH2=CHCH=CH2 (g)的压强满足以下关系。p(CH3CHO):p(CH2=CH2): p(CH2=CHCH=CH2)=1:3:2,,则1,3-丁二烯的产率为

(3)在T2℃、15 MPa反应条件下,向 A、B、C三个容器中通入
 分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。
分别为1:1、1:3、1:7的混合气体,若只发生反应Ⅰ,测得C2H5OH(g)转化率随时间的变化如表所示。| 10 min | 20 min | 30 min | 40 min | 50 min | |
| A | 4.1% | 7.8% | 10.9% | 13.8% | 13.8% |
| B | 4.7% | 8.9% | 12.9% | 16.8% | 20.3% |
| C | 5.0% | 9.5% | 13.8% | 17.9% | 21.9% |
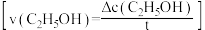 从大到小的顺序是
从大到小的顺序是
您最近一年使用:0次
解题方法
9 . 回答下列问题:
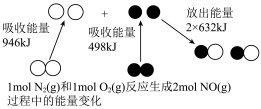
(1)汽车尾气中NO生成过程的能量变化如图所示。1molN2和1molO2完全反应生成NO会_______ (填“吸收”或“放出”)_______ kJ能量。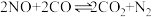 。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
①表中a=_______ 。
②能验证温度对化学反应速率影响规律的是实验_______ (填实验编号)。
③实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线_______ (填“甲”或“乙”)。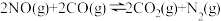 ,不能说明该反应已达到平衡状态的是_______(填字母)。
,不能说明该反应已达到平衡状态的是_______(填字母)。
(1)汽车尾气中NO生成过程的能量变化如图所示。1molN2和1molO2完全反应生成NO会
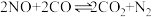 。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。
。已知增大催化剂的比表面积可提高反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,如表所示。| 实验编号 | T/℃ | NO初始浓度/( ) ) | CO初始浓度/( ) ) | 催化剂的比表面积/(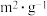 ) ) |
| I | 280 | 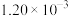 |  | 82 |
| II | 280 | 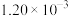 |  | 124 |
| III | 350 | a |  | 82 |
②能验证温度对化学反应速率影响规律的是实验
③实验I和实验II中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验II的是曲线

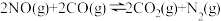 ,不能说明该反应已达到平衡状态的是_______(填字母)。
,不能说明该反应已达到平衡状态的是_______(填字母)。| A.容器内温度不再变化 |
| B.容器内的气体压强保持不变 |
| C.2v逆(NO)=v正(N2) |
| D.容器内混合气体的密度保持不变 |
您最近一年使用:0次
10 . 由硫铁矿“烧渣”(主要成分: 、
、 和FeO)制备绿矾(
和FeO)制备绿矾( ))的流程如图:
))的流程如图: (S的化合价为-1)难溶于水。
(S的化合价为-1)难溶于水。
(1)①中加入的酸为___________ 。①中 (烧渣的主要成分之一)与酸反应的离子方程式为
(烧渣的主要成分之一)与酸反应的离子方程式为___________ 。
(2)关于制备流程中含铁微粒的描述,错误的是___________。
(3)反应②需在高温高压下进行,且随着反应温度的升高,硫铁矿烧渣酸浸液中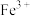 的还原率增加。已知滤渣2的成分中仅有
的还原率增加。已知滤渣2的成分中仅有 ,请你写出反应②的离子方程式
,请你写出反应②的离子方程式___________ 。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、___________ 过滤、洗涤、干燥。
(5)绿矾纯度测定:称量2.920g样品于锥形瓶中,溶解后加稀 酸化,用
酸化,用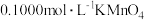 溶液滴定,消耗
溶液滴定,消耗 溶液20.00mL。该样品的纯度为
溶液20.00mL。该样品的纯度为___________ %(保留一位小数)。
(6)长期放置的 溶液易被氧化而变质,实验室用绿矾
溶液易被氧化而变质,实验室用绿矾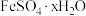 配制
配制 溶液时为了防止
溶液时为了防止 溶液变质,经常向其中加入
溶液变质,经常向其中加入___________ ,其原因是___________ (用离子方程式表示)。
(7) 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。已知
在空气中加热反应可制得铁系氧化物材料。已知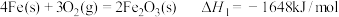
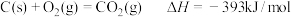

则:4FeCO3(s)+O2(g) 2Fe2O3(s)+4CO2(g) ΔH=
2Fe2O3(s)+4CO2(g) ΔH=___________ 。
(8)用一氧化碳还原氮氧化物,可防止氮氧化物污染。已知:
①2C(s)+O2(g)=2CO(g) ΔH1=-221kJ•mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+181kJ•mol-1
③2CO(g)+2NO(g)=2CO2(g)+N2(g) ΔH3=-747kJ•mol-1
则C(s)的燃烧热为___________ 。
 、
、 和FeO)制备绿矾(
和FeO)制备绿矾( ))的流程如图:
))的流程如图: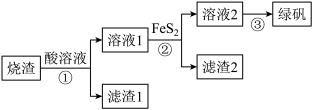
 (S的化合价为-1)难溶于水。
(S的化合价为-1)难溶于水。(1)①中加入的酸为
 (烧渣的主要成分之一)与酸反应的离子方程式为
(烧渣的主要成分之一)与酸反应的离子方程式为(2)关于制备流程中含铁微粒的描述,错误的是___________。
A.步骤①,硫酸酸溶后溶液中主要有 、 、 等正离子 等正离子 |
B.步骤①后可依次用KSCN溶液和酸性 溶液来检测溶液中铁元素的价态 溶液来检测溶液中铁元素的价态 |
| C.Fe元素位于周期表的第ⅥB族 |
D.步骤②中加入硫铁矿的目的是将 还原为 还原为 |
(3)反应②需在高温高压下进行,且随着反应温度的升高,硫铁矿烧渣酸浸液中
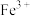 的还原率增加。已知滤渣2的成分中仅有
的还原率增加。已知滤渣2的成分中仅有 ,请你写出反应②的离子方程式
,请你写出反应②的离子方程式(4)通过③得到绿矾晶体的实验操作:加热浓缩、
(5)绿矾纯度测定:称量2.920g样品于锥形瓶中,溶解后加稀
 酸化,用
酸化,用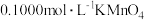 溶液滴定,消耗
溶液滴定,消耗 溶液20.00mL。该样品的纯度为
溶液20.00mL。该样品的纯度为(6)长期放置的
 溶液易被氧化而变质,实验室用绿矾
溶液易被氧化而变质,实验室用绿矾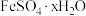 配制
配制 溶液时为了防止
溶液时为了防止 溶液变质,经常向其中加入
溶液变质,经常向其中加入(7)
 可转化为
可转化为 ,
, 在空气中加热反应可制得铁系氧化物材料。已知
在空气中加热反应可制得铁系氧化物材料。已知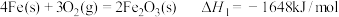
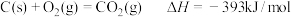

则:4FeCO3(s)+O2(g)
 2Fe2O3(s)+4CO2(g) ΔH=
2Fe2O3(s)+4CO2(g) ΔH=(8)用一氧化碳还原氮氧化物,可防止氮氧化物污染。已知:
①2C(s)+O2(g)=2CO(g) ΔH1=-221kJ•mol-1
②N2(g)+O2(g)=2NO(g) ΔH2=+181kJ•mol-1
③2CO(g)+2NO(g)=2CO2(g)+N2(g) ΔH3=-747kJ•mol-1
则C(s)的燃烧热为
您最近一年使用:0次



