1 . 下列叙述正确的是
A.可逆反应X(g)+Y(g) Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 Z(g)+W(s) ∆H>0,平衡后加入X,∆H增大 |
B.反应CO(g)+H2O(g) CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 CO2(g)+H2(g) ∆H<0,其他条件不变时升高温度,反应速率加快,反应放出的热量不变 |
| C.根据反应CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) H =-2878 kJ·mol−1 ;(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);H =-2869kJ·mol−1可知异丁烷的稳定性大于正丁烷 |
| D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
您最近一年使用:0次
名校
解题方法
2 . 有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。在101 kPa下,1 g氢气完全燃烧生成液态水放出142.9 kJ的热量。
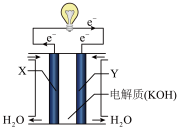
(1)请写出表示氢气燃烧热的热化学方程式__________________ 。
(2)将上述反应设计成下图所示的原电池,其中Y为________ 极(填“正”或“负”),该极电极反应式为___________________ 。

(1)请写出表示氢气燃烧热的热化学方程式
(2)将上述反应设计成下图所示的原电池,其中Y为
您最近一年使用:0次
名校
解题方法
3 . 下列关于热化学反应的描述中正确的是
| A.在25℃、101 kPa、1 mol CH4(g)和2 molCH4(g)的燃烧热相等 |
| B.1 mol浓硫酸与1 mol NaOH溶液完全中和所放出的热量为中和热 |
C.已知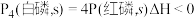 ,则白磷比红磷稳定 ,则白磷比红磷稳定 |
| D.△H越大,说明反应热量变化越大 |
您最近一年使用:0次
名校
解题方法
4 . 长征五号B运载火箭是中国近地轨道运载能力最大的新一代运载火箭,承担中国空间站舱段发射任务.采用液氧、液氢作为推进剂.回答下列问题:
(1)与偏二甲肼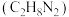 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是___________ ;
(2)已知: ;
;
 ;
;
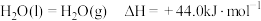 ;
;
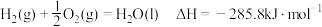 .
.
请写出液氢和液氧生成气态水的热化学方程式:______________ ,氢气的燃烧热
________ ;
(3)如果长征五号B运载火箭所携带的燃料为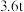 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量________  (保留3位有效数字);
(保留3位有效数字);
(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,________ 能转化为化学能;
②由图可知, 转化为
转化为 的催化剂是
的催化剂是________ (填字母)。
A. B.
B. C.
C. D.紫外线
D.紫外线
(1)与偏二甲肼
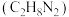 、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是
、四氧化二氨推进剂相比,液氢、液氧推进剂的优点是(2)已知:
 ;
; ;
;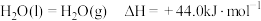 ;
;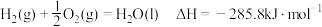 .
.请写出液氢和液氧生成气态水的热化学方程式:

(3)如果长征五号B运载火箭所携带的燃料为
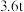 液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量
液氢、液氢,且液氢、液氧恰好完全反应生成气态水,总共释放能量 (保留3位有效数字);
(保留3位有效数字);(4)光催化制氢是能源研究热点.一种光催化水分解制取氢气的机理如图所示.

①该转化过程中,
②由图可知,
 转化为
转化为 的催化剂是
的催化剂是A.
 B.
B. C.
C. D.紫外线
D.紫外线
您最近一年使用:0次
5 . 依据图示关系,下列说法不正确的是
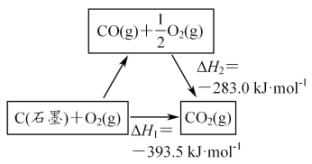

| A.C(石墨)的燃烧热为△H=—393.5kJ/mol |
| B.C(石墨)+CO2(g)= 2CO(g) △H=△H1—△H2 |
| C.1molC(石墨)和1 mol CO分别在足量O2中燃烧,全部转化为CO2,前者放热多 |
| D.化学反应的△H,只与反应体系的始态和终态有关,与反应途径无关 |
您最近一年使用:0次
名校
6 . 过氧乙酸(CH3CO3H)是一种广谱高效消毒剂,不稳定、易分解,高浓度易爆炸。常用于空气、器材的消毒,可由乙酸与H2O2在硫酸催化下反应制得,热化学方程式为:CH3COOH(aq)+H2O2(aq) CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
(1)利用上述反应制备760g CHCOH,放出的热量为_______ kJ。
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
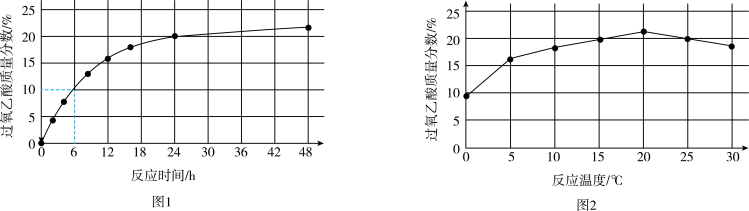 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=_____ g/h。(用含m的代数式表示)
②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是_______ (写出2条)。
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。
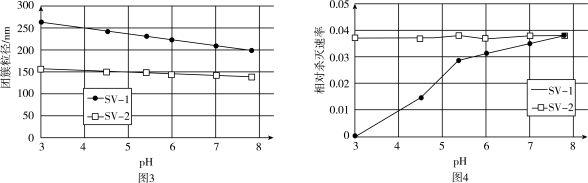
依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是___________ 。
 CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol
CH3CO3H(aq) + H2O(1) △H=-13.7kJ/mol(1)利用上述反应制备760g CHCOH,放出的热量为
(2)取质量相等的冰醋酸和50% H2O2溶液混合均匀,在一定量硫酸催化下进行如下实验。
实验1:在25℃下,测定不同时间所得溶液中过氧乙酸的质量分数。数据如图1所示。
实验2:在不同温度下反应(反应均未达到平衡),测定24小时所得溶液中过氧乙酸的质量分数。数据如图2所示。
 ①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=
①实验1中,若反应混合液的总质量为m g,依据图1数据计算,在0~6h间,v(CH3CO3H)=②综合图1、图2分析,与20℃相比,25℃时过氧乙酸产率降低的可能原因是
(3)SV-1、SV-2是两种常用于实验研究的病毒,粒径分别为40nm和70nm。病毒在水中可能会聚集成团簇。不同pH下,病毒团簇粒径及过氧乙酸对两种病毒的相对杀灭速率分别如图3、图4所示。

依据图3、图4分析,过氧乙酸对SV-1的杀灭速率随pH增大而增大的原因可能是
您最近一年使用:0次
名校
7 . 25℃、101kPa下,32g甲醇完全燃烧生成液态水和二氧化碳时,放出763.3kJ热量,下列表示该反应的热化学方程式正确的是
| A.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-763.3kJ/mol |
| B.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) ΔH=-763.3 kJ |
| C.2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(1) ΔH=-763.3 kJ/mol |
| D.CH3OH(1)+3/2O2(g)=CO2(g)+2H2O(1) ΔH=-763.3kJ/mol |
您最近一年使用:0次
2023-12-27更新
|
250次组卷
|
3卷引用:北京市中关村中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
8 . 结合已知条件分析,下列热化学方程式正确的是(所有数据均在常温常压条件下测定)
| 选项 | 已知条件 | 热化学方程式 |
| A |  的燃烧热数值为a kJ/mol 的燃烧热数值为a kJ/mol | 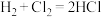 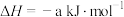 |
| B | 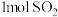 与足量 与足量 充分反应后,放出热量 充分反应后,放出热量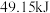 |  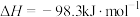 |
| C |   | 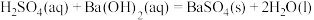 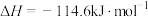 |
| D | 31g白磷比31g红磷能量多b kJ |  , ,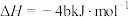 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-19更新
|
246次组卷
|
8卷引用:山西省太原市2021-2022学年高二上学期期中考试化学试题
解题方法
9 . “对比实验”是科学探究中的重要方法。请根据图回答下列问题:

(1)图甲铜片上白磷燃烧而水中白磷不燃烧,说明燃烧条件之一是________ 。
(2)图乙A中溶液呈紫红色,B中溶液无色,说明A中溶液呈紫红色的原因是________ 含有(填离子符号或名称)。
(3)图丙中铁钉最容易生锈的是________ (填序号)。自行车链条防锈措施是________ (任填一条)。

(1)图甲铜片上白磷燃烧而水中白磷不燃烧,说明燃烧条件之一是
(2)图乙A中溶液呈紫红色,B中溶液无色,说明A中溶液呈紫红色的原因是
(3)图丙中铁钉最容易生锈的是
您最近一年使用:0次
名校
10 . 自热化学链重整制氢 CLR(a)工艺的原理如图所示:
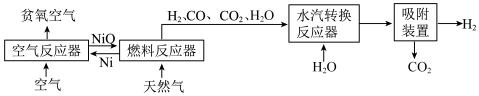
回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为___________ 。
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:___________ 。
②K1、K2、K3之间的关系是:___________ ;
③在___________ (填“高温”或“低温”)情况下有利于反应Ⅲ的自发进行。
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=___________ 。
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:___________ ;
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:___________ ;
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为___________ (结果保留 1 位小数)。

回答下列问题:
(1)25℃、101kPa 时,5.9gNi 与足量 O2反应生成 NiO 放出 47.2kJ 的热量,则在“空气反应器” 中发生反应的热化学方程式为
(2)“燃料反应器”中发生的部分反应有:
(I)CO(g)+NiO(s)=CO2(g)+Ni(s) ΔH1=-47.0kJ/mol 平衡常数 K1
(II)CH4(g)+4NiO(s)=CO2(g)+2H2O(g)+4Ni(s) ΔH2=+137.7kJ/mol 平衡常数 K2
(III) CH4(g)+3CO2(g)=4CO(g)+2H2O(g) ΔH3=akJ/mol 平衡常数 K3
①CO2的电子式:
②K1、K2、K3之间的关系是:
③在
(3)“水汽转换反应器”中发生的反应为CO(g)+ H2O(g)=CO2(g)+H2(g),将天然气看作是纯净的CH4(假定向水汽转换反应器中补充的水的物质的量等于甲烷的物质的量),若在 t℃时进行转换,水汽转换反应器中达平衡时 CO、H2O、H2、CO2浓度之比为1:x:3:1,则该反应的平衡常数 K=
(4)甲烷制氢传统工艺有水蒸气重整部分氧化重整以及联合重整等,CLR(a)工艺重整是一种联合重整,涉及反应的热化学方程式如下:
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+192kJ/mol
CH4(g)+O2(g)=CO2(g)+2H2(g) ΔH=-768kJ/mol
水蒸气重整反应: 部分氧化重整反应:
①采用水蒸气重整的优点是:
②上述两个反应的缺点之一是在制取氢气的同时产生大量温室气体 CO2,若用 NaOH 溶液来吸收 CO2,写出反应的离子方程式:
③若上述两个反应在保持自热条件下(假设无热量损失),理论上 2 molCH4至多可获得 H2的物质的量为
您最近一年使用:0次



