1 . 按要求回答下列问题:
(1)已知:I.

II.

III.

①表示C的燃烧热的热化学方程式为______ (填序号)。
②写出CO燃烧的热化学方程式______ 。
③
______ 。
(2)下列反应是目前大规模制取氢气的方法之一


①在容积不变的密闭容器中,将2.0mol的CO与8.0mol的 混合加热到830℃,达到平衡时CO的转化率80%,此温度下该反应的平衡常数
混合加热到830℃,达到平衡时CO的转化率80%,此温度下该反应的平衡常数______ ,放出的热量为______ 。
②若保持温度不变,把容器的容积缩小一半,则正反应速率______ (填“增大”“减小”或“不变”,下同),逆反应速率______ ,CO的转化率______ ,平衡常数______ 。
(1)已知:I.


II.


III.


①表示C的燃烧热的热化学方程式为
②写出CO燃烧的热化学方程式
③

(2)下列反应是目前大规模制取氢气的方法之一


①在容积不变的密闭容器中,将2.0mol的CO与8.0mol的
 混合加热到830℃,达到平衡时CO的转化率80%,此温度下该反应的平衡常数
混合加热到830℃,达到平衡时CO的转化率80%,此温度下该反应的平衡常数②若保持温度不变,把容器的容积缩小一半,则正反应速率
您最近一年使用:0次
名校
2 . 下图是煤的综合利用过程中化工产业链的一部分
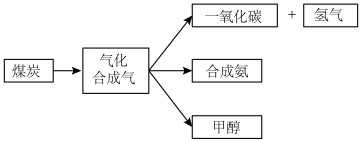
(1)煤的气化发生的主要反应是: 。
。
已知:
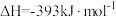

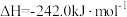
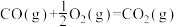
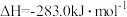
煤气化时发生主要反应的热化学方程式是___________ 。
(2)用煤气化后得到的 合成氨:
合成氨: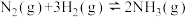
 。在容积为2L的密闭容器中投入
。在容积为2L的密闭容器中投入 和
和 充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是___________ (填字母)。
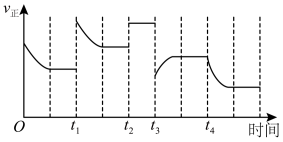
a.t1时可能增大了 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气
c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)如图是合成氨反应平衡混合气中 的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是___________ (填“温度”或“压强”);判断L1___________ L2 (填“>”或“<”),理由是___________ 。

(4)某温度时合成甲醇的反应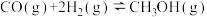
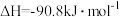 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:
①前2min的反应速率
___________ 。
②该温度下的平衡常数___________ 。(可用分数表示)

(1)煤的气化发生的主要反应是:
 。
。已知:

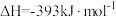

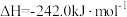
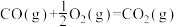
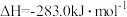
煤气化时发生主要反应的热化学方程式是
(2)用煤气化后得到的
 合成氨:
合成氨: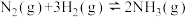
 。在容积为2L的密闭容器中投入
。在容积为2L的密闭容器中投入 和
和 充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
充分反应,在不同时间改变反应条件,正反应速率的变化如图所示。下列说法正确的是
a.t1时可能增大了
 的浓度 b.t2时可能充入了氦气
的浓度 b.t2时可能充入了氦气c.t3时可能降低了温度 d.t4时可能分离出氨气
(3)如图是合成氨反应平衡混合气中
 的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是
(4)某温度时合成甲醇的反应
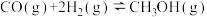
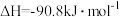 ,在容积固定的密闭容器中,各物质的浓度如下表所示:
,在容积固定的密闭容器中,各物质的浓度如下表所示:浓度 时间 |  | 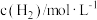 |  |
| 0 | 1.0 | 1.8 | 0 |
| 2min | 0.5 | 0.5 | |
| 4min | 0.4 | 0.6 | 0.6 |
| 6min | 0.4 | 0.6 | 0.6 |
①前2min的反应速率

②该温度下的平衡常数
您最近一年使用:0次
2022-02-17更新
|
196次组卷
|
3卷引用:北京市平谷区2021-2022学年高二上学期期末化学试题
3 . 实现二氧化碳选择性,稳定性加氢合成甲醇是“甲醇经济”理念下的一个重要成果。反应包括两步:
Ⅰ.
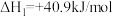
Ⅱ.
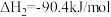
(1)由 合成
合成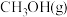 的热化学方程式
的热化学方程式_______ 。
(2)恒压下,按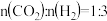 时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出水)。
时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出水)。

①根据图中数据,压强不变采用有分子筛膜时的最佳反应温度为_______  。
。
②有分子筛膜时甲醇产率高的原因是_______ 。
(3)如果在不同压强下, 和
和 的起始物质的量比仍为
的起始物质的量比仍为 ,测定
,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示:

已知: 的平衡转化率
的平衡转化率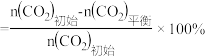 ,
, 的平衡产率
的平衡产率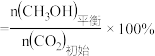 。
。
①压强p1______ p2(填“ ”或“
”或“ ”),原因
”),原因_______ 。
②其中图中纵坐标表示CO2平衡转化率的是图_______ (填“甲”或“乙”)。
③图乙中T1温度时,两条曲线几乎交于一点,分析原因_______ 。
Ⅰ.

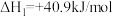
Ⅱ.

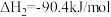
(1)由
 合成
合成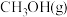 的热化学方程式
的热化学方程式(2)恒压下,按
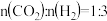 时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出水)。
时,该反应在无分子筛膜和有分子筛膜时甲醇的平衡产率随温度的变化如图所示。(分子筛膜能选择性分离出水)。
①根据图中数据,压强不变采用有分子筛膜时的最佳反应温度为
 。
。②有分子筛膜时甲醇产率高的原因是
(3)如果在不同压强下,
 和
和 的起始物质的量比仍为
的起始物质的量比仍为 ,测定
,测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度升高的变化关系,如图所示:
的平衡产率随温度升高的变化关系,如图所示:
已知:
 的平衡转化率
的平衡转化率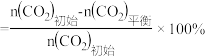 ,
, 的平衡产率
的平衡产率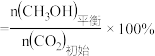 。
。①压强p1
 ”或“
”或“ ”),原因
”),原因②其中图中纵坐标表示CO2平衡转化率的是图
③图乙中T1温度时,两条曲线几乎交于一点,分析原因
您最近一年使用:0次
2021-03-26更新
|
1320次组卷
|
4卷引用:北京市平谷区2022-2023学年高二上学期期末考试化学试题
北京市平谷区2022-2023学年高二上学期期末考试化学试题北京市平谷区2021届高三一模化学试题北京市平谷区2021届高三下学期质量监控(零模)化学试题(已下线)2021年高考全国甲卷化学试题变式题



