解题方法
1 . 含碳化合物的合成与转化具有重要的研究价值。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为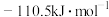 、
、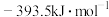 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为___________ 。
(2) 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示:
该反应的热化学反应方程式为___________ 。
(3)汽车尾气中的 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
(4) 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: 、
、 表示,则
表示,则
___________  (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。
②y点对应的v(逆)___________ z点对应的v(正)。
③若w点的时间为5min,则 的平均反应速率为
的平均反应速率为___________  。此温度下的化学平衡常数为
。此温度下的化学平衡常数为___________ 。
(1)热力学规定,在标准压强和指定温度下,由元素最稳定的单质生成
 化合物时的反应热称为该化合物的标准摩尔生成焓。常温下,
化合物时的反应热称为该化合物的标准摩尔生成焓。常温下, 、
、 的标准摩尔生成焓分别为
的标准摩尔生成焓分别为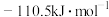 、
、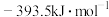 ,则表示
,则表示 标准摩尔生成焓的热化学反应方程式为
标准摩尔生成焓的热化学反应方程式为(2)
 与
与 在某催化剂作用下的反应如图所示:
在某催化剂作用下的反应如图所示: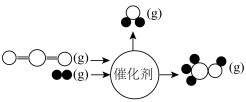
| 化学键 |
|
|
|
|
|
键能/( ) ) | 438 | 326 | 802 | 464 | 414 |
(3)汽车尾气中的
 和
和 在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。
在催化转化器中可反应生成两种无毒无害的气体(该反应为放热反应),若该反应在恒温、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到时刻达到平衡状态的是___________(填标号)。A.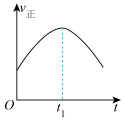 | B.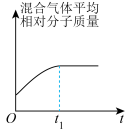 |
C.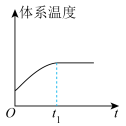 | D.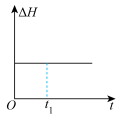 |
 与
与 可发生反应:
可发生反应: ,2L密闭容器中通入
,2L密闭容器中通入
 和
和
 ,在不同催化剂(A、B)作用下,进行相同时间后,
,在不同催化剂(A、B)作用下,进行相同时间后, 的产率随反应温度的变化如图所示:
的产率随反应温度的变化如图所示: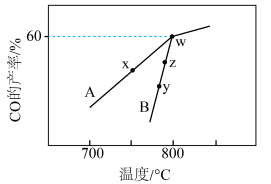
 、
、 表示,则
表示,则
 (填“>”“<”或“=”,下同)。
(填“>”“<”或“=”,下同)。②y点对应的v(逆)
③若w点的时间为5min,则
 的平均反应速率为
的平均反应速率为 。此温度下的化学平衡常数为
。此温度下的化学平衡常数为
您最近一年使用:0次
解题方法
2 . 乙烯是一种基本化工原料,广泛应用于高新材料合成、医药合成等。工业上,乙烯的制备途径有多种。回答下列问题:
(1)二氧化碳催化加氢制备乙烯
反应原理: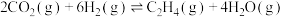
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
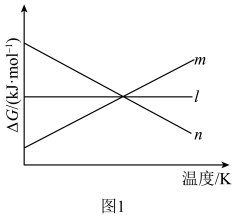
①△H=______ ;△G随着温度变化的三种趋势如图1所示,能用来表示该反应的曲线是________ (填字母标号)。 和3mol
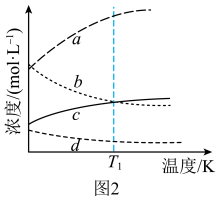
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是______ (填字母标号); K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
___________ 。
主反应:
副反应:
某温度下,向0.5L恒容密闭容器中充入1mol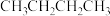 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=_______ 。
②平衡时乙烯的选择性η(乙烯)=_________ 。
[已知选择性 ]
]
③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图_________ 。
(1)二氧化碳催化加氢制备乙烯
反应原理:
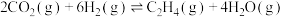
 。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓(
。已知相关物质的标准摩尔生成焓数据如表所示[标准摩尔生成焓( )是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。
)是指在标准压力下,一定温度时,由元素最稳定的单质合成1摩尔物质时的反应焓变]。物质 |
|
|
|
|
|
| 0 | 52.3 |
|
 和3mol
和3mol  ,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表
,发生上述反应。平衡体系中各成分的浓度随温度的变化如图2所示。则图中代表 的曲线是
的曲线是 K时,该反应的化学平衡常数
K时,该反应的化学平衡常数
主反应:

副反应:

某温度下,向0.5L恒容密闭容器中充入1mol
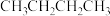 (g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。
(g),发生上述反应。保持温度不变,正丁烷与乙烯的浓度随时间的变化关系如图3所示。①反应开始至达平衡过程中,副反应平均反应速率v(丙烯)=
②平衡时乙烯的选择性η(乙烯)=
[已知选择性
 ]
]③第12min时,其他条件不变,扩大容器容积至1L,至14min体系再次达到平衡,请在图3中画出乙烯的浓度随时间的变化曲线示意图

您最近一年使用:0次
3 .  是一种重要的化工品,一定温度下发生分解反应:
是一种重要的化工品,一定温度下发生分解反应:
①

②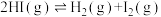
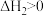
③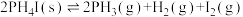

回答下列问题:
(1)
_______ (用含 和
和 的式子表示),
的式子表示),
_______ 0(填“”“<”或“=”)。
(2)向一恒温恒容密闭容器中投入足量 (s),只发生反应①,下列叙述正确的是
(s),只发生反应①,下列叙述正确的是_______ (填标号)。
A.平衡后,再充入少量 ,
, 质量增大
质量增大
B. 体积分数不变时,该反应达到平衡状态
体积分数不变时,该反应达到平衡状态
C.再投入一定量的 (s),反应速率明显增大
(s),反应速率明显增大
(3) 的速率方程为
的速率方程为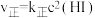 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。
①某温度下,K=15,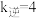 ,则
,则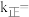
_______ 。
②已知: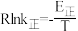 (R为常数,
(R为常数, 的单位为
的单位为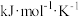 ,温度T的单位为K,E的单位为
,温度T的单位为K,E的单位为 )速率常数
)速率常数 与活化能(
与活化能(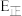 )、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
)、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。_______ (填“Cat1”或“Cat2”),判断依据是_______ 。在催化剂Cat2作用下,正反应的活化能为_______  。
。
(4)一定温度下,向一体积为1L的恒容密闭容器中充入足量 (s),达到平衡时测得生成1mol
(s),达到平衡时测得生成1mol  (g)和0.4mol
(g)和0.4mol  ,则
,则 的平衡常数K=
的平衡常数K=_______ 。
 是一种重要的化工品,一定温度下发生分解反应:
是一种重要的化工品,一定温度下发生分解反应:①


②
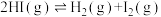
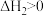
③
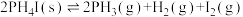

回答下列问题:
(1)

 和
和 的式子表示),
的式子表示),
(2)向一恒温恒容密闭容器中投入足量
 (s),只发生反应①,下列叙述正确的是
(s),只发生反应①,下列叙述正确的是A.平衡后,再充入少量
 ,
, 质量增大
质量增大B.
 体积分数不变时,该反应达到平衡状态
体积分数不变时,该反应达到平衡状态C.再投入一定量的
 (s),反应速率明显增大
(s),反应速率明显增大(3)
 的速率方程为
的速率方程为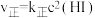 ,
, (
( 、
、 为速率常数,只与温度有关)。
为速率常数,只与温度有关)。①某温度下,K=15,
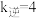 ,则
,则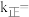
②已知:
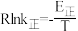 (R为常数,
(R为常数, 的单位为
的单位为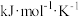 ,温度T的单位为K,E的单位为
,温度T的单位为K,E的单位为 )速率常数
)速率常数 与活化能(
与活化能(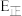 )、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。
)、温度(T)的关系如图所示(Cat1、Cat2为催化剂)。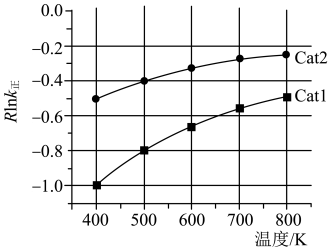
 。
。(4)一定温度下,向一体积为1L的恒容密闭容器中充入足量
 (s),达到平衡时测得生成1mol
(s),达到平衡时测得生成1mol  (g)和0.4mol
(g)和0.4mol  ,则
,则 的平衡常数K=
的平衡常数K=
您最近一年使用:0次
4 .  转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。
(1)活化能:反应①______ 反应②(填“>”“<”或“=”);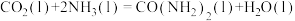

_____ (用含 、
、 、
、 、
、 的式子表示)。
的式子表示)。
Ⅱ.利用 和重整技术可获得合成气(主要成分为CO、
和重整技术可获得合成气(主要成分为CO、 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:
反应ⅰ: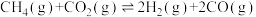
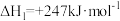
反应ⅱ:
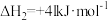
不同配比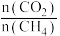 随温度变化对出口合成气中
随温度变化对出口合成气中 的影响如下图所示:
的影响如下图所示: 的转化率:M
的转化率:M_______ N(填“>”“<”或“=”,下同);平衡常数M_______ N。
(3)当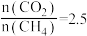 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是_______ 。
 转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将
转化利用对化解全球环境生态危机、助力全球“碳达峰、碳中和”目标的实现具有重要意义。化学工作者致力于将 转化为各种化工原料。
转化为各种化工原料。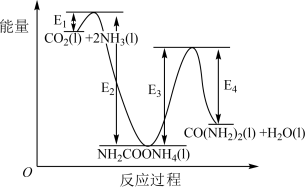
 和
和 为原料在一定温度和压强下合成尿素。反应分两步:①
为原料在一定温度和压强下合成尿素。反应分两步:① 和
和 生成
生成 ;②
;② 分解生成尿素。
分解生成尿素。(1)活化能:反应①
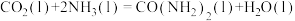

 、
、 、
、 、
、 的式子表示)。
的式子表示)。Ⅱ.利用
 和重整技术可获得合成气(主要成分为CO、
和重整技术可获得合成气(主要成分为CO、 ),重整过程中反应的热化学方程式如下:
),重整过程中反应的热化学方程式如下:反应ⅰ:
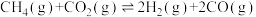
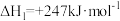
反应ⅱ:

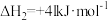
不同配比
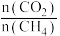 随温度变化对出口合成气中
随温度变化对出口合成气中 的影响如下图所示:
的影响如下图所示: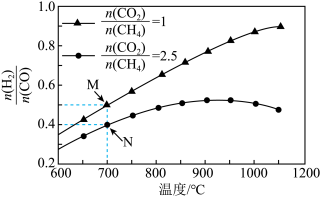
 的转化率:M
的转化率:M(3)当
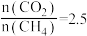 ,温度高于900℃,
,温度高于900℃, 减小的原因可能是
减小的原因可能是
您最近一年使用:0次
名校
解题方法
5 . 甲烷选择性氧化制备甲醇是一种原子利用率高的方法。回答下列问题:
(1)已知下列反应的热化学方程式:
①

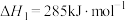
②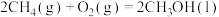

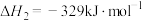
反应③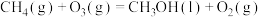 的
的
______  ,平衡常数
,平衡常数
______ (用 、
、 表示)。
表示)。
(2)电喷雾电离等方法得到的 (
( 、
、 、
、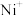 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应
反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应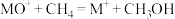 ,结果如下图所示。图中300K的曲线是
,结果如下图所示。图中300K的曲线是______ (填“a”或“b”)。300K、60s时 的转化率为
的转化率为______ (列出算式)。 分别与
分别与 、
、 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。
示例)。______ (填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线______ (填“c”或“d”)。
(ⅲ) 与
与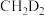 反应,氘代甲醇的产量
反应,氘代甲醇的产量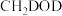
______ 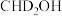 (填“>”“<”或“=”)。若
(填“>”“<”或“=”)。若 与
与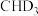 反应,生成的氘代甲醇可能为
反应,生成的氘代甲醇可能为______ 或______ (写结构简式)。
(1)已知下列反应的热化学方程式:
①


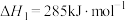
②
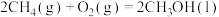

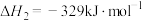
反应③
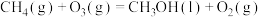 的
的
 ,平衡常数
,平衡常数
 、
、 表示)。
表示)。(2)电喷雾电离等方法得到的
 (
( 、
、 、
、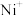 等)与
等)与 反应可得
反应可得 。
。 与
与 反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应
反应能高选择性地生成甲醇。分别在300K和310K下(其他反应条件相同)进行反应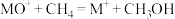 ,结果如下图所示。图中300K的曲线是
,结果如下图所示。图中300K的曲线是 的转化率为
的转化率为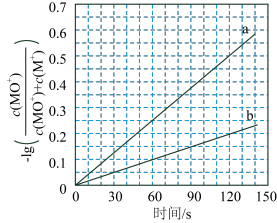
 分别与
分别与 、
、 反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以
反应,体系的能量随反应进程的变化如下图所示(两者历程相似,图中以 示例)。
示例)。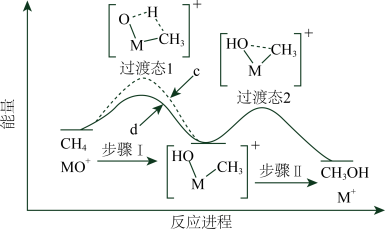
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则
 与
与 反应的能量变化应为图中曲线
反应的能量变化应为图中曲线(ⅲ)
 与
与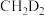 反应,氘代甲醇的产量
反应,氘代甲醇的产量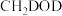
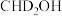 (填“>”“<”或“=”)。若
(填“>”“<”或“=”)。若 与
与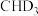 反应,生成的氘代甲醇可能为
反应,生成的氘代甲醇可能为
您最近一年使用:0次
解题方法
6 . I.甲醇(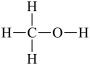 )是重要的化工原料,又可作为燃料。利用合成气(主要成分为
)是重要的化工原料,又可作为燃料。利用合成气(主要成分为 、
、 和
和 )在催化剂的作用下合成甲醇,涉及的反应有:
)在催化剂的作用下合成甲醇,涉及的反应有:
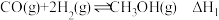
②

③
 与
与 反应生成
反应生成 和
和
已知反应①中的相关的化学键键能数据如下:(
 为
为 )
)| 化学键 |  |  |  |  |  |
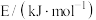 | 436 | 343 | 1076 | 465 | 413 |
(1)

 。
。(2)反应③的热化学方程式为
 用含
用含 和
和 的式子表示)
的式子表示)Ⅱ.亚硝酰氯(
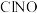 )是有机合成中的重要试剂,可通过反应:
)是有机合成中的重要试剂,可通过反应: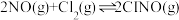 获得。
获得。(3)在恒温恒容的密闭容器中,氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
①
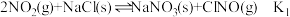
②

③

则

 、
、 的式子表示)。
的式子表示)。下列事实不能说明上述体系中反应③已达平衡状态的是
a.容器内气体的颜色不再变化 b.容器中气体的密度不再变化 c.
 不再发生变化
不再发生变化(4)300℃时,
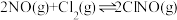 的正反应速率表达式为
的正反应速率表达式为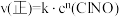 ,测得速率和浓度的关系如表所示:
,测得速率和浓度的关系如表所示:| 序号 | 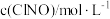 | 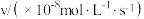 |
| ① | 0.30 | 0.36 |
| ② | 0.60 | 1.44 |
| ③ | 0.90 | 3.24 |
(5)对于反应③按投料比
 把
把 和
和 加入到压强恒为p的密闭容器中发生反应,平衡时
加入到压强恒为p的密闭容器中发生反应,平衡时 的转化率与温度T的关系如图所示:
的转化率与温度T的关系如图所示: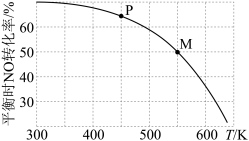
 的体积分数为
的体积分数为②M点的分压平衡常数

(6)一定条件下,在恒温恒容的密闭容器中按一定比例充入
 和
和 ,平衡时
,平衡时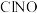 的体积分数随
的体积分数随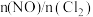 的变化图像如图所示,则A、B、C三状态中,
的变化图像如图所示,则A、B、C三状态中, 的转化率最大的是
的转化率最大的是
您最近一年使用:0次
7 . 已知① ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 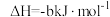 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)
 ②C2H5OH(g)=C2H5OH(l)
②C2H5OH(g)=C2H5OH(l) 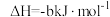 ,③
,③ (a、b、c均>0)。若使
(a、b、c均>0)。若使 酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位:
酒精液体完全燃烧,最后恢复到室温,则放出的热量为(单位: )
)A.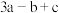 | B.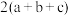 | C.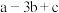 | D.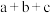 |
您最近一年使用:0次
解题方法
8 . 工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g) H= +133 kJ/mol
H= +133 kJ/mol
H2O(g)=H2O(l) H=- 44 kJ/mol
H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___________ 。
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是___________ 。
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH 和SO
和SO 。物质A的化学式为
。物质A的化学式为___________ ,阴极的电极反应式是___________ 。
(1)I.脱硝:已知:H2的燃烧热为285.8 kJ/mol
N2(g)+2O2(g)=2NO2(g)
 H= +133 kJ/mol
H= +133 kJ/molH2O(g)=H2O(l)
 H=- 44 kJ/mol
H=- 44 kJ/mol催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为
(2)II.脱碳:
向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应 CO2(g) + 3H2(g) =CH3OH(l) + H2O(l)。下列叙述能说明此反应达到平衡状态的是
A.混合气体的平均式量保持不变
B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等
D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(3)III.脱硫:
如图电解装置可将雾霾中的NO、SO2分别转化为NH
 和SO
和SO 。物质A的化学式为
。物质A的化学式为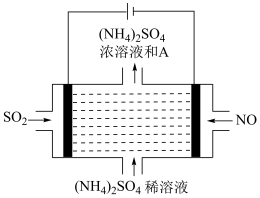
您最近一年使用:0次
解题方法
9 . 以  为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:
I.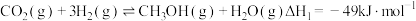
II.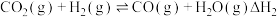
回答下列问题:
(1)已知 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、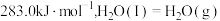
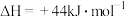 ,则∆H2=
,则∆H2=___________ kJ/mol。
(2)在恒压密闭容器中,按照 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 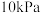 )。
)。 对应图1中
对应图1中___________ (填:“ ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=___________ kPa-2 (保留两位有效数字)。
②通过调整温度可调控平衡时 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= ___________ kPa 。
(3)在密闭容器中,保持投料比不变,将 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。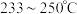 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 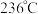 图中曲线下降的原因是
图中曲线下降的原因是___________ ;
②若气体流速过大, 的转化率会降低,原因是
的转化率会降低,原因是___________ 。
(4)向恒温恒压的两个密闭容器甲 、乙
、乙  中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应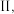 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 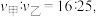 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为___________ 。
 为原料合成
为原料合成  的反应是研究热点之一,该反应体系涉及的反应如下:
的反应是研究热点之一,该反应体系涉及的反应如下:I.
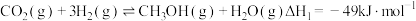
II.
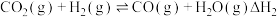
回答下列问题:
(1)已知
 和101kPa下,
和101kPa下, 的燃烧热分别为
的燃烧热分别为  、
、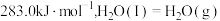
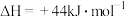 ,则∆H2=
,则∆H2=(2)在恒压密闭容器中,按照
 投料进行反应,反应I、
投料进行反应,反应I、 以物质的分压表示的平衡常数
以物质的分压表示的平衡常数 随温度
随温度  的变化关系如下图1所示(体系总压为
的变化关系如下图1所示(体系总压为 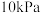 )。
)。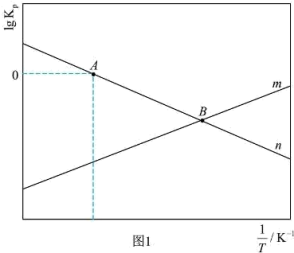
 对应图1中
对应图1中 ” 或“
” 或“ ”);
”);  点对应温度下体系达到平衡时
点对应温度下体系达到平衡时  的转化率为
的转化率为  ,反应I的Kp=
,反应I的Kp=②通过调整温度可调控平衡时
 的值。
的值。 点对应温度下,平衡时
点对应温度下,平衡时  ,则p(H2)=
,则p(H2)= (3)在密闭容器中,保持投料比不变,将
 和
和 按一定流速通过反应器,一段时间后,测得
按一定流速通过反应器,一段时间后,测得  转化率
转化率 和甲醇选择性
和甲醇选择性 随温度
随温度 变化关系如上图2所示。
变化关系如上图2所示。
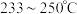 催化剂的活性受温度影响不大,则
催化剂的活性受温度影响不大,则 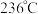 图中曲线下降的原因是
图中曲线下降的原因是②若气体流速过大,
 的转化率会降低,原因是
的转化率会降低,原因是(4)向恒温恒压的两个密闭容器甲
 、乙
、乙  中,分别充入物质的量均为
中,分别充入物质的量均为 的
的  和
和  ,若只发生反应
,若只发生反应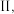 其正反应速率
其正反应速率  为气体分压。若甲、乙容器平衡时正反应速率之比
为气体分压。若甲、乙容器平衡时正反应速率之比 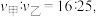 则甲、乙容器的体积之比为
则甲、乙容器的体积之比为
您最近一年使用:0次
名校
10 . CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l) H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=___________ kJ/mol。
Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(2)制备“合成气”反应历程分两步:
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
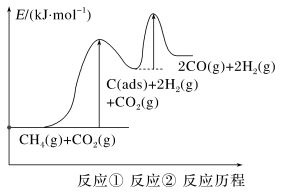
①反应速率快慢比较:反应①___________ 反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因___________ 。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=___________ (用k1、k2、k3、k4表示)。
(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
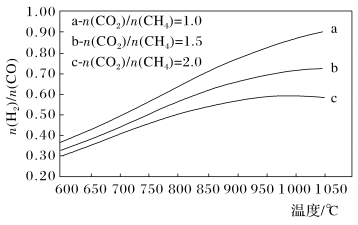
随着进料比 的增加,
的增加, 的值
的值___________ (填“增大”、“不变”或“减小”),其原因是___________ 。
Ⅰ.工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)
 H2O(l)+NH2CONH2(l) ΔH=
H2O(l)+NH2CONH2(l) ΔH=Ⅱ.可利用CO2和CH4催化制备合成气(CO、H2),在一定温度下容积为1 L密闭容器中,充入等物质的量CH4和CO2,加入Ni/Al2O3使其发生反应:CH4(g)+CO2(g)
 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。(2)制备“合成气”反应历程分两步:
| 步骤 | 反应 | 正反应速率方程 | 逆反应速率方程 |
| 反应① | CH4(g) C(ads)+2H2(g) C(ads)+2H2(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) 2CO(g) 2CO(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |

①反应速率快慢比较:反应①
②一定温度下,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的平衡常数K=
2CO(g)+2H2(g)的平衡常数K=(3)制备合成气(CO、H2)过程中发生副反应:CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比
CO(g)+H2O(g) ΔH2=+41.0 kJ/mol,在刚性密闭容器中,进料比 分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中,
分别等于1.0、1.5、2.0,且反应达到平衡状态。反应体系中, 随温度变化的关系如图所示:
随温度变化的关系如图所示:
随着进料比
 的增加,
的增加, 的值
的值
您最近一年使用:0次





 (g)
(g)