名校
解题方法
1 . 根据HX的水溶液能量循环图,下列说法不正确 的是
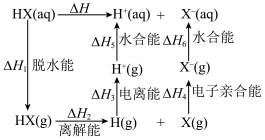

A.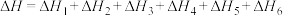 |
| B.相同条件下,1molHF(g)的熵=1molHCl(g)的熵 |
C.相同条件下,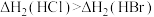 |
D.相同条件的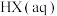 中, 中,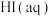 酸性最强,可推测HI电离的 酸性最强,可推测HI电离的 最小 最小 |
您最近一年使用:0次
解题方法
2 . 氢能是一种绿色能源。以乙醇和水催化重整可获得到 。有关反应如下:
。有关反应如下:
反应①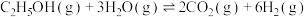
 ,平衡常数
,平衡常数 ;
;
反应②
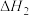 ,平衡常数
,平衡常数 ;
;
反应③
 ,平衡常数
,平衡常数 。
。
已知:平衡常数与 关系为
关系为 (R为常能数,K为平衡常数,T为温度)。
(R为常能数,K为平衡常数,T为温度)。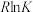 与T关系如图所示。下列推断正确的是
与T关系如图所示。下列推断正确的是

 。有关反应如下:
。有关反应如下:反应①
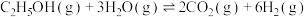
 ,平衡常数
,平衡常数 ;
;反应②

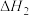 ,平衡常数
,平衡常数 ;
;反应③

 ,平衡常数
,平衡常数 。
。已知:平衡常数与
 关系为
关系为 (R为常能数,K为平衡常数,T为温度)。
(R为常能数,K为平衡常数,T为温度)。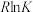 与T关系如图所示。下列推断正确的是
与T关系如图所示。下列推断正确的是
A. , , | B.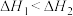 |
C.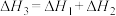 | D.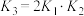 |
您最近一年使用:0次
3 . 用钌( )基催化剂催化
)基催化剂催化 和
和 的反应时,反应机理如图,下列说法正确的是
的反应时,反应机理如图,下列说法正确的是

 )基催化剂催化
)基催化剂催化 和
和 的反应时,反应机理如图,下列说法正确的是
的反应时,反应机理如图,下列说法正确的是
| A.该反应历程中包含6个基元反应 |
B.图示中参与循环的物质只有 和 和 |
C.总反应式为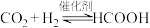 |
| D.图示中物质Ⅱ为该反应催化剂,Ⅰ和Ⅲ是反应中间体 |
您最近一年使用:0次
2023-12-13更新
|
206次组卷
|
4卷引用:山东省泰安第二中学2023-2024学年高二上学期12月月考化学试题
4 . 二甲醚(DME)被誉为“21世纪的清洁燃料”,由合成气制备二甲醚的主要原理如下:
①
 kJ·mol
kJ·mol

②
 kJ⋅mol
kJ⋅mol

③
 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应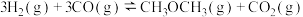 的
的
______ kJ⋅mol ;该反应的平衡常数
;该反应的平衡常数
______ (用 、
、 、
、 表示)。
表示)。
(2)下列措施中,能提高(1)中 产率的有______(填字母)。
产率的有______(填字母)。
(3)一定温度下,将0.2 mol CO和0.1 mol 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内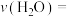
______ ,,CO的转化率为______ 。
(4)将合成气以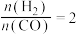 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: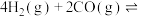

 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是______ (填字母)。
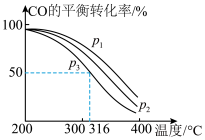
A.
B.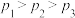
C.若在 和316℃时,起始时
和316℃时,起始时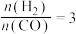 ,则平衡时,
,则平衡时,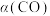 小于50%
小于50%
①

 kJ·mol
kJ·mol

②

 kJ⋅mol
kJ⋅mol

③

 kJ⋅mo
kJ⋅mo

回答下列问题:
(1)反应
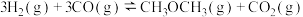 的
的
 ;该反应的平衡常数
;该反应的平衡常数
 、
、 、
、 表示)。
表示)。(2)下列措施中,能提高(1)中
 产率的有______(填字母)。
产率的有______(填字母)。| A.使用过量的CO | B.升高温度 | C.增大压强 | D.加入合适的催化剂 |
(3)一定温度下,将0.2 mol CO和0.1 mol
 通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得
通入2 L恒容密闭容器中,发生反应③,5 min后达到化学平衡,平衡后测得 的体积分数为0.1。则0~5 min内
的体积分数为0.1。则0~5 min内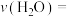
(4)将合成气以
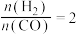 通入1 L的反应器中,一定条件下发生反应:
通入1 L的反应器中,一定条件下发生反应: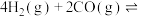

 ,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
,其中CO的平衡转化率随温度、压强的变化关系如图所示,下列说法正确的是
A.

B.
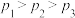
C.若在
 和316℃时,起始时
和316℃时,起始时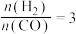 ,则平衡时,
,则平衡时,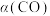 小于50%
小于50%
您最近一年使用:0次
解题方法
5 . 第19届亚运会在杭州奥体中心“大莲花”盛大开幕.此次杭州亚运会主火炬的燃料首次使用废碳再生的绿色甲醇,实现了循环内的零排放.我国科学家在含铂高效催化剂作用下把二氧化碳高效转化为清洁液态燃料——甲醇.
(1)该法利用 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: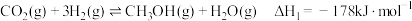
已知反应中相关的化学键键能数据如下:
由此计算断开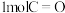 键需要吸收
键需要吸收__________  的能量(甲醇的结构式为
的能量(甲醇的结构式为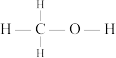 ).
).
(2)在 下,
下, 甲醇燃烧生成
甲醇燃烧生成 和液态水时放热
和液态水时放热 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为__________ .
(3)在钯基催化剂表面上,甲醇制氢的反应历程如下图所示,其中吸附在钯催化剂表面上的物种用*标注.
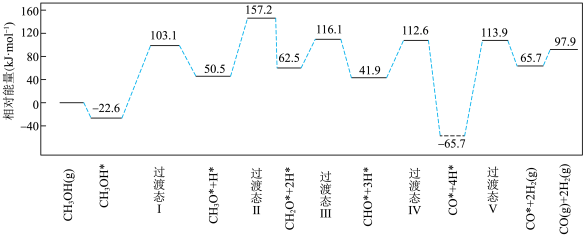
①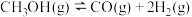 的
的
__________  ;催化剂对该反应的反应热
;催化剂对该反应的反应热__________ (填“有”或“无”)影响.
②该历程中最大能垒(活化能)
__________  ,该步骤的基元反应方程式为
,该步骤的基元反应方程式为__________ .
(1)该法利用
 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: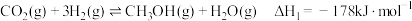
已知反应中相关的化学键键能数据如下:
化学键 |
|
|
|
|
|
键能/ | 348 | 413 | 436 | 358 | 463 |
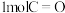 键需要吸收
键需要吸收 的能量(甲醇的结构式为
的能量(甲醇的结构式为 ).
).(2)在
 下,
下,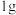 甲醇燃烧生成
甲醇燃烧生成 和液态水时放热
和液态水时放热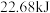 ,则表示甲醇燃烧热的热化学方程式为
,则表示甲醇燃烧热的热化学方程式为(3)在钯基催化剂表面上,甲醇制氢的反应历程如下图所示,其中吸附在钯催化剂表面上的物种用*标注.

①
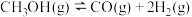 的
的
 ;催化剂对该反应的反应热
;催化剂对该反应的反应热②该历程中最大能垒(活化能)

 ,该步骤的基元反应方程式为
,该步骤的基元反应方程式为
您最近一年使用:0次
6 . 已知: 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式:
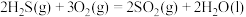
 ①
①

 ②
②

 ③
③
 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是
 与不足量的
与不足量的 反应时,生成S和
反应时,生成S和 。根据以下三个热化学方程式:
。根据以下三个热化学方程式: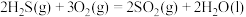
 ①
①
 ②
②
 ③
③ 、
、 、
、 三者大小关系正确的是
三者大小关系正确的是A.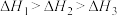 | B.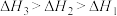 |
C.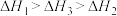 | D.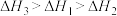 |
您最近一年使用:0次
2023-12-03更新
|
479次组卷
|
24卷引用:山东省聊城市2023-2024学年高二上学期11月期中考试化学试题
山东省聊城市2023-2024学年高二上学期11月期中考试化学试题江西省上饶县中学2017-2018学年高二上学期补考化学试题重庆市第三十中学2018-2019学年高二上学期第三次月考化学试题甘肃省古浪县第二中学2019-2020学年高二上学期基础知识竞赛化学试题福建省福州格致中学2021-2022学年高二上学期第一阶段测试化学试题(10月)山西省怀仁市2021-2022学年高二上学期期中化学试题广西钦州市2021-2022学年高二上学期期末考试化学试题第二节 反应热的计算 第2课时 反应热的计算甘肃省甘南藏族自治州合作第一中学2021-2022学年高二上学期期中考试化学试题(理)河南省濮阳市元龙高级中学2021-2022学年高二上学期期中考试化学试题贵州省部分学校2022-2023学年高二上学期10月联考化学试题贵州省“三新”改革联盟校联考2022-2023学年高二上学期期中考试化学试题陕西省咸阳市实验中学2021-2022学年高二上学期第三次月考化学试题湖南省怀化市雅礼实验学校2022-2023学年高二上学期第一次月考化学试题河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题章末检测卷(一) 化学反应的热效应广东省广州市执信中学2023-2024学年高二上学期10月选考化学试题安徽省无为襄安中学2022-2023学年高二下学期开学考试化学试题天津市南开区2023-2024学年高二上学期11月期中考试化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)江西省抚州市资溪县第一中学2023-2024学年高二上学期11月期中化学试题安徽省淮北市第一中学2023-2024学年高二下学期寒假自主学习质量评估化学试题江苏省淮安市涟水县第一中学2020届高三上学期第二次月考化学试题
名校
7 . 请回答下列问题:
(1)铋基催化剂对 电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。
电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。
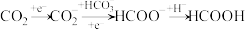
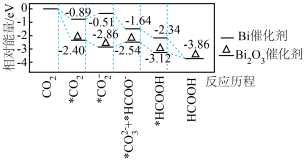
①制取HCOOH,写出效果更好的催化剂的化学式___________ ,并简述判断依据:___________ 。
②使用Bi催化剂时,最大能垒是___________ 。
③由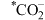 生成
生成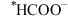 的反应为
的反应为___________ 。
(2)工业炼铁时常用CO还原铁矿粉,已知:
①
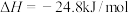
②
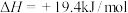
③
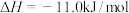
则反应 的
的
___________ 。
(3)正丁烷催化脱氢可得到2-丁烯,其有顺反异构,转化关系如左图所示。左图中三个反应的平衡常数的对数1gK与温度T的变化关系如右图所示,
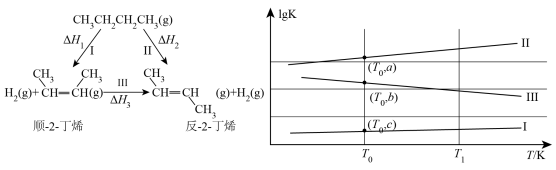
回答下列问题:
①图中b=___________ (用含a、c的代数式表示)。
②在 K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为___________ mol。
(1)铋基催化剂对
 电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。
电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。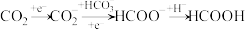

①制取HCOOH,写出效果更好的催化剂的化学式
②使用Bi催化剂时,最大能垒是
③由
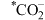 生成
生成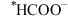 的反应为
的反应为(2)工业炼铁时常用CO还原铁矿粉,已知:
①

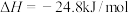
②

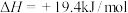
③

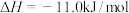
则反应
 的
的
(3)正丁烷催化脱氢可得到2-丁烯,其有顺反异构,转化关系如左图所示。左图中三个反应的平衡常数的对数1gK与温度T的变化关系如右图所示,

回答下列问题:
①图中b=
②在
 K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中
K时,向某密闭容器中加入2mol正丁烷,测得生成的顺-2-丁烯为0.15mol,则平衡体系中 为
为
您最近一年使用:0次
名校
解题方法
8 . 二氧化碳的综合利用是当下研究的重要课题。回答下列问题:
(1)已知下列热化学方程式:
反应Ⅰ:
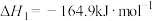
反应Ⅱ:

则反应

_____  。
。
(2)①向体积均为VL的恒压密闭容器中通入 、
、 ,分别在
,分别在 和
和 下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中
下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中 、CO、
、CO、 的影响,设这三种气体物质的量分数之和为1,其中CO和
的影响,设这三种气体物质的量分数之和为1,其中CO和 的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是
的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是_____ (填标号)。
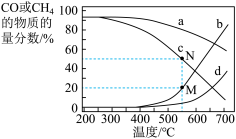
A. 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
②图中表示 时
时 的物质的量分数随温度变化关系的曲线是
的物质的量分数随温度变化关系的曲线是_____ (填字母),理由是_____ ;在N点所示条件下, 反应达到平衡,平衡时容器的体积为
反应达到平衡,平衡时容器的体积为_____ L,反应Ⅱ的
_____ 。(以分压表示,分压=总压×物质的量分数)
(3)一种从高炉气回收 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:

①某温度下,当吸收池中溶液的 时,此时该溶液中
时,此时该溶液中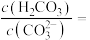
_____ [已知:该温度下 ,
, ]。
]。
②利用电化学原理控制反应条件能将 电催化还原为
电催化还原为 ,电解过程中还伴随着析氢反应,若生成
,电解过程中还伴随着析氢反应,若生成 的电解效率为80%,当电路中转移
的电解效率为80%,当电路中转移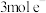 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加_____ g。[B的电解效率= ]。
]。
(1)已知下列热化学方程式:
反应Ⅰ:

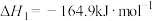
反应Ⅱ:


则反应


 。
。(2)①向体积均为VL的恒压密闭容器中通入
 、
、 ,分别在
,分别在 和
和 下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中
下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中 、CO、
、CO、 的影响,设这三种气体物质的量分数之和为1,其中CO和
的影响,设这三种气体物质的量分数之和为1,其中CO和 的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是
的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是
A.
 的消耗速率和
的消耗速率和 的消耗速率相等
的消耗速率相等B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
②图中表示
 时
时 的物质的量分数随温度变化关系的曲线是
的物质的量分数随温度变化关系的曲线是 反应达到平衡,平衡时容器的体积为
反应达到平衡,平衡时容器的体积为
(3)一种从高炉气回收
 制储氢物质
制储氢物质 的综合利用示意图如图所示:
的综合利用示意图如图所示:
①某温度下,当吸收池中溶液的
 时,此时该溶液中
时,此时该溶液中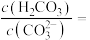
 ,
, ]。
]。②利用电化学原理控制反应条件能将
 电催化还原为
电催化还原为 ,电解过程中还伴随着析氢反应,若生成
,电解过程中还伴随着析氢反应,若生成 的电解效率为80%,当电路中转移
的电解效率为80%,当电路中转移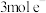 时,阴极室溶液的质量增加
时,阴极室溶液的质量增加 ]。
]。
您最近一年使用:0次
2023-11-23更新
|
223次组卷
|
3卷引用:山东省青岛第二中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
9 . 肼 在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。

已知200℃时:
反应Ⅰ: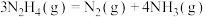
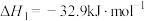
反应Ⅱ: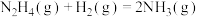
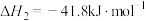
下列说法不正确的是
 在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
在不同条件下分解产物不同,200℃时在Cu表面分解的机理如图1。
已知200℃时:
反应Ⅰ:
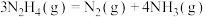
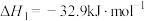
反应Ⅱ:
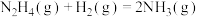
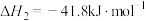
下列说法不正确的是
| A.图1所示过程①是放热反应、②是吸热反应。 |
| B.反应Ⅱ的能量过程示意图如图2所示 |
C.200℃时,肼分解生成氮气和氢气的热化学方程式为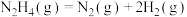 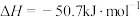 |
D.断开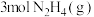 中的化学键吸收的能量小于形成 中的化学键吸收的能量小于形成 和 和 中的化学键释放的能量 中的化学键释放的能量 |
您最近一年使用:0次
2023-11-23更新
|
298次组卷
|
4卷引用:山东省青岛第二中学2023-2024学年高二上学期期中考试化学试卷
名校
解题方法
10 . 已知:
①
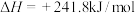
②
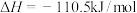
③
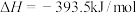
下列说法错误的是
①

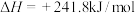
②

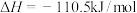
③

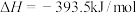
下列说法错误的是
| A.上述反应属于吸热反应的是① |
| B.表示C的燃烧热的热化学方程式是③ |
C.10g 完全燃烧生成水蒸气,放热2418kJ 完全燃烧生成水蒸气,放热2418kJ |
D.CO燃烧的热化学方程式为  |
您最近一年使用:0次
2023-11-14更新
|
150次组卷
|
5卷引用:山东省临沂市临沭第一中学2023-2024学年高二上学期12月月考化学试题








