名校
解题方法
1 . 下列说法不正确的是
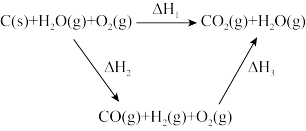

A.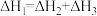 |
B.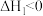 、 、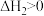 、 、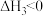 |
C.将煤转化为 和 和 后燃烧与煤直接燃烧放出的热量一样多 后燃烧与煤直接燃烧放出的热量一样多 |
| D.将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失 |
您最近一年使用:0次
2 . 乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。回答下列问题:
(1)已知:①C2H6(g) C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
②H2(g)+ O2(g)
O2(g) H2O(l) ΔH2=-285.8kJ·mol-1
H2O(l) ΔH2=-285.8kJ·mol-1
③C2H4(g)+3O2(g) 2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
则表示C2H6(g)摩尔燃烧焓的热化学方程式为_______ 。
(2)1000℃时,在某刚性容器内充入一定量的C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%。
①1000℃时,反应①的平衡常数Kp=_______ Pa[气体分压(Pa)=气体总压(Pa)×物质的量分数]。
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率_______ 40%(填“>”“<”或“=”)。
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+ O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,该反应的正活化能和逆活化能中较大的是
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,该反应的正活化能和逆活化能中较大的是_______ 。
(1)已知:①C2H6(g)
 C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1
C2H4(g)+H2(g) ΔH1=+136.8kJ·mol-1②H2(g)+
 O2(g)
O2(g) H2O(l) ΔH2=-285.8kJ·mol-1
H2O(l) ΔH2=-285.8kJ·mol-1③C2H4(g)+3O2(g)
 2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1
2CO2(g)+2H2O(1) ΔH3=-1411.0kJ·mol-1则表示C2H6(g)摩尔燃烧焓的热化学方程式为
(2)1000℃时,在某刚性容器内充入一定量的C2H6,只发生反应①,已知平衡时容器中总压为2.1×105Pa,乙烷的平衡转化率为40%。
①1000℃时,反应①的平衡常数Kp=
②若其他条件不变,刚性容器改为体积可变的密闭容器,则达到平衡时乙烷的转化率
(3)乙烷催化氧化裂解法是一种新型的制备乙烯的方法:C2H6(g)+
 O2(g)
O2(g) C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,该反应的正活化能和逆活化能中较大的是
C2H4(g)+H2O(g) ΔH=-149kJ·mol-1,该反应的正活化能和逆活化能中较大的是
您最近一年使用:0次
名校
3 . 多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为____ 。
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) △H3
3SiHCl3(g) △H3
反应③的△H3____ 0(填“>”或“<”)。
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有____ (填化学式)。
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
则SiO2与SiC中比较稳定的是____ (填化学式),工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),该反应的△H=____ 。(提示:1mol晶体Si中含有2molSi-Si键)

回答下列问题:
(1)硅粉与HCl在300℃时反应生成SiHCl3气体和H2,当有1gSi反应时放出8.4kJ热量,该反应的热化学方程式为
(2)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) △H1>0
SiHCl3(g)+HCl(g) △H1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) △H2<0
4SiHCl3(g) △H2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) △H3
3SiHCl3(g) △H3反应③的△H3
(3)由粗硅制备多晶硅过程中循环使用的物质除SiCl4、SiHCl3、Si外,还有
(4)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,利用键能可以衡量化学键的强弱,也可以计算化学反应的焓变。已知:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
您最近一年使用:0次
2022-09-25更新
|
266次组卷
|
4卷引用:福建省泉州第五中学2022-2023学年高二上学期期中考化学试题
4 . I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+H2O(g) CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) △H3③
2CO(g)+2H2(g) △H3③
则反应①自发进行的条件是____ ,△H3=____ kJ·mol-1。
II.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氮的体积分数(φ)如图所示。
①其中,p1、p2和p3由大到小的顺序是____ ,其原因是____ 。
②若分别用VA(N2)和VB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(N2)____ VB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为104Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为_____ Pa(分压=总压×物质的量分效,保留一位小数)。
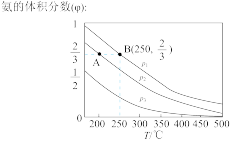
III.以连二硫酸根(S2O )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
(3)①阴极区的电极反应式为____ 。
②NO吸收转化后的主要产物为NH ,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为____ mL。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)
 CO(g)+3H2(g) △H1=+205.9kJ·mol-1①
CO(g)+3H2(g) △H1=+205.9kJ·mol-1①CO(g)+H2O(g)
 CO2(g)+H2(g) △H2=-41.2kJ·mol-1②
CO2(g)+H2(g) △H2=-41.2kJ·mol-1②二氧化碳重整:CH4(g)+CO2(g)
 2CO(g)+2H2(g) △H3③
2CO(g)+2H2(g) △H3③则反应①自发进行的条件是
II.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1mol、0.3mol时,平衡后混合物中氮的体积分数(φ)如图所示。

①其中,p1、p2和p3由大到小的顺序是
②若分别用VA(N2)和VB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(N2)
③若在250℃、p1为104Pa条件下,反应达到平衡时容器的体积为1L,则该条件下B点N2的分压p(N2)为
III.以连二硫酸根(S2O
 )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
(3)①阴极区的电极反应式为
②NO吸收转化后的主要产物为NH
 ,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
,若通电时电路中转移了0.3mole-,则此通电过程中理论上吸收的NO在标况下的体积为
您最近一年使用:0次
2022-09-22更新
|
108次组卷
|
8卷引用:福建省宁德第一中学2022-2023学年高二上学期第二次月考化学试题
福建省宁德第一中学2022-2023学年高二上学期第二次月考化学试题福建泉州实验中学2021-2022学年高三上学期12月月考化学试题广东省揭阳市2018高三高考第一次模拟考试理综化学试题云南省昆明市寻甸一中2020届高三第一次全真模拟考试理综化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题山西省太原市第五中学2021-2022学年上学期高三第四次模块诊断化学试题(已下线)一轮巩固卷10-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-练习
名校
解题方法
5 . 完成下列问题
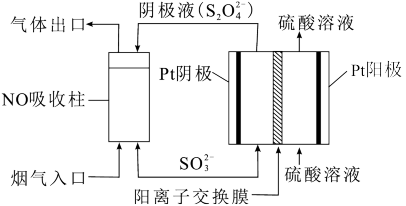
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量。已知白磷和 的分子结构如图所示:
的分子结构如图所示:

现提供以下化学键的键能 :
: ,
,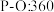 ;
; 。则
。则 (白磷)氧化生成
(白磷)氧化生成 的热化学方程式为
的热化学方程式为_______
(2)在 、
、 时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。已知:1g液体甲醇燃烧生成
时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。已知:1g液体甲醇燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______
(3)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
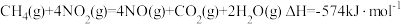
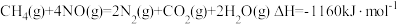
则甲烷直接将 还原为
还原为 的热化学方程式为:
的热化学方程式为:_______
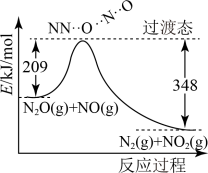
(4)由 和NO反应生成
和NO反应生成 和
和 的能量变化如图所示若生成
的能量变化如图所示若生成 其
其
_______ 
(5) 可用于甲醇和甲醚,其反应为(m、n均大于0):
可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①: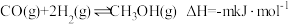
反应②:
反应③: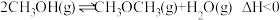
则表示m与n的关系的代数式为_______
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量。已知白磷和
 的分子结构如图所示:
的分子结构如图所示:
现提供以下化学键的键能
 :
: ,
, ;
; 。则
。则 (白磷)氧化生成
(白磷)氧化生成 的热化学方程式为
的热化学方程式为(2)在
 、
、 时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。已知:1g液体甲醇燃烧生成
时,1mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热。已知:1g液体甲醇燃烧生成 和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为
和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为(3)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
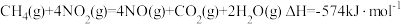
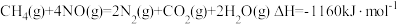
则甲烷直接将
 还原为
还原为 的热化学方程式为:
的热化学方程式为:(4)由
 和NO反应生成
和NO反应生成 和
和 的能量变化如图所示若生成
的能量变化如图所示若生成 其
其


(5)
 可用于甲醇和甲醚,其反应为(m、n均大于0):
可用于甲醇和甲醚,其反应为(m、n均大于0):反应①:
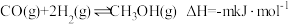
反应②:

反应③:
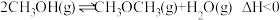
则表示m与n的关系的代数式为
您最近一年使用:0次
6 . 回答下列问题
(1)下列变化过程属于放热反应的是_________ 。
①2Al + Fe2O3 2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
(2)CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
则ΔH1_______ ΔH2(填“>”、“<”或“=”)。
(3)已知1g苯燃烧生成二氧化碳和气态水时放出a kJ热量,1mol液态水气化需要吸收b kJ热量,请写出苯的燃烧热的热化学方程__________________ 。
(4)让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g) + O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=
O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=  S2(g) + 2H2O(g) ΔH2
S2(g) + 2H2O(g) ΔH2
③H2S(g) + O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
则ΔH4的表达式为________________ 。
(5)CO(g)和CH3OH(l)的摩尔燃烧焓ΔH分别为a kJ·mol-1和b kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和1mol液态水的ΔH=__________ 。
(6)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4—CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①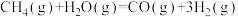
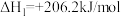
②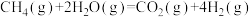
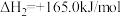
写出该催化重整反应的热化学方程式:_____________ 。
(1)下列变化过程属于放热反应的是
①2Al + Fe2O3
 2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌
2Fe + Al2O3 ②酸碱中和反应 ③浓H2SO4稀释 ④醋酸电离 ⑤NH4Cl晶体与Ba(OH)2·8H2O混合搅拌(2)CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
则ΔH1
(3)已知1g苯燃烧生成二氧化碳和气态水时放出a kJ热量,1mol液态水气化需要吸收b kJ热量,请写出苯的燃烧热的热化学方程
(4)让生态环境更秀美、人民生活更幸福!为此,天津冬季取暖许多家庭用上了清洁能源天然气。实际生产中天然气需要脱硫,在1200℃时,工艺中会发生下列反应:
①H2S(g) +
 O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=
O2(g)= SO2(g) + H2O(g) ΔH1 ②2H2S(g) + SO2(g)=  S2(g) + 2H2O(g) ΔH2
S2(g) + 2H2O(g) ΔH2③H2S(g) +
 O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4
O2(g)= S(g) + H2O(g) ΔH3 ④2S(g) = S2(g) ΔH4则ΔH4的表达式为
(5)CO(g)和CH3OH(l)的摩尔燃烧焓ΔH分别为a kJ·mol-1和b kJ·mol-1,则甲醇不完全燃烧生成一氧化碳和1mol液态水的ΔH=
(6)对温室气体CO2进行减排和综合治理具有十分重要的意义。CH4—CO2催化重整不仅对温室气体的减排具有重要意义,还可以得到合成气(CO和H2)。
已知:①
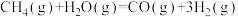
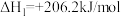
②
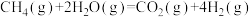
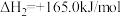
写出该催化重整反应的热化学方程式:
您最近一年使用:0次
7 . 纳米级Cu2O由于具有优良的催化性能而受关注,表中为制取Cu2O的两种方法:
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成____ 而使Cu2O产率降低。
(2)已知:①2Cu(s)+ O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1
②C(s)+ O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=____ 。
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:
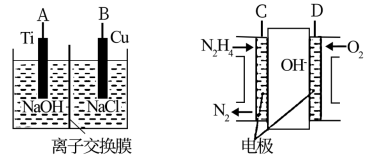
①上述装置中B电极应连____ (填“C”或“D”)电极。
②该离子交换膜为____ (填“阴”或“阳”)离子交换膜,该电解池的阴极反应式____ 。
③原电池中负极反应式为____ 。
| 方法a | 用炭粉在高温条件下还原CuO |
| 方法b | 电解法,反应为2Cu+H2O Cu2O+H2↑ Cu2O+H2↑ |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成
(2)已知:①2Cu(s)+
 O2(g)=Cu2O(s) △H1=-169kJ·mol-1
O2(g)=Cu2O(s) △H1=-169kJ·mol-1②C(s)+
 O2(g)=CO(g) △H2=-110.5kJ·mol-1
O2(g)=CO(g) △H2=-110.5kJ·mol-1③Cu(s)+
 O2(g)=CuO(s) △H3=-157kJ·mol-1
O2(g)=CuO(s) △H3=-157kJ·mol-1则方法a中发生的反应:2CuO(s)+C(s)=Cu2O(s)+CO(g) △H=
(3)方法b是用液态肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH—的浓度来制备纳米Cu2O,装置如图所示:

①上述装置中B电极应连
②该离子交换膜为
③原电池中负极反应式为
您最近一年使用:0次
名校
解题方法
8 . 完成下列问题。
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:_______ 。
②该实验①、②可探究_______ 对反应速率的影响,因此V3是_______ ;实验①、③可探究_______ 对反应速率的影响,因此V5是_______ 。
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
①该反应的化学平衡常数表达式为K=_______ 。
②该反应为_______ 反应(填“吸热”或“放热”)。
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为_______ ℃。
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向_______ (填“正向”或“逆向”)进行。
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1_______ ΔH2(填“>”或“<”)。
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
(1)某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下系列实验:
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(1)①写出硫代硫酸钠与稀硫酸反应的化学方程式:
②该实验①、②可探究
(2)在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)⇌CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表所示:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①该反应的化学平衡常数表达式为K=
②该反应为
③某温度下,平衡浓度符合下式:c(CO2)∙c(H2)=c(CO)∙c(H2O),试判断此时的温度为
④在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)=2mol/L,c(H2)=1.5mol/L,c(CO)=1mol/L,c(H2O)=3mol/L,则下一时刻,反应向
(3)已知常温时红磷比白磷稳定,比较下列反应中ΔH的大小:ΔH1
①P4(白磷,s)+5O2(g)=2P2O5(s) ΔH1
②4P(红磷,s)+5O2(g)=2P2O5(s) ΔH2
您最近一年使用:0次
2022-08-29更新
|
170次组卷
|
2卷引用:福建省三明第一中学2022-2023学年高二上学期第一次月考化学试题
名校
9 . 我国科学家实现了在铜催化剂条件下将DMF[(CH3)2NCHO]转化为三甲胺[N(CH3)3]。计算机模拟单个DMF分子在铜催化剂表面的反应历程如图所示,下列说法正确的是
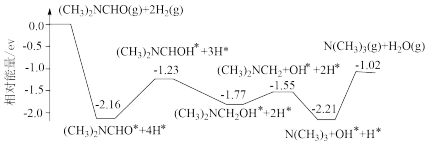

| A.该历程中最小能垒的化学方程式为 (CH3)2NCH2OH*=(CH3)2NCH2+OH* |
| B.该历程中最大能垒(活化能)为2.16eV |
| C.该反应热化学方程式为(CH3)2NCHO(g)+2H2(g)=N(CH3)3(g)+H2O(g) ΔH=-1.02ev•mol-1 |
| D.增大压强或升高温度均能加快反应速率,并增大DMF平衡转化率 |
您最近一年使用:0次
2022-08-24更新
|
780次组卷
|
29卷引用:福建省南安市华侨中学2023-2024学年高二上学期10月月考化学试题
福建省南安市华侨中学2023-2024学年高二上学期10月月考化学试题福建省德化一中、永安一中、漳平一中三校协作2023-2024学年高二上学期12月联考化学试题河北省张家口市宣化一中2020-2021学年高二下学期期初考试化学试题河南省顶尖名校联盟2021-2022学年高二下学期联赛考试化学试题山西省运城市教育发展联盟2021-2022学年高二上学期11月期中检测化学试题湖南省株洲市第二中学2022-2023学年高二上学期期中考试化学试题湖南省株洲南方中学2022-2023学年高二上学期期中考试化学试题山东省青岛第二中学2021-2022学年高二上学期期中考试化学试题(已下线)广西“贵百河”2023-2024学年高二上学期12月份联考化学试题山东省德州市实验中学2023-2024学年高二上学期期中考试 化学试题山东省威海市2020届高三年级高考模拟考(二模)化学试题(已下线)专题07 化学反应中的能量变化-2020年高考真题和模拟题化学分项汇编浙江省杭州第二中学2021届高三上学期期中考试化学试题(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密08 化学反应与能量(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省绍兴市第一中学2020-2021学年高三1月高考适应性考试化学试题(已下线)押全国卷理综第13题 反应机理图分析、能垒图分析等创新题型及阿伏伽德罗常数-备战2021年高考化学临考题号押题(课标全国卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)湖南省长沙市雅礼中学2021-2022学年高三上学期月考卷(三)化学试题辽宁省大连市第一中学 2021-2022学年高三上学期期中联考化学试题(已下线)卷04 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)2022年湖南卷高考真题变式题(11-14)(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)辽宁省大连市普兰店区第一中学2022届高三上学期期中联考化学试题湖南省邵阳市第二中学2022届高三下学期全真模拟考试化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用北京市第二十中学2022-2023学年高三下学期开学检测化学试题(已下线)查补易混易错04 化学反应原理部分-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)
10 . 全球变暖是人类行为造成地球气候变化的后果,随着石油、煤炭、木材等含“碳”自然资源的过度使用,导致地球暖化的“元凶”二氧化碳也制造得越来越多,减少二氧化碳排放刻不容缓。回答下列问题:
(1)二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=
CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=_______ 。
(2)当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:
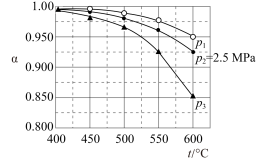
则反应在0.5MPa,550°C时的α=_______ ,判断的依据是_______ ,影响α的因素有_______ (答出一点即可)。
(3)将组成(物质的量分数)为0.2mol CO2(g),0.6mol H2(g)和0.1mol N2(g)通入反应器,按(1)中的反应原理,在温度T,恒定压强为p的条件下反应,平衡时若H2的转化率为50%,则CH3OH(g)的压强为_______ ,平衡常数Kp=_______ (以分压表示,分压=总压×气体物质的量分数)。
(4)根据相关文献报道,我国科学家设计了CO2熔盐捕获与电化学转化装置,原理如下图所示:
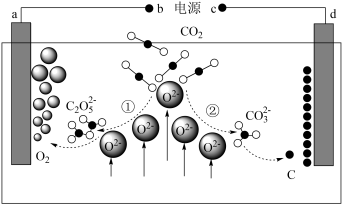
则b为电源_______ 极(填“正”或“负"),电路中转移0.4mol电子可捕获CO2的体积(标况下)为_______ L。
(1)二氧化碳可催化加氢以制备甲醇:CO2(g)+3H2(g)
 CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=
CH3OH(g)+H2O(l)。已知氢气的燃烧热为285.8kJ/mol,甲醇(液态)的燃烧热为725.8kJ/mol,1mol液态甲醇转变为气态需吸热35.5kJ,计算以上甲醇制备反应的ΔH=(2)当二氧化碳和氢气起始投料比n(CO2):n(H2)=1:2时,在0.5MPa、2.5MPa、5MPa压强下,H2.的平衡转化率α随温度变化如图所示:

则反应在0.5MPa,550°C时的α=
(3)将组成(物质的量分数)为0.2mol CO2(g),0.6mol H2(g)和0.1mol N2(g)通入反应器,按(1)中的反应原理,在温度T,恒定压强为p的条件下反应,平衡时若H2的转化率为50%,则CH3OH(g)的压强为
(4)根据相关文献报道,我国科学家设计了CO2熔盐捕获与电化学转化装置,原理如下图所示:

则b为电源
您最近一年使用:0次
2022-06-27更新
|
343次组卷
|
3卷引用:福建省南安市华侨中学2023-2024学年高二上学期10月月考化学试题



