解题方法
1 . 氮元素在工业应用上有重要地位,回答下列问题:
(1)理论研究表明,在101 kPa和298K下,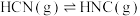 异构化反应的能量变化如图。
异构化反应的能量变化如图。
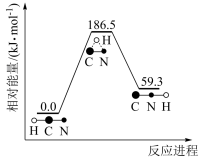
①稳定性:HCN_______ HNC(填“>”、“<”或“=”)。
②该异构化反应的△H=_______ 
(2)“长征2F”运载火箭使用N2O4和C2H8N2 (偏二甲册)作推进剂。12.0 g液态C2H8N2在液态N2O4中燃烧生成CO2、N2、H2O三种气体,放出510 kJ热量。该反应的热化学方程式为_______ 。
(3)科学家用氮气和氢气制备肼,过程如下:

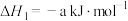
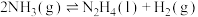
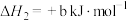
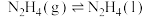
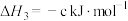
则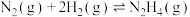 △H=
△H=_______ kJ/mol(用含a、b、c的计算式表示)
(1)理论研究表明,在101 kPa和298K下,
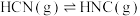 异构化反应的能量变化如图。
异构化反应的能量变化如图。
①稳定性:HCN
②该异构化反应的△H=

(2)“长征2F”运载火箭使用N2O4和C2H8N2 (偏二甲册)作推进剂。12.0 g液态C2H8N2在液态N2O4中燃烧生成CO2、N2、H2O三种气体,放出510 kJ热量。该反应的热化学方程式为
(3)科学家用氮气和氢气制备肼,过程如下:

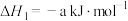
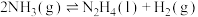
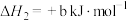
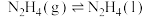
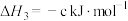
则
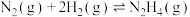 △H=
△H=
您最近一年使用:0次
2 . 化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,1g甲醇 在氧气中充分燃烧生成二氧化碳和液态水释放出
在氧气中充分燃烧生成二氧化碳和液态水释放出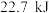 的热量,写出甲醇燃烧的热化学方程式
的热量,写出甲醇燃烧的热化学方程式_______ 。
(2)已知反应CH3-CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
试计算该反应的反应热
_______ 。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变
_______ 。
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
(4)根据能量变化示意图:
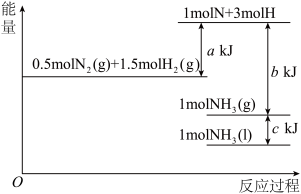
写出N2(g)+3H2(g)=2NH3(l)
_______ 
(1)实验测得,1g甲醇
 在氧气中充分燃烧生成二氧化碳和液态水释放出
在氧气中充分燃烧生成二氧化碳和液态水释放出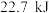 的热量,写出甲醇燃烧的热化学方程式
的热量,写出甲醇燃烧的热化学方程式(2)已知反应CH3-CH3(g) → CH2=CH2(g)+H2(g),有关化学键的键能如下。
| 化学键 | C-H |  | 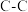 | H-H | |
键能 | 414.4 | 615.3 | 347.3 | 435.3 |

(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的焓变

①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+
 O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1(4)根据能量变化示意图:

写出N2(g)+3H2(g)=2NH3(l)


您最近一年使用:0次
解题方法
3 . 氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)已知: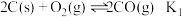

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)
①则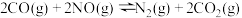 的平衡常数为K,则
的平衡常数为K,则
_______ (用 、
、 、
、 表示)。
表示)。
②在一个恒温恒容的密闭容器中发生反应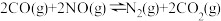 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有_______ (填字母)。
A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.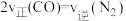 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。
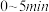 内,以
内,以 表示的平均反应速率
表示的平均反应速率
_______ ,最终达平衡时 的浓度
的浓度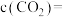
_______ ,平衡时 的转化率
的转化率
_______ ,写出该反应平衡常数的表达式
_______ ,并求该温度 下的平衡常数
下的平衡常数
_______ 。
(1)已知:
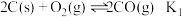

 (其中
(其中 、
、 、
、 为对应化学反应的平衡常数)
为对应化学反应的平衡常数)①则
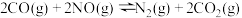 的平衡常数为K,则
的平衡常数为K,则
 、
、 、
、 表示)。
表示)。②在一个恒温恒容的密闭容器中发生反应
 。能表明反应已达到平衡状态的标志有
。能表明反应已达到平衡状态的标志有A.混合气体的压强保持不变 B.混合气体的密度保持不变
C.混合气体的平均相对分子质量保持不变 D.气体的总质量保持不变
E.
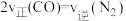 F.
F. 内生成
内生成 同时消耗
同时消耗
(2)向容积为
 的密闭容器中加入活性炭(足量)和
的密闭容器中加入活性炭(足量)和 ,发生反应
,发生反应 ,
, 和
和 的物质的量变化如表所示。
的物质的量变化如表所示。| 条件 | 保持温度为 | ||||||
时间/ | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
物质的量/ | 2.0 | 1.4 | 1.0 | 0.70 | 0.50 | 0.40 | 0.40 |
物质的量/ | 0 | 0.30 | 0.50 | 0.65 | 0.75 | 0.80 | 0.80 |
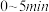 内,以
内,以 表示的平均反应速率
表示的平均反应速率
 的浓度
的浓度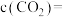
 的转化率
的转化率

 下的平衡常数
下的平衡常数
您最近一年使用:0次
2023-02-18更新
|
135次组卷
|
3卷引用:福建省福州市三校2022-2023学年高二上学期期中联考化学试题
福建省福州市三校2022-2023学年高二上学期期中联考化学试题广西北海市2022-2023学年高二上学期期末考试化学试题(已下线)专题04 可逆反应、化学平衡状态、化学平衡常数【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
4 . 一碳化学技术是指以分子中只含一个碳原子的化合物如一氧化碳、二氧化碳、甲烷、甲醇等为原料,用化工的方法制造产品的化学体系的总称,一碳化学技术的应用对构建生态文明社会具有重要的意义。
(1) 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:
I、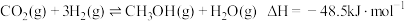
II、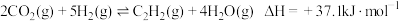
反应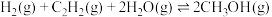 的
的
___________ 。升高温度,反应速率先增大后减小的原因是___________ , 含量
含量___________ (填“增多”或“不变”或“减少”)。
(2)在压强、 、
、 的起始投料一定的条件下,发生反应I、II,实验测得
的起始投料一定的条件下,发生反应I、II,实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
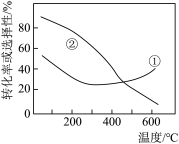
已知:
其中曲线②表示___________ 平衡时的选择性;温度高于 时,曲线①随温度升高而升高的原因是
时,曲线①随温度升高而升高的原因是___________ ;为同时提高 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为___________ (填标号)。
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压。
(1)
 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:I、
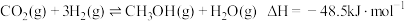
II、
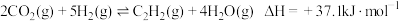
反应
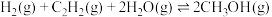 的
的
 含量
含量(2)在压强、
 、
、 的起始投料一定的条件下,发生反应I、II,实验测得
的起始投料一定的条件下,发生反应I、II,实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
已知:

其中曲线②表示
 时,曲线①随温度升高而升高的原因是
时,曲线①随温度升高而升高的原因是 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压。
您最近一年使用:0次
11-12高二下·北京·期中
名校
解题方法
5 . 已知反应:①
 ,
,
②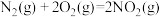
 ,
,
③
 ,
,
则反应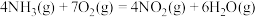 的
的 为
为

 ,
,②
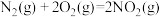
 ,
,③

 ,
,则反应
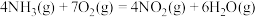 的
的 为
为A.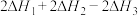 | B. |
C.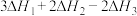 | D.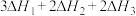 |
您最近一年使用:0次
2023-01-20更新
|
604次组卷
|
54卷引用:福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题
福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题(已下线)2011-2012学年北京市101中学高二下学期期中考试化学试卷2015-2016学年山东省济宁任城区高二上学期统考化学试卷吉林省长春市田家炳实验中学2018-2019学年高二上学期第一学程检测化学试题【全国百强校】山西省太原市第五中学2018-2019学年高二(理)上学期10月月考化学试题【全国百强校】江西省金溪县第一中学2018-2019学年高二上学期12月月考化学试题宁夏长庆高级中学2019-2020学年高二上学期第一次月考化学试题黑龙江省双鸭山市第一中学2019-2020学年高二上学期期中考试化学试题云南省迪庆州香格里拉中学2019-2020学年高二上学期期末考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期12月月考化学试题(已下线)1.1.3 反应焓变的计算 练习——【高中新教材同步备课】鲁科版高中化学选择性必修1安徽省合肥市第九中学2020-2021学年高二上学期第一次月考化学试题(已下线)【南昌新东方】9.湾里一中 梁莎(已下线)【浙江新东方】48鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 第1节 化学反应的热效应 课时4 反应焓变的计算人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 课时1 盖斯定律安徽省六安市舒城育才学校2020-2021学年高二12月月考化学试题黑龙江省大庆中学2021-2022学年高二上学期开学考试化学试题云南省楚雄师范学院附属中学2020-2021学年高二上学期期中考试化学试题天津市南开中学2021-2022学年高二上学期期中检测化学试题江西省吉安市永新中学2021-2022学年高二上学期期中考试化学(理科)试题吉林省延边朝鲜族自治州汪清县汪清第四中学2021-2022学年高二上学期第二次阶段考试化学试题(已下线)1.2.2 化学反应焓变的计算-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)辽宁省辽河油田第二高级中学2022-2023学年高二上学期开学考试化学试题湖南省涟源市第二中学2021-2022学年高二上学期期中考试化学试题黑龙江省牡丹江市海林市朝鲜族中学2022-2023学年高二上学期第一次月考化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高二上学期第一次月考化学试题陕西省宝鸡市千阳县中学2022-2023学年高二上学期第一次月考(理)化学试题广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(期末考)化学试题吉林省洮南市第一中学2022-2023学年高二上学期第一次(10月)月考化学试题甘肃省靖远县第二中学2021-2022学年高二上学期期中考试化学(理)试题黑龙江省哈尔滨市宾县第二中学2021-2022学年高二上学期第二次月考化学试题吉林省长春市九台区营城第一高级中学2022-2023学年高二上学期第一次月考化学试题(已下线)专题02 盖斯定律、反应热的计算【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)江西省抚州市2023-2024学年高二上学期学生学业质量监测化学试题青海省西宁北外附属新华联外国语高级中学2023-2024学年高二上学期期中考试化学试题江西省南昌十九中2022-2023学年高二上学期期末考试化学试卷 湖南省长沙市德成学校2023-2024学年高二上学期1月期末化学试题(已下线)2014届黑龙江省哈六中高三上学期期中考试化学试卷2017届河北省武邑中学高三上学期第一次调研化学试卷辽宁省庄河市高级中学2016-2017学年高一下学期期中考试化学试题【全国校级联考】安徽省淮北十二中、濉溪二中2017-2018学年高一下学期期中联考化学试题吉林省长春汽车经济开发区第六中学2017-2018学年高一下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期10月月考化学试题吉林省乾安县第七中学2018-2019学年高一下学期第二次质量检测化学试题安徽省砀山县第二中学2020届高三上学期第四次月考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】2020届高三化学知识点强化训练—盖斯定律河南省鹤壁市高中2019-2020学年高一下学期第一次段考化学试题安徽省怀宁县第二中学2021-2022学年高三上学期期末考试化学试题湖北省2022-2023学年高三上学期期末考试化学试题辽宁省沈阳市郊校2022-2023学年高一下学期4月联考化学试题河北省邢台市2022-2023学年高一下学期6月月考化学试题
解题方法
6 . Ⅰ、工业上利用 和
和 在催化剂作用下合成甲醇
在催化剂作用下合成甲醇 。
。
已知相关物质的摩尔燃烧焓(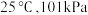 ):数据如下表所示:
):数据如下表所示:
(1)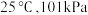 时,由
时,由 和
和 合成
合成 的热化学方程式为
的热化学方程式为___ 。
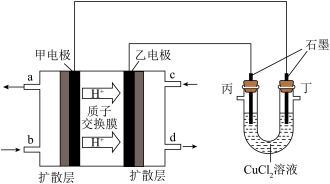
Ⅱ、某研究小组以甲醇—空气燃料电池为电源,用石墨电极持续电解 溶液,装置如下图所示。
溶液,装置如下图所示。
实验现象记录如下:
(2)甲电极的电极反应式为___________ ;当通入 (折算为标准状况下)甲醇蒸汽,测得电路中转移
(折算为标准状况下)甲醇蒸汽,测得电路中转移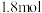 电子,则甲醇的利用率为
电子,则甲醇的利用率为___________ 。
(3)通电前 溶液呈酸性的原因:
溶液呈酸性的原因:___________ (用离子方程式表示)。
(4) 时丁电极的电极反应式为
时丁电极的电极反应式为___________ 。
(5)从丁电极刮取白色固体(含少量红色固体),经检验含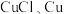 。针对
。针对 固体是如何产生的,某兴趣小组提出两种假设。
固体是如何产生的,某兴趣小组提出两种假设。
假设1:由电极反应产生: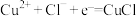
假设2:由反应___________ 产生(用离子方程式表示)。
(6)镀铜工业中,电镀液以 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,反应的离子方程式为
(微溶)固体能有效解决该问题,反应的离子方程式为___________ 。
 和
和 在催化剂作用下合成甲醇
在催化剂作用下合成甲醇 。
。已知相关物质的摩尔燃烧焓(
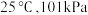 ):数据如下表所示:
):数据如下表所示:| 物质 |  |  | 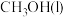 |
摩尔燃烧焓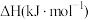 |  |  |  |
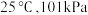 时,由
时,由 和
和 合成
合成 的热化学方程式为
的热化学方程式为Ⅱ、某研究小组以甲醇—空气燃料电池为电源,用石墨电极持续电解
 溶液,装置如下图所示。
溶液,装置如下图所示。
实验现象记录如下:
| 时刻 | 实验现象 | |
| 通电前 |  溶液呈绿色,显酸性 溶液呈绿色,显酸性 | |
 | 丙电极产生气体 | 丁电极底部出现少量红色固体,电极周围溶液变棕黑色 |
 | 丙电极产生气体 | 丁电极产生白色固体 |
| … | …… | |
 | 丙电极产生气体 | 丁电极产生气体 |
 (折算为标准状况下)甲醇蒸汽,测得电路中转移
(折算为标准状况下)甲醇蒸汽,测得电路中转移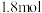 电子,则甲醇的利用率为
电子,则甲醇的利用率为(3)通电前
 溶液呈酸性的原因:
溶液呈酸性的原因:(4)
 时丁电极的电极反应式为
时丁电极的电极反应式为(5)从丁电极刮取白色固体(含少量红色固体),经检验含
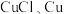 。针对
。针对 固体是如何产生的,某兴趣小组提出两种假设。
固体是如何产生的,某兴趣小组提出两种假设。假设1:由电极反应产生:
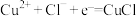
假设2:由反应
(6)镀铜工业中,电镀液以
 、
、 为主,同时含
为主,同时含 和添加剂。过多的
和添加剂。过多的 会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量
会使镀层出现白色胶状薄膜,电镀前向电镀液中加入适量 (微溶)固体能有效解决该问题,反应的离子方程式为
(微溶)固体能有效解决该问题,反应的离子方程式为
您最近一年使用:0次
名校
7 . 合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:N2(g)+3H2(g) 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;
2H2(g)+O2(g) 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1
(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是___________ 。
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
该条件下H2的转化率为___________ (可用分数表示),平衡常数K=___________ (可用分数表示)。
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。
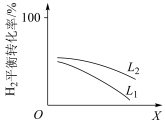
i.X代表的物理量是___________ 。
ii.判断L1、L2的大小关系,并简述理由___________ 。
已知:N2(g)+3H2(g)
 2NH3(g) ∆H1=-a kJ∙mol-1;
2NH3(g) ∆H1=-a kJ∙mol-1;2H2(g)+O2(g)
 2H2O(l) ∆H2=-b kJ∙mol-1
2H2O(l) ∆H2=-b kJ∙mol-1(1)有研究报道,在常温、常压、光照条件下,N2在特殊催化剂表面与H2O反应可生成NH3。则由N2与H2O反应生成NH3的热化学方程式是
(2)工业上主要以N2(g)、H2(g)为原料气合成NH3。
①将物质的量之比为1:3的N2和H2充入2L的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
物质 | N2 | H2 | NH3 |
平衡时物质的量/mol | 0.2 | 0.6 | 0.2 |
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 | N2 | H2 | NH3 |
起始浓度(mol/L) | 0.5 | 1.5 | 0.5 |

i.X代表的物理量是
ii.判断L1、L2的大小关系,并简述理由
您最近一年使用:0次
解题方法
8 . 填空。
(1)25℃、101KPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式_______ 。
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=_______ kJ∙mol-1。
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
则N2(g)+O2(g)=2NO(g) ΔH=_______ kJ·mol-1。
(1)25℃、101KPa时,26gC2H2气体完全燃烧生成二氧化碳气体和液态水放出1299.6kJ的热,写出该反应的热化学方程式
(2)研究NO2、SO2等大气污染气体的处理方法具有重要的意义。
已知:①2SO2(g)+O2(g)⇌2SO3(g) ∆H1=-196kJ∙mol-1
②2NO(g)+O2(g)⇌2NO2(g) ∆H2=-113.0kJ∙mol-1
则反应NO2(g)+SO2(g)⇌SO3(g)+NO(g)的∆H=
(3)已知拆开1mol下列气态分子形成独立的气态原子时需要的能量数据如表。
| 物质 | N2 | O2 | NO |
| 能量(kJ·mol-1) | 946 | 498 | 632 |
您最近一年使用:0次
名校
解题方法
9 . 能源是现代社会发展的支柱之一,请按要求完成以下填空:
(1)下列反应中,属于放热反应的是_______ (填序号)。
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式_______ 。
(3)实验测得,1g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇摩尔燃烧焓的热化学方程式:_______ 。
(4)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量。试写出反应过程中的热化学方程式:_______ 。
(5)将 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:

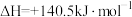
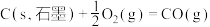
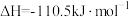
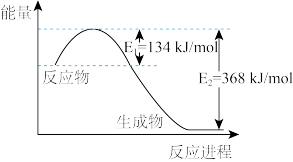
则反应 的
的 是
是_______
(6)工业上用二氧化碳催化加氢可合成乙醇,过程能量变化如图所示,其反应原理为2CO2(g)+6H2(g) C2H5OH(g)+3H2O(g) △H。该反应的△H
C2H5OH(g)+3H2O(g) △H。该反应的△H_______ (填“>”、“<”或“=”)0;其正反应在_______ (填“高温”“低温”或“任何温度”)下能自发进行。
(1)下列反应中,属于放热反应的是
a.Ba(OH)2•8H2O与NH4Cl混合搅拌 b.高温煅烧石灰石 c.铝与盐酸反应
(2)已知稀溶液中,1mol H2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
(3)实验测得,1g甲醇(CH3OH,常温下为液态)在氧气中充分燃烧生成二氧化碳和液态水释放出22.7kJ的热量,试写出甲醇摩尔燃烧焓的热化学方程式:
(4)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量。试写出反应过程中的热化学方程式:
(5)将
 转化为
转化为 是工业冶炼金属钛的主要反应之一。已知:
是工业冶炼金属钛的主要反应之一。已知:
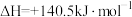
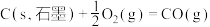
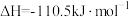
则反应
 的
的 是
是(6)工业上用二氧化碳催化加氢可合成乙醇,过程能量变化如图所示,其反应原理为2CO2(g)+6H2(g)
 C2H5OH(g)+3H2O(g) △H。该反应的△H
C2H5OH(g)+3H2O(g) △H。该反应的△H
您最近一年使用:0次
解题方法
10 . 填空。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=_______ 。
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:
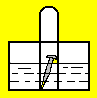
若液面上升,发生_______ 腐蚀(填“析氢”或“吸氧”),负极电极反应式:_______ ,正极电极反应式:_______
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是_______ 。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知①2CH4(g)+ 3O2(g) = 2 CO(g)+ 4 H2O(l) △H1 = -1214.6 kJ/mol
②2 CO(g)+ O2(g) =2 CO2(g) ΔH2 = -566 kJ/mol
则反应CH4(g)+2O2(g) = CO2(g)+2H2O(l) 的△H=
(2)如图,水槽中试管内有一枚铁钉,放置数天观察:

若液面上升,发生
(3)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。通入CH4的一极,其电极反应式是
您最近一年使用:0次



