1 . 碳中和作为一种新型环保形式,已经被越来越多的大型活动和会议采用。回答下列有关问题:
(1)利用 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。
工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:
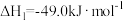
Ⅱ.逆水汽变换: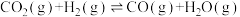

Ⅲ.甲醇脱水: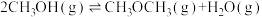
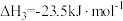
工艺2:利用 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)
据上述信息可知反应Ⅳ的热化学方程式为________________ ,反应Ⅰ_____________ 低温自发进行(填“能”、“不能”)。
(2)工艺1需先合成甲醇。在不同压强下,按照 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲、乙所示。
的平衡产率随温度的变化关系如图甲、乙所示。___________________ 。
A.图甲纵坐标表示 的平衡产率
的平衡产率
B.
C.为了同时提高 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件
D.一定温度压强下,提高 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是_______________ 。
(3)对于合成甲醇的反应:
 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于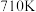 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是:
转化率降低的原因可能是:________________ 。 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。____________ ;
②电极R上发生的电极反应为___________ 。
(1)利用
 合成二甲醚有两种工艺。
合成二甲醚有两种工艺。工艺1:涉及以下主要反应:
Ⅰ.甲醇的合成:

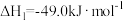
Ⅱ.逆水汽变换:
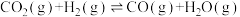

Ⅲ.甲醇脱水:
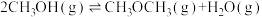
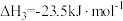
工艺2:利用
 直接加氢合成
直接加氢合成 (反应Ⅳ)
(反应Ⅳ)据上述信息可知反应Ⅳ的热化学方程式为
(2)工艺1需先合成甲醇。在不同压强下,按照
 投料合成甲醇,实验测定
投料合成甲醇,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度的变化关系如图甲、乙所示。
的平衡产率随温度的变化关系如图甲、乙所示。
A.图甲纵坐标表示
 的平衡产率
的平衡产率B.

C.为了同时提高
 的平衡转化率和
的平衡转化率和 的平衡产率,应选择低温、高压条件
的平衡产率,应选择低温、高压条件D.一定温度压强下,提高
 的平衡转化率的主要方向是寻找活性更高的催化剂
的平衡转化率的主要方向是寻找活性更高的催化剂②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)对于合成甲醇的反应:

 ,一定条件下,单位时间内不同温度下测定的
,一定条件下,单位时间内不同温度下测定的 转化率如图丙所示。温度高于
转化率如图丙所示。温度高于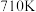 时,随温度的升高
时,随温度的升高 转化率降低的原因可能是:
转化率降低的原因可能是:
 和
和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。
都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图丁所示,两电极均为惰性电极。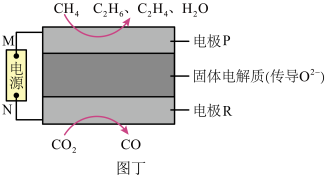
②电极R上发生的电极反应为
您最近一年使用:0次
2 . 甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
由表中数据判断反应为___________ 热反应(填“吸”或“放”);某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为___________ ,此时的温度为___________ (从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2kJ/mol
③H2O(g)=H2O(l) △H3kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=___________ kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有 )时,实验室利用如图装置模拟该法:
)时,实验室利用如图装置模拟该法:___________ 。
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5mol·L-1时,Cr3+沉淀完全,此时溶液的pH=___________ 。(已知,Ksp=6.4×10-31,lg2=0.3)
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)
 CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H,下表所列数据是该反应在不同温度下的化学平衡常数(K)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2kJ/mol
③H2O(g)=H2O(l) △H3kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有
 )时,实验室利用如图装置模拟该法:
)时,实验室利用如图装置模拟该法: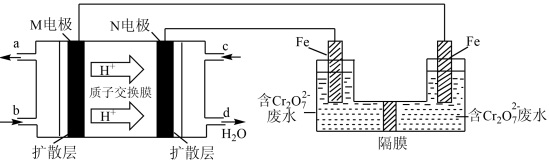
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5mol·L-1时,Cr3+沉淀完全,此时溶液的pH=
您最近一年使用:0次
名校
解题方法
3 . 以CO2和H2为原料制造更高价值的化学产品是用来缓解温室效应的研究方向。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:
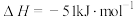
反应Ⅱ:
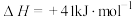
①已知几种化学键的键能如下表所示,则a=_____ kJ·mol-1.
②若反应Ⅱ逆反应活化能 ,则该反应的正反应的活化能
,则该反应的正反应的活化能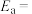
_____ kJ·mol-1.
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数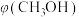 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中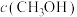 关系如图2所示:
关系如图2所示:
①图1中P1_____ P2(填“>”、“<”或“=”);
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是_____ (填字母序号)。 、
、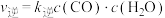 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是_____ ,表示lgk逆随温度T变化关系的直线是_____ 。
(4)已知一定温度下按照起始比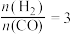 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
_____ MPa-2(保留2位有效数字)(各气体分压=平衡体系中各气体的体积分数×总压)。
(5)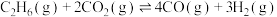
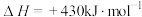 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
(1)工业上常用CO2和H2为原料合成甲醇(CH3OH),过程中发生如下两个反应:
反应I:

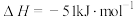
反应Ⅱ:

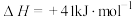
①已知几种化学键的键能如下表所示,则a=
| 化学键 | C—H | C—O | H—O | H—H | C≡O |
| 键能/kJ·mol-1 | 406 | 351 | 465 | 436 | a |
 ,则该反应的正反应的活化能
,则该反应的正反应的活化能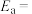
(2)向2L容器中充入1molCO2和2molH2,若只发生反应I,测得反应在不同压强下平衡混合物中甲醇体积分数
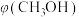 随温度变化如图1所示,逆反应速率与容器中
随温度变化如图1所示,逆反应速率与容器中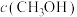 关系如图2所示:
关系如图2所示:①图1中P1
②图2中x点平衡体系时升温,反应重新达平衡状态时新平衡点可能是

 、
、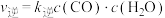 ,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是
,k正、k逆分别表示正逆反应速率常数,只与温度有关。则图3中所示的甲、乙、丙、丁四条直线中,表示lgk正随温度T变化关系的直线是(4)已知一定温度下按照起始比
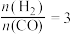 ,在一密闭容器中进行反应:
,在一密闭容器中进行反应: ,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
,保持总压为2.1MPa不变,达到平衡时CO的平衡转化率为50%,则该条件下用平衡体系中各气体分压表示的平衡常数
(5)
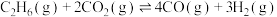
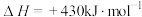 ,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。
,在四种不同容器中发生上述反应,若初始温度、压强和反应物用量均相同,则CO2的转化率最高的是_____(填字母)。| A.恒温恒容容器 | B.恒容绝热容器 |
| C.恒压绝热容器 | D.恒温恒压容器 |
您最近一年使用:0次
4 . 回答下列问题
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g) SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0
②3SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0
③2SiCl4(g)+H2(g)+Si(s)+HCl(g) 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3
反应③的ΔH3=___________ (用ΔH1,ΔH2表示)。
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为___________ mol,若要恢复到电解前的浓度,还可加入0.3mol___________ 和0.3molH2O。
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:
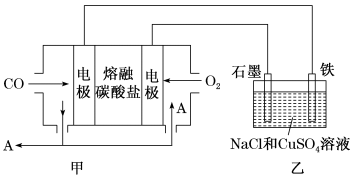
为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为___________ 。
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。
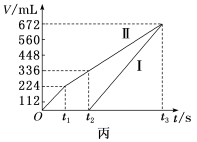
①写出在t1后,石墨电极上的电极反应:___________ ;原NaCl溶液物质的量浓度为___________ mol·L-1(假设溶液体积不变)。
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为___________ g。
(1)将SiCl4氢化为SiHCl3有三种方法,对应的反应依次为:
①SiCl4(g)+H2(g)
 SiHCl3(g)+HCl(g) ΔH1>0
SiHCl3(g)+HCl(g) ΔH1>0②3SiCl4(g)+2H2(g)+Si(s)
 4SiHCl3(g) ΔH2<0
4SiHCl3(g) ΔH2<0③2SiCl4(g)+H2(g)+Si(s)+HCl(g)
 3SiHCl3(g) ΔH3
3SiHCl3(g) ΔH3反应③的ΔH3=
(2)用惰性电极电解一定浓度的硫酸铜溶液一段时间后,若要恢复到电解前的浓度,须向所得的溶液中加入0.3molCu(OH)2。此电解过程中两个电极共放出气体为
(3)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池示意图如图:

为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。该电池负极电极反应为
(4)用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如乙图。理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(体积为标准状况下的体积)。

①写出在t1后,石墨电极上的电极反应:
②当向上述甲装置中通入标准状况下的氧气336mL时,理论上在铁电极上可析出铜的质量为
您最近一年使用:0次
5 . 磷酸是重要的化学试剂和工业原料。回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
向NaF溶液中滴加少量 溶液,反应的离子方程式为
溶液,反应的离子方程式为___________ 。
(2)已知:
Ⅰ. CaO(s)+H2SO4(l) CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 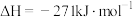
Ⅱ.

①工业上用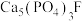 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为___________ 。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___________ (填“增大”“减小”“不变”,下同);HF的平衡浓度___________ 。
(3)工业上用磷尾矿制备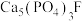 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和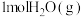 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
___________ ,该反应的平衡常数K=___________ 。
②在压强不变的密闭容器中发生上述反应,设起始的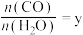 ,CO的平衡体积分数
,CO的平衡体积分数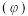 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。

则:该反应的
___________ 0(填“>”“<”或“=”,下同),a___________ 1。
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
| 物质 |  |  |
| 电离常数 |  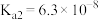 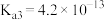 |  |
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(2)已知:
Ⅰ. CaO(s)+H2SO4(l)
 CaSO4(s)+H2O(l)
CaSO4(s)+H2O(l) 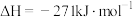
Ⅱ.


①工业上用
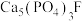 和硫酸反应制备磷酸的热化学方程式为
和硫酸反应制备磷酸的热化学方程式为②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率
(3)工业上用磷尾矿制备
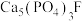 时生成的副产物CO可用于制备
时生成的副产物CO可用于制备 ,原理为
,原理为

①一定温度下,向10L密闭容器中充入0.5molCO和
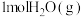 ,2min达到平衡时,测得0~2min内用
,2min达到平衡时,测得0~2min内用 表示的反应速率
表示的反应速率 ,则CO的平衡转化率
,则CO的平衡转化率
②在压强不变的密闭容器中发生上述反应,设起始的
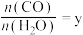 ,CO的平衡体积分数
,CO的平衡体积分数 与温度(T)的关系如图所示。
与温度(T)的关系如图所示。
则:该反应的

您最近一年使用:0次
名校
解题方法
6 . 工业上可用 来生产甲醇等燃料,这一技术的应用对构建生态文明社会具有重要意义。
来生产甲醇等燃料,这一技术的应用对构建生态文明社会具有重要意义。
(1) 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:
Ⅰ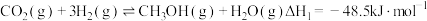
Ⅱ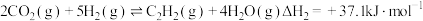
则反应 的
的
_______ 。
(2)在压强、 和
和 的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得
的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。

已知: 的选择性
的选择性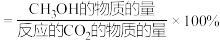
①曲线 表示的是
表示的是_______ 。(填“ 的平衡转化率”或“
的平衡转化率”或“ 的选择性”)
的选择性”)
②温度高于280℃时,曲线N随温度升高而升高的原因是_______ 。
③要同时提高 的平衡转化率和
的平衡转化率和 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为_______ (填标号)。
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(3)在一定条件下,向体积为 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和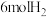 ,只反应Ⅰ、Ⅱ,tmin后达到平衡,转化率及和选择性如上图所示。
,只反应Ⅰ、Ⅱ,tmin后达到平衡,转化率及和选择性如上图所示。
①Q点时,生成 物质的量为
物质的量为_______ mol。
② 点时,从反应开始到平衡,
点时,从反应开始到平衡, 的反应速率
的反应速率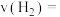
_______ mol·L-1·min-1。
③写出 点时反应
点时反应 的化学平衡常数
的化学平衡常数
_______ (写计算式)。
 来生产甲醇等燃料,这一技术的应用对构建生态文明社会具有重要意义。
来生产甲醇等燃料,这一技术的应用对构建生态文明社会具有重要意义。(1)
 和
和 在催化剂作用下可发生以下两个反应:
在催化剂作用下可发生以下两个反应:Ⅰ
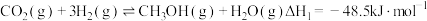
Ⅱ
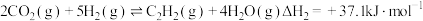
则反应
 的
的
(2)在压强、
 和
和 的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得
的起始投料一定的条件下,发生反应Ⅰ、Ⅱ,实验测得 的平衡转化率和平衡时
的平衡转化率和平衡时 的选择性随温度的变化如图所示。
的选择性随温度的变化如图所示。
已知:
 的选择性
的选择性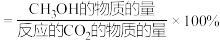
①曲线
 表示的是
表示的是 的平衡转化率”或“
的平衡转化率”或“ 的选择性”)
的选择性”)②温度高于280℃时,曲线N随温度升高而升高的原因是
③要同时提高
 的平衡转化率和
的平衡转化率和 的选择性,应选择的反应条件为
的选择性,应选择的反应条件为A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(3)在一定条件下,向体积为
 的恒容密闭容器中,充入
的恒容密闭容器中,充入 和
和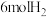 ,只反应Ⅰ、Ⅱ,tmin后达到平衡,转化率及和选择性如上图所示。
,只反应Ⅰ、Ⅱ,tmin后达到平衡,转化率及和选择性如上图所示。①Q点时,生成
 物质的量为
物质的量为②
 点时,从反应开始到平衡,
点时,从反应开始到平衡, 的反应速率
的反应速率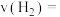
③写出
 点时反应
点时反应 的化学平衡常数
的化学平衡常数
您最近一年使用:0次
名校
7 . 目前,大规模和低成本制取氢能实质上都是通过烃重整实现的,该过程主要是甲烷水蒸气重整,包括以下两步气相化学催化反应:
反应Ⅰ: CH4(g)+H2O(g) CO(g)+3H2(g) ∆H=+206 kJ·mol-1
CO(g)+3H2(g) ∆H=+206 kJ·mol-1
反应Ⅱ: CO(g)+H2O(g) CO2(g)+H2(g) ∆H=-41 kJ·mol-1
CO2(g)+H2(g) ∆H=-41 kJ·mol-1
(1)反应:CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= ___________
(2)将2molCO和lmolH2O充入某容积不变的绝热密闭容器中,发生反应Ⅱ,下列说法正确的是___________ 。
A.断2个O-H键同时 断2个C=O键,能判断反应Ⅱ达到平衡
B.混合气体的密度保持不变,能判断反应Ⅱ达到平衡
C.混合气体的平均相对分子质量保持不变,能判断反应Ⅱ达到平衡
D.容器内温度不再变化,能判断反应Ⅱ达到平衡
E.反应Ⅱ平衡后,充入氮气,压强增大,平衡不移动
(3)甲烷水蒸气重整得到的CO2与H2,可以催化重整制备CH3OCH3,制备的过程中存在反应:
①2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ∆H<0;
CH3OCH3(g)+3H2O(g) ∆H<0;
②CO2(g)+H2(g) CO(g)+H2O(g) ∆H>0。
CO(g)+H2O(g) ∆H>0。
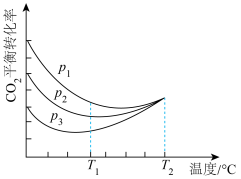
向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示,P1、P2、 P3由大到小的顺序为___________ ;T2°C时主要发生反应___________ 。(填“①”或“②”),CO2平衡转化率随温度变化先降后升的原因为___________ 。
(4)甲烷水蒸气重整得到的CO2和H2, 也可用来制备甲醇,反应方程式CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
①用CO2表示前2h的平均反应速率v(CO2)=___________ mol/(L·h)。
②该条件下的分压平衡常数为Kp=___________ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
反应Ⅰ: CH4(g)+H2O(g)
 CO(g)+3H2(g) ∆H=+206 kJ·mol-1
CO(g)+3H2(g) ∆H=+206 kJ·mol-1反应Ⅱ: CO(g)+H2O(g)
 CO2(g)+H2(g) ∆H=-41 kJ·mol-1
CO2(g)+H2(g) ∆H=-41 kJ·mol-1(1)反应:CH4(g)+2H2O(g)
 CO2(g)+4H2(g) ∆H=
CO2(g)+4H2(g) ∆H= (2)将2molCO和lmolH2O充入某容积不变的绝热密闭容器中,发生反应Ⅱ,下列说法正确的是
A.断2个O-H键同时 断2个C=O键,能判断反应Ⅱ达到平衡
B.混合气体的密度保持不变,能判断反应Ⅱ达到平衡
C.混合气体的平均相对分子质量保持不变,能判断反应Ⅱ达到平衡
D.容器内温度不再变化,能判断反应Ⅱ达到平衡
E.反应Ⅱ平衡后,充入氮气,压强增大,平衡不移动
(3)甲烷水蒸气重整得到的CO2与H2,可以催化重整制备CH3OCH3,制备的过程中存在反应:
①2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) ∆H<0;
CH3OCH3(g)+3H2O(g) ∆H<0;②CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H>0。
CO(g)+H2O(g) ∆H>0。向密闭容器中以物质的量之比为1:3充入CO2与H2,实验测得CO2的平衡转化率随温度和压强的变化关系如图所示,P1、P2、 P3由大到小的顺序为

(4)甲烷水蒸气重整得到的CO2和H2, 也可用来制备甲醇,反应方程式CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:
CH3OH(g)+H2O(g) ∆H<0, 某温度下,将1 mol CO2和1 mol H2充入体积不变的2L密闭容器中,初始总压为8MPa,发生上述反应,测得不同时刻反应后与反应前的压强关系如表:| 时间/h | 1 | 2 | 3 | 4 | 5 |
 | 0.92 | 0.85 | 0.79 | 0.75 | 0.75 |
②该条件下的分压平衡常数为Kp=
您最近一年使用:0次
8 . 党的二十大报告指出,要积极稳妥推进碳达峰、碳中和。二氧化碳的捕集、利用与封存(CCUS)已成为科学家研究的重要课题。
I.工业上用 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: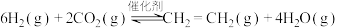

已知:①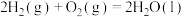
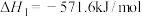
②
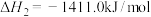
③
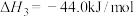
(1)
__________ (用 、
、 、
、 表示)。
表示)。
(2)恒温恒容下,向密闭容器按投料比 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
(3)向密闭容器按投料比 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强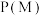
__________ 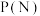 ,原因是:
,原因是:__________ 。

Ⅱ. 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:
①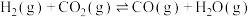
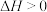
②

恒压条件下, 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
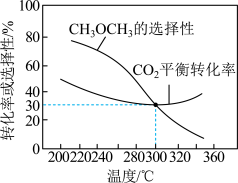
已知:的选择性 %
%
(4)300℃时,通入 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
__________ (保留2位有效数字)。
(5)温度高于300℃, 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是__________ 。
Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。
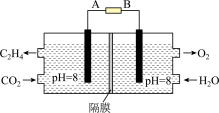
(6)该电池的阴极电极反应式为:__________ 。
I.工业上用
 和
和 在一定条件下可以合成乙烯:
在一定条件下可以合成乙烯: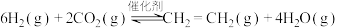

已知:①
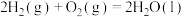
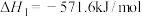
②

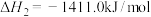
③

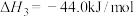
(1)

 、
、 、
、 表示)。
表示)。(2)恒温恒容下,向密闭容器按投料比
 通入原料气,能判断该反应处于平衡状态的是_______(填标号)。
通入原料气,能判断该反应处于平衡状态的是_______(填标号)。A. |
| B.混合气体的密度保持不变 |
| C.混合气体的平均相对分子质量保持不变 |
D.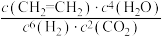 保持不变 保持不变 |
(3)向密闭容器按投料比
 通入原料气(,不同温度对
通入原料气(,不同温度对 的平衡转化率和催化剂催化效率的影响如图所示,则压强
的平衡转化率和催化剂催化效率的影响如图所示,则压强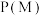
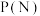 ,原因是:
,原因是:
Ⅱ.
 催化加氢可以直接合成二甲醚。涉及以下主要反应:
催化加氢可以直接合成二甲醚。涉及以下主要反应:①
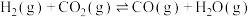
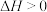
②


恒压条件下,
 、起始量相等时,
、起始量相等时, 的平衡转化率和的选择性随温度变化如下图所示。
的平衡转化率和的选择性随温度变化如下图所示。
已知:的选择性
 %
%(4)300℃时,通入
 、
、 各
各 ,平衡时
,平衡时 的选择性、
的选择性、 的平衡转化率均为30%,则此温度下反应①的平衡常数
的平衡转化率均为30%,则此温度下反应①的平衡常数
(5)温度高于300℃,
 的平衡转化率随温度升高而增大的原因可能是
的平衡转化率随温度升高而增大的原因可能是Ⅲ.电化学法也可还原二氧化碳制乙烯,原理如下图所示。

(6)该电池的阴极电极反应式为:
您最近一年使用:0次
解题方法
9 . 工业上通过 与
与 共转化生成合成气,助力实现“碳达峰”。
共转化生成合成气,助力实现“碳达峰”。
其主反应ⅰ
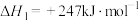 ;
;
副反应主要有:ⅱ
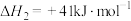 ;
;
ⅲ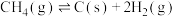
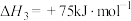 (积碳反应);
(积碳反应);
ⅳ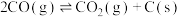
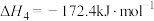 (积碳反应);
(积碳反应);
ⅴ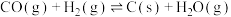
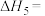 (积碳反应)
(积碳反应)
Ⅰ.若只考虑主反应
(1)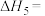
___________ 。
(2)该反应在一定条件下建立平衡后,下列说法正确的是___________。
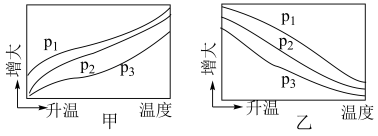
(3)不同压强下,按照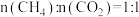 投料,实验测得
投料,实验测得 平衡转化率和
平衡转化率和 平衡产率随温度变化关系如下图所示,纵坐标可表示
平衡产率随温度变化关系如下图所示,纵坐标可表示 平衡转化率的为
平衡转化率的为___________ (填“甲”或“乙”),压强由大到小的顺序为___________ 。
(4)一定条件下,向真空密闭容器中通入 和
和 ,使总压为
,使总压为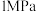 。反应达到平衡时,容器中气体压强为原来的
。反应达到平衡时,容器中气体压强为原来的 倍。已知容器中气体的分压
倍。已知容器中气体的分压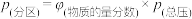 ,用气体的分压计算得到的平衡常数称为分压平衡常数
,用气体的分压计算得到的平衡常数称为分压平衡常数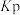 。则该反应的平衡常数
。则该反应的平衡常数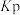 为
为___________  。
。
Ⅱ.若考虑副反应
在 、CH4和
、CH4和 总物质的量为
总物质的量为 的条件下,温度及投料比[
的条件下,温度及投料比[ ]对或
]对或 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。
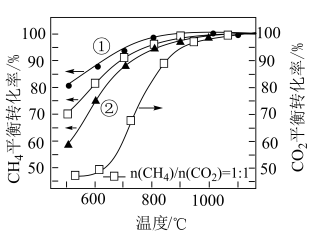
(5)根据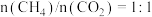 的曲线,推断表示
的曲线,推断表示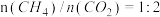 的
的 平衡转化率的曲线是
平衡转化率的曲线是___________ (填“①”或“②”)。
(6)在投料比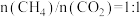 下
下 平衡转化率
平衡转化率 明显大于
明显大于 的原因为
的原因为___________ 。
(7)为了提高合成气的产量和消除积碳,可以往反应体系中加入适量的___________ 。
 与
与 共转化生成合成气,助力实现“碳达峰”。
共转化生成合成气,助力实现“碳达峰”。其主反应ⅰ

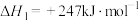 ;
;副反应主要有:ⅱ

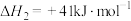 ;
;ⅲ
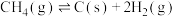
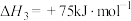 (积碳反应);
(积碳反应);ⅳ
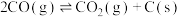
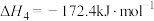 (积碳反应);
(积碳反应);ⅴ
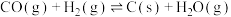
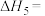 (积碳反应)
(积碳反应)Ⅰ.若只考虑主反应
(1)
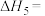
(2)该反应在一定条件下建立平衡后,下列说法正确的是___________。
| A.升高温度,反应平衡常数增大 |
| B.增大压强有利于反应平衡正向移动 |
C.增大 浓度,正、逆反应速率均增大 浓度,正、逆反应速率均增大 |
D.增大 浓度,可以提高 浓度,可以提高 的平衡转化率 的平衡转化率 |
(3)不同压强下,按照
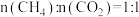 投料,实验测得
投料,实验测得 平衡转化率和
平衡转化率和 平衡产率随温度变化关系如下图所示,纵坐标可表示
平衡产率随温度变化关系如下图所示,纵坐标可表示 平衡转化率的为
平衡转化率的为
(4)一定条件下,向真空密闭容器中通入
 和
和 ,使总压为
,使总压为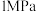 。反应达到平衡时,容器中气体压强为原来的
。反应达到平衡时,容器中气体压强为原来的 倍。已知容器中气体的分压
倍。已知容器中气体的分压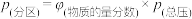 ,用气体的分压计算得到的平衡常数称为分压平衡常数
,用气体的分压计算得到的平衡常数称为分压平衡常数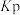 。则该反应的平衡常数
。则该反应的平衡常数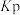 为
为 。
。Ⅱ.若考虑副反应
在
 、CH4和
、CH4和 总物质的量为
总物质的量为 的条件下,温度及投料比[
的条件下,温度及投料比[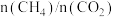 ]对或
]对或 平衡转化率的影响如图所示。
平衡转化率的影响如图所示。
(5)根据
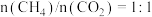 的曲线,推断表示
的曲线,推断表示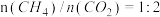 的
的 平衡转化率的曲线是
平衡转化率的曲线是(6)在投料比
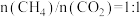 下
下 平衡转化率
平衡转化率 明显大于
明显大于 的原因为
的原因为(7)为了提高合成气的产量和消除积碳,可以往反应体系中加入适量的
您最近一年使用:0次
名校
10 . 铁及其化合物在生产、生活中有广泛的应用。
(1)中科院兰州化学物理研究所用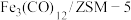 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
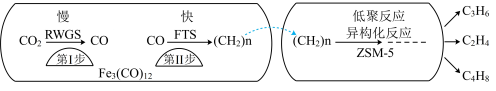
下列说法正确的是___________ 。
a.第1步所发生的反应为: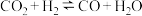
b.第1步反应的活化能低于第2步
c.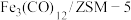 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小
d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和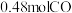 ,在
,在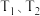 不同温度下进行反应,测得
不同温度下进行反应,测得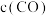 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。
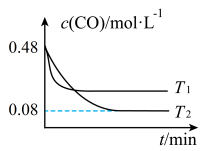

___________ 0(填“>”或“<”);
(3) 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数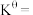
___________ (已知:标准平衡常数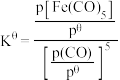 ,其中
,其中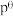 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)
(4)高铁酸钾 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
①电解法可制得 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为___________ 。

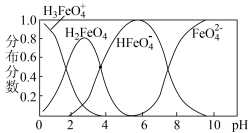
② 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
(5)复合氧化物铁酸锰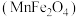 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下:
①

②

③

则: 与
与 、
、 的关系为
的关系为
___________
(1)中科院兰州化学物理研究所用
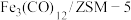 催化
催化 加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂
加氢合成低碳烯烃反应,反应过程如图,催化剂中添加助剂 (也起催化作用)后可改变反应的选择性。
(也起催化作用)后可改变反应的选择性。
下列说法正确的是
a.第1步所发生的反应为:
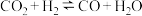
b.第1步反应的活化能低于第2步
c.
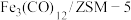 使
使 加氢合成低碳烯烃的
加氢合成低碳烯烃的 减小
减小d.添加不同助剂后,各反应的平衡常数不变
(2)纳米铁是重要的储氢材料,可用反应
 制得。在
制得。在 恒容密闭容器中加入足量铁粉和
恒容密闭容器中加入足量铁粉和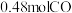 ,在
,在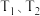 不同温度下进行反应,测得
不同温度下进行反应,测得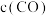 与温度、时间的关系如图所示。
与温度、时间的关系如图所示。

(3)
 温度下,平衡时体系的压强为
温度下,平衡时体系的压强为 ,反应的标准平衡常数
,反应的标准平衡常数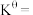
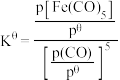 ,其中
,其中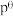 为标准压强
为标准压强 为各组分的平衡分压。)
为各组分的平衡分压。)(4)高铁酸钾
 被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。
被称为“绿色化学”净水剂,在酸性至弱碱性条件下不稳定。①电解法可制得
 ,装置如图,阳极电极反应式为
,装置如图,阳极电极反应式为
②
 在水解过程中铁元素形成的微粒分布分数与
在水解过程中铁元素形成的微粒分布分数与 的关系如图所示,向
的关系如图所示,向 的溶液中加入
的溶液中加入 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
(5)复合氧化物铁酸锰
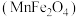 可用于热化学循环分解制氢气,原理如下:
可用于热化学循环分解制氢气,原理如下: ①


②


③


则:
 与
与 、
、 的关系为
的关系为
您最近一年使用:0次



