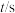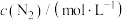名校
解题方法
1 . 研究二氧化碳合成甲醇对实现“碳中和”具有重要意义,二氧化碳加氢制甲醇的过程一般含有以下三个反应:
Ⅰ.


Ⅱ.
 kJ·mol
kJ·mol

Ⅲ.
 kJ·mol
kJ·mol

(1)
______ ;反应Ⅰ在______ (填“高温”、“低温”或“任意温度”)下可自发进行。
(2)一定温度下,向盛有催化剂的恒容密闭容器中按初始进料比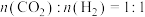 投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是
投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是______ (填字母)。
a.容器内气体的压强不再发生改变
b. 的体积分数不再变化
的体积分数不再变化
c.1 mol H-H键断裂的同时1 mol C-H键断裂
d.反应的焓变 不再变化
不再变化
(3)向恒容密闭容器中按初始进料比 投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中
投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中 、CO的选择性和
、CO的选择性和 的平衡转化率
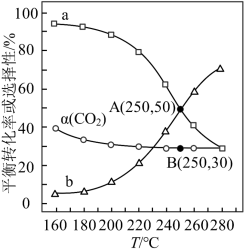
的平衡转化率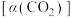 与温度的关系如图所示。
与温度的关系如图所示。
(已知: 的选择性
的选择性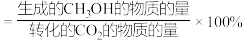 )
)
①图中表示 选择性变化的曲线是
选择性变化的曲线是______ (填“a”或“b”),其原因是_______________ 。
②当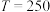 ℃,平衡时
℃,平衡时 的体积分数
的体积分数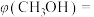
__________ (答案保留两位有效数字)。
(4)500℃时,已知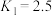 ,
, ,则
,则
______ 。该温度下,往2 L恒容密闭容器中充入1 mol CO和2 mol  发生反应Ⅲ。测得某时刻
发生反应Ⅲ。测得某时刻 ,CO的转化率为50%,则此时该反应的v(正)
,CO的转化率为50%,则此时该反应的v(正)______ v(逆)(填“>”、“<”或“=”)。
Ⅰ.



Ⅱ.

 kJ·mol
kJ·mol

Ⅲ.

 kJ·mol
kJ·mol

(1)

(2)一定温度下,向盛有催化剂的恒容密闭容器中按初始进料比
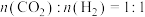 投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是
投入反应物,发生反应I。下列不能说明该反应一定处于平衡状态的是a.容器内气体的压强不再发生改变
b.
 的体积分数不再变化
的体积分数不再变化c.1 mol H-H键断裂的同时1 mol C-H键断裂
d.反应的焓变
 不再变化
不再变化(3)向恒容密闭容器中按初始进料比
 投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中
投入反应物,只发生反应Ⅰ和Ⅱ。在不同温度下达到平衡,体系中 、CO的选择性和
、CO的选择性和 的平衡转化率
的平衡转化率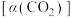 与温度的关系如图所示。
与温度的关系如图所示。
(已知:
 的选择性
的选择性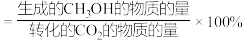 )
)①图中表示
 选择性变化的曲线是
选择性变化的曲线是②当
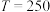 ℃,平衡时
℃,平衡时 的体积分数
的体积分数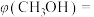
(4)500℃时,已知
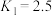 ,
, ,则
,则
 发生反应Ⅲ。测得某时刻
发生反应Ⅲ。测得某时刻 ,CO的转化率为50%,则此时该反应的v(正)
,CO的转化率为50%,则此时该反应的v(正)
您最近一年使用:0次
2023-08-31更新
|
498次组卷
|
2卷引用:福建省福州延安中学2023-2024学年高二上学期12月月考化学试卷
解题方法
2 . 通过以下两步反应可实现NH4Cl分解产物的分离。
NH4Cl(s)+MgO(s)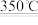 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
Mg(OH)Cl(s) HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
下列说法不正确的是
NH4Cl(s)+MgO(s)
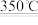 NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1
NH3(g)+Mg(OH)Cl(s) ΔH=+61.34kJ·mol-1Mg(OH)Cl(s)
 HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1
HCl(g)+MgO(s) ΔH=+97.50kJ·mol-1下列说法不正确的是
| A.反应NH4Cl(s)=NH3(g)+HCl(g)的ΔH=+158.84kJ·mol-1 |
| B.两步反应的ΔS均大于0 |
| C.Mg(OH)Cl是NH4Cl分解反应的催化剂 |
| D.5.35gNH4Cl完全分解理论上可获得标准状况下的HCl约2.24L |
您最近一年使用:0次
3 . 下列说法正确的是
A.  , ,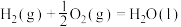  ,则 ,则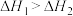 |
B.  , ,  ,则碳的摩尔燃烧焓 ,则碳的摩尔燃烧焓 |
C.已知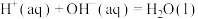  ,则 ,则  |
D.已知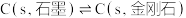  ,则稳定性石墨小于金刚石 ,则稳定性石墨小于金刚石 |
您最近一年使用:0次
2023-08-20更新
|
295次组卷
|
3卷引用:福建省宁德市部分一级达标中学2022-2023学年高二上学期11月期中考试化学(C卷)试题
4 . 利用CO2催化加氢制二甲醚,可以实现CO2的再利用,该过程中涉及以下两个反应:
①CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
则反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为
①CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2则反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)的ΔH为
CH3OCH3(g)+3H2O(g)的ΔH为| A.2ΔH1+ΔH2 | B.2ΔH1-ΔH2 | C.ΔH1+2ΔH2 | D.ΔH1+ΔH2 |
您最近一年使用:0次
2023-08-02更新
|
563次组卷
|
4卷引用:福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题
福建省福州市延安中学2023-2024学年高二上学期期中考试化学试题新疆生产建设兵团第二师八一中学2023-2024学年高二上学期第一次月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)辽宁省部分学校2022-2023学年高一下学期期末考试化学试题
名校
5 . NO催化 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:
第1步:
 ;
;
第2步: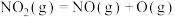
 ;
;
第3步:

 生成
生成 的过程由以下三步基元反应构成:
的过程由以下三步基元反应构成:第1步:

 ;
;第2步:
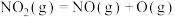
 ;
;第3步:


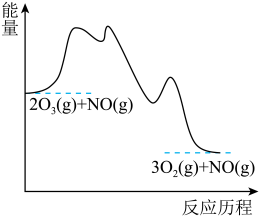
| A.第2步是总反应的决速步 |
| B.三步基元反应都是放热反应 |
| C.该过程共有两种中间产物 |
D.总反应 的焓变为 的焓变为 |
您最近一年使用:0次
2023-07-31更新
|
486次组卷
|
7卷引用:福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题
福建省福州高新区第一中学(闽侯县第三中学)2023-2024学年高二上学期12月月考化学试题福建省福州市闽 闽侯县第一中学2023-2024学年高二上学期12月月考化学试题福建省莆田第七中学、第十一中学、第十五中学等校2023-2024学年高二上学期期末联考化学试题江苏省淮安市2022-2023学年高二上学期期末考试化学试题江苏省苏州震泽中学2023~2024学年高二上学期10月月考化学试题(已下线)专题07 化学能与热能、电能-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)江苏省苏州市吴江市高级中学2023-2024学年高二上学期10月月考化学试题
6 . 请参考题中图表,根据要求回答问题:
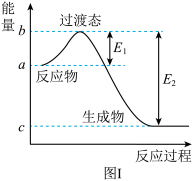
(1)图I是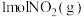 和
和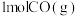 反应生成
反应生成 和
和 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知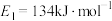 、
、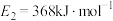 ,若在反应体系中加入催化剂,反应速率增大,
,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。请写出 和
和 反应的热化学方程式:
反应的热化学方程式:___________ 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①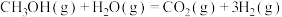
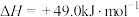
②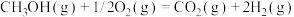
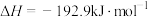
又知③
 ,则甲醇蒸汽燃烧为液态水的热化学方程式为
,则甲醇蒸汽燃烧为液态水的热化学方程式为___________ 。
(3)如表所示是部分化学键的键能参数:
已知白磷的燃烧热为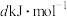 ,白磷及其完全燃烧的产物的结构如图II所示,
,白磷及其完全燃烧的产物的结构如图II所示,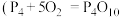 )则表中x=
)则表中x=___________  (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
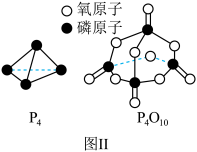
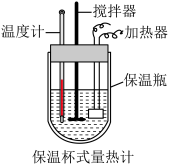
(4)某实验小组通过如图所示的量热计中,向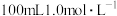 稀盐酸加
稀盐酸加 稀
稀 溶液(碱稍过量),测得中和热
溶液(碱稍过量),测得中和热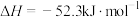 ,理论值为
,理论值为 ,造成这一结果的原因可能是
,造成这一结果的原因可能是___________ 。
a.用量筒量取盐酸时仰视读数
b.分多次将 溶液倒入量热计中
溶液倒入量热计中
c.温度计测量完盐酸的温度再次测量 溶液温度时,残留的酸液末用水冲洗干净
溶液温度时,残留的酸液末用水冲洗干净
d.错把同浓度的醋酸当成盐酸溶液与 溶液反应
溶液反应
(1)图I是
 和
和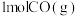 反应生成
反应生成 和
和 过程中的能量变化示意图,已知
过程中的能量变化示意图,已知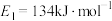 、
、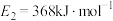 ,若在反应体系中加入催化剂,反应速率增大,
,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是 和
和 反应的热化学方程式:
反应的热化学方程式:
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①
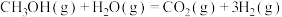
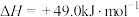
②
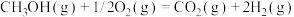
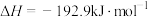
又知③

 ,则甲醇蒸汽燃烧为液态水的热化学方程式为
,则甲醇蒸汽燃烧为液态水的热化学方程式为(3)如表所示是部分化学键的键能参数:
| 化学键 |  |  |  | 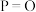 |
键能 |  |  |  |  |
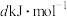 ,白磷及其完全燃烧的产物的结构如图II所示,
,白磷及其完全燃烧的产物的结构如图II所示,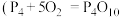 )则表中x=
)则表中x= (用含a、b、c、d的代数式表示)。
(用含a、b、c、d的代数式表示)。
(4)某实验小组通过如图所示的量热计中,向
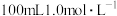 稀盐酸加
稀盐酸加 稀
稀 溶液(碱稍过量),测得中和热
溶液(碱稍过量),测得中和热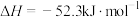 ,理论值为
,理论值为 ,造成这一结果的原因可能是
,造成这一结果的原因可能是
a.用量筒量取盐酸时仰视读数
b.分多次将
 溶液倒入量热计中
溶液倒入量热计中c.温度计测量完盐酸的温度再次测量
 溶液温度时,残留的酸液末用水冲洗干净
溶液温度时,残留的酸液末用水冲洗干净d.错把同浓度的醋酸当成盐酸溶液与
 溶液反应
溶液反应
您最近一年使用:0次
名校
7 . 填空
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+ O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1
②C(s)+ O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
③H2O(g)=H2(g)+ O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1
上述反应中属于放热反应的是_____ 。
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为_____ 。
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将_____ (填“增大”“减小”或“不变”)
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=_____ kJ∙mol−1。
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式_____ 。
②H2O(1)=H2O(g) △H=_____ kJ∙mol−1。
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热_____ kJ。
(1)已知下列热化学方程式:
①H2O(1)=H2(g)+
 O2(g) △H1=285.8 kJ∙mol−1
O2(g) △H1=285.8 kJ∙mol−1②C(s)+
 O2(g)=CO(g) △H2=−110.5 kJ∙mol−1
O2(g)=CO(g) △H2=−110.5 kJ∙mol−1③H2O(g)=H2(g)+
 O2(g) △H3=241.8 kJ∙mol−1
O2(g) △H3=241.8 kJ∙mol−1上述反应中属于放热反应的是
(2)①的反应过程是太阳光催化分解水制氢气,该反应中主要能量转化形式为
a.太阳能转化为化学能 b.化学能转化为电能
(3)若反应③使用催化剂,那么△H3将
(4)反应C(s)+H2O(g)=CO(g)+H2(g)的△H=
(5)0.1mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼(B2O3)和气态水,释放203.3kJ的热。
①写出反应的热化学方程式
②H2O(1)=H2O(g) △H=
③11.2L(标准状况)气态乙硼烷(B2H6)完全燃烧生成液态水生成的热
您最近一年使用:0次
2023-07-28更新
|
453次组卷
|
2卷引用:福建省莆田第二十五中学2023-2024学年高二上学期期中考试化学试题
8 . 研究氮氧化物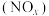 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。
(1)在密闭容器中发生该反应,氮气浓度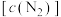 随温度
随温度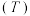 、时间
、时间 的变化关系如下表。
的变化关系如下表。
据此判断:
①
___________  (填“>”或“<”)。
(填“>”或“<”)。
② 时,
时, 内的
内的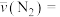
___________  。
。
(2)在绝热、恒容的密闭体系中充入一定量的 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。
(3)计算机模拟 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:
I: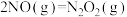
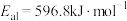
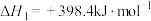
II:
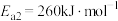
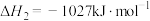
III :
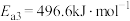
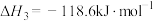
①反应过程的决速步骤是___________ (填“I”“II”或“III”)。
②总反应的热化学方程式为___________ 。
(4)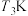 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为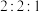 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为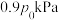 。实验测得:
。实验测得: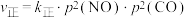 ,
,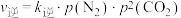 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
①平衡后升高温度, 增大的倍数比
增大的倍数比 的
的___________ (填“大”或“小”)。
② 的平衡转化率为
的平衡转化率为___________ 。
③
___________ (用含 的代数式表示)。
的代数式表示)。
(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是___________ 。

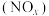 还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和
还原处理方法是环保领域的主要方向之一。上海复兴路的“生态马路”运用了“光触媒”技术,即在路面上涂了一层光催化剂涂料,可将汽车尾气中部分NO和 转化为
转化为 和
和 。
。(1)在密闭容器中发生该反应,氮气浓度
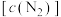 随温度
随温度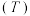 、时间
、时间 的变化关系如下表。
的变化关系如下表。
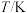 | 0 | 2 | 4 | 6 | 8 | 10 | 12 |
 | 0 | 0.10 | 0.18 | 0.25 | 0.25 | 0.25 | 0.25 |
 | 0 | 0.08 | 0.15 | 0.21 | 0.26 | 0.29 | 0.29 |
①

 (填“>”或“<”)。
(填“>”或“<”)。②
 时,
时, 内的
内的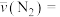
 。
。(2)在绝热、恒容的密闭体系中充入一定量的
 和
和 气体,反应达到平衡的标志是_______。
气体,反应达到平衡的标志是_______。| A.体系温度不变 | B. |
C. 的体积分数不变 的体积分数不变 | D. |
 还原
还原 的反应经历以下3个步骤:
的反应经历以下3个步骤:I:
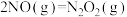
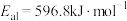
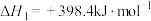
II:

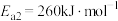
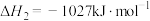
III :

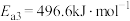
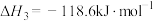
①反应过程的决速步骤是
②总反应的热化学方程式为
(4)
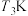 时,在刚性密闭容器中充入物质的量之比为
时,在刚性密闭容器中充入物质的量之比为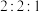 的
的 、
、 和
和 的混合气体,起始气体总压强为
的混合气体,起始气体总压强为 ,达到平衡时气体总压强为
,达到平衡时气体总压强为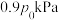 。实验测得:
。实验测得: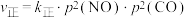 ,
,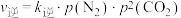 ,其中
,其中 、
、 分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。
分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=总压×物质的量分数)。①平衡后升高温度,
 增大的倍数比
增大的倍数比 的
的②
 的平衡转化率为
的平衡转化率为③

 的代数式表示)。
的代数式表示)。(5)该反应的某种催化剂的催化效率与NO的消耗速率随温度的变化关系如图所示。300~350℃之间,NO的消耗速率加快的原因是

您最近一年使用:0次
名校
解题方法
9 . 已知反应:
反应①: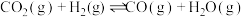
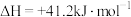
反应②: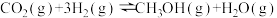
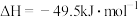
反应③:
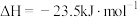
在2 MPa,起始投料 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。

(1)①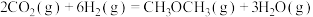 ΔH=
ΔH=___________
②从453-553℃,升高温度CO2平衡转化率降低的原因是___________ 。
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是___________ 。
(2)在催化剂作用下,二甲醚还原NO的反应原理为 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
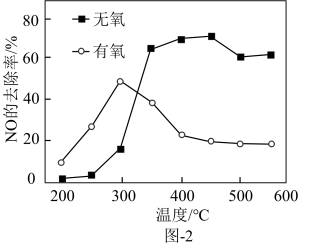
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是___________ 。
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有___________ 。
反应①:
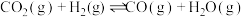
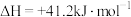
反应②:
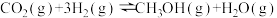
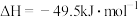
反应③:

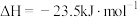
在2 MPa,起始投料
 时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
时,CO2的平衡转化率及CH3OCH3和CH3OH的平衡体积分数随温度变化如图-1所示。
(1)①
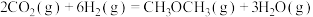 ΔH=
ΔH=②从453-553℃,升高温度CO2平衡转化率降低的原因是
③为提高单位时间内CH3OCH3产率。研发的催化剂需具备的特点是
(2)在催化剂作用下,二甲醚还原NO的反应原理为
 ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
ΔH<0。在有氧和无氧的环境下,NO的去除率随温度变化如图-2所示。
①无氧环境下,在250~450℃范围内随着温度的升高,NO的去除率先迅速上升后上升缓慢的主要原因是
②温度高于400℃时,NO去除率明显低于无氧环境的可能原因有
您最近一年使用:0次
名校
解题方法
10 . 对于反应: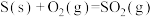
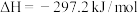 ,下列说法不正确的是
,下列说法不正确的是
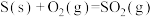
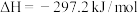 ,下列说法不正确的是
,下列说法不正确的是A.1mol S(s)与1mol (g)的总能量比1mol (g)的总能量比1mol  (g)的总能量高 (g)的总能量高 |
B.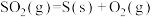 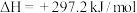 |
C.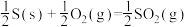 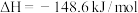 |
D.1mol S(g)与1mol (g)反应生成1mol (g)反应生成1mol (g)放出热量少于297.2kJ (g)放出热量少于297.2kJ |
您最近一年使用:0次
2023-04-23更新
|
305次组卷
|
3卷引用:福建省华安县第一中学2023-2024学年高二上学期10月月考化学试题
福建省华安县第一中学2023-2024学年高二上学期10月月考化学试题浙江省宁波市慈溪市2022-2023学年高二上学期1月期末考试化学试题(已下线)专题02 反应热的计算-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)