9-10高一下·江西·期中
1 . 已知一定条件下,有下列反应(相同质量的金刚石、石墨完全反应):
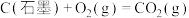
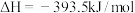
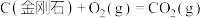
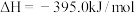
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高 |
您最近一年使用:0次
2023-10-26更新
|
118次组卷
|
34卷引用:2012-2013学年福建省东山县第二中学高二第一次月考化学试卷
(已下线)2012-2013学年福建省东山县第二中学高二第一次月考化学试卷2015-2016学年福建省漳州市东山二中高二上第一次月考化学试卷福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题福建省东山县第二中学2018-2019学年高二上学期第一次(10月)月考化学试题(已下线)2010年甘肃省康县一中高二第二学期期末考试化学试题(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试文科化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2015-2016学年湖南省岳阳县第一中学高二上学期第一次月考化学试卷2015-2016学年浙江省台州市书生中学高二上学期第一次月考化学试卷2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷河北省景县中学2017-2018学年高二开学摸底考试化学试题甘肃省甘谷县第一中学2018-2019学年高二上学期第一次月考子材班化学试题福建省长泰县第一中学2020届高三上学期期中考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题天津市第四十七中学2023-2024学年高二上学期10月月考化学试题天津市第四十七中学2023-2024学年高二上学期第一次月考化学试题(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2012年人教版高中化学必修二2.1 化学能与热能练习卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷(已下线)2013-2014山西省广灵县第一中学第二学期期末考试高一化学试卷2014-2015浙江省杭州市西湖高级中学高一下学期5月月考化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题山西省晋中市和诚中学2019-2020学年高一4月月考化学试题安徽省阜阳市2019-2020学年高一下学期开学考化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
名校
2 . 火箭推进器中装有还原剂液态肼(N2H4)和氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量。回答下列问题:
(1)过氧化氢的电子式是___________ 。
(2)该反应的热化学方程式为___________ 。
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为___________ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
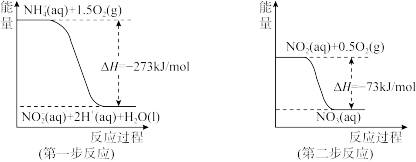
①第一步反应是___________ (填“放热”或“吸热”)反应,判断依据是___________ 。
②1 mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是___________ 。
(5)已知: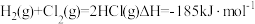 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=___________ 。
(1)过氧化氢的电子式是
(2)该反应的热化学方程式为
(3)实验室可用次氯酸钠溶液与氨气反应制备液态肼,已知生成物之一是常见的盐,则反应的化学方程式为
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
①第一步反应是
②1 mol NH
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的反应热ΔH是
(aq)的反应热ΔH是(5)已知:
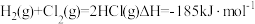 ,几种化学键的键能如下表所示,则a=
,几种化学键的键能如下表所示,则a=| 共价键 | H-H | Cl-Cl | H-Cl |
键能/( ) ) | 436 | 247 | a |
您最近一年使用:0次
2023-10-24更新
|
206次组卷
|
2卷引用:福建省漳州市东山县2023-2024学年高二上学期期中考试化学试题
3 . 化学反应过程伴随有热量的变化。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:
反应Ⅱ: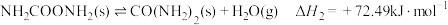
总反应: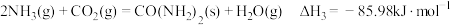
则反应I的
___________  。
。
(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
则

___________ 。(用a、b、c、d表示)
②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:
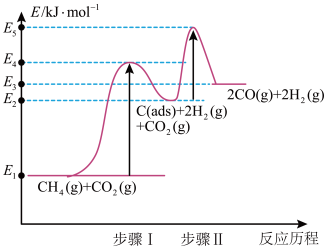
步骤1反应的焓变 为
为___________ kJ/mol(选用E1~E5的关系式表示)。
③反应 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
___________  (填“>”或“<)。
(填“>”或“<)。
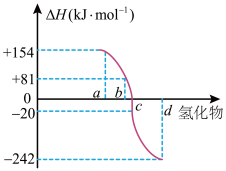
(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热( )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为___________ 。
(1)在尿素合成塔中的主要反应可表示如下:
反应I:

反应Ⅱ:
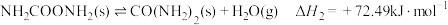
总反应:
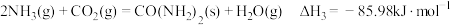
则反应I的

 。
。(2)利用CH4可制备乙烯及合成气(CO、H2)。
①有关化学键键能(E)的数据如下表:
| 化学键 | H—H | C=C | C—C | C—H |
| E(kJ/mol) | a | b | c | d |


②制备合成气反应历程分两步(步骤I、步骤Ⅱ,反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤1反应的焓变
 为
为③反应
 的焓变为
的焓变为 ,与步骤1焓变
,与步骤1焓变 相比,
相比,
 (填“>”或“<)。
(填“>”或“<)。(3)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(
 )。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热
)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热 越小。硫化氢发生分解反应的热化学方程式为
越小。硫化氢发生分解反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
4 . A.为探究碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应,某化学兴趣小组进行如下实验。
查阅资料:反应Ⅰ: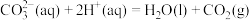
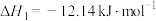 ;
;
反应Ⅱ: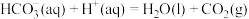
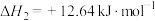
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为___________ 。
(2)向 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入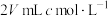 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
表格2:
表格3:
(3)表格1实验___________ (填“能”或“否”)验证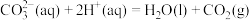
 ,
,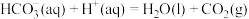
 。
。
(4)实验中玻璃搅拌器的使用方法是___________ 。(填标号)
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是___________ 。
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ: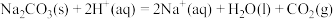
 ;
;
反应Ⅴ: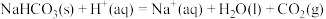

则
___________  (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
___________  。
。
查阅资料:反应Ⅰ:
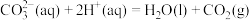
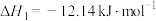 ;
;反应Ⅱ:
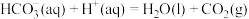
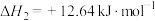
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为
(2)向
 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入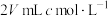 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。A.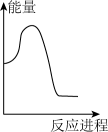 | B.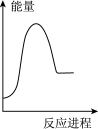 | C.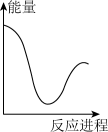 | D.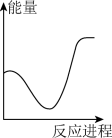 |
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
| 试剂1 | 试剂2 | 试剂1和试剂2混合后温度 |
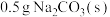 | 19.0℃的40 mL HCl | 21.7℃ |
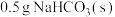 | 19.0℃的40 mL HCl | 18.1℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
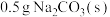 | 19.0℃的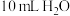 | 22.3℃ | 19.0℃ | 19.0℃的10 mL HCl | 20.5℃ |
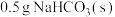 | 19.0℃的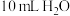 | 17.5℃ | 19.0℃ | 19.0℃的10 mL HCl | 18.3℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
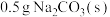 | 19.0℃的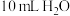 | 22.3℃ | 19.0℃ | 19.0℃的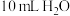 | 19.0℃ |
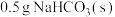 | 19.0℃的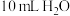 | 17.5℃ | 19.0℃ | 19.0℃的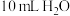 | 19.0℃ |
(3)表格1实验
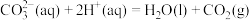
 ,
,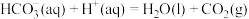
 。
。(4)实验中玻璃搅拌器的使用方法是
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ:
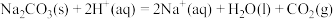
 ;
;反应Ⅴ:
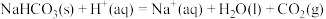

则

 (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
 。
。
您最近一年使用:0次
名校
解题方法
5 . 甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为
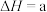 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)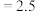 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)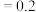 (mol⋅L
(mol⋅L )
) 。
。
①
___________ 0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率___________ 消耗 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.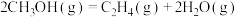
 kJ⋅mol
kJ⋅mol
Ⅱ.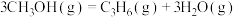
 kJ⋅mol
kJ⋅mol
Ⅲ.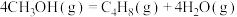
 kJ⋅mol
kJ⋅mol
① 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: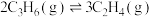
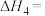
___________ 。
②加入 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将___________ (填“增大”、“减小”或“不变”)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
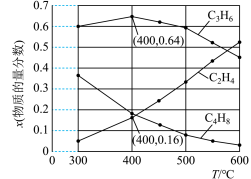
①随着温度的升高, 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是___________ 。
②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数
___________ 。
(1)煤的液化发生的主要反应之一为

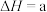 kJ⋅mol
kJ⋅mol ,在不同温度下,K(500°C)
,在不同温度下,K(500°C)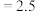 (mol⋅L
(mol⋅L ),K(700°C)
),K(700°C)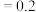 (mol⋅L
(mol⋅L )
)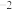 。
。①

②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内
 、CO、
、CO、 物质的量分别为2 mol、1 mol、3 mol,则此时生成
物质的量分别为2 mol、1 mol、3 mol,则此时生成 的速率
的速率 的速率(填“>”、“<”、“=”)。
的速率(填“>”、“<”、“=”)。(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
Ⅰ.
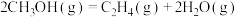
 kJ⋅mol
kJ⋅mol
Ⅱ.
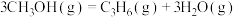
 kJ⋅mol
kJ⋅mol
Ⅲ.
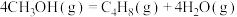
 kJ⋅mol
kJ⋅mol
①
 转化为
转化为 的热化学方程式为Ⅳ:
的热化学方程式为Ⅳ: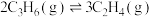
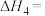
②加入
 作为稀释剂,反应Ⅰ中
作为稀释剂,反应Ⅰ中 的产率将
的产率将(3)为研究不同条件对反应的影响,测得不同温度下平衡时
 、
、 和
和 的物质的量分数变化,如图所示:
的物质的量分数变化,如图所示:
①随着温度的升高,
 的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是
的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是②体系总压为0.1 MPa,400℃时反应Ⅳ的平衡常数

您最近一年使用:0次
名校
解题方法
6 . 甲醇是重要的工业原料。
(1)已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
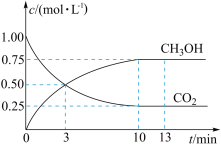
①T℃时,计算该反应的平衡常数为_______ (结果保留3位有效数字)。
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正_______ v逆(填“>”、“<”或=)。
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=_______ 。
(2)已知:(Ⅰ)CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
(Ⅱ)CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1
(Ⅲ)2H2(g)+CO(g) CH3OH(g) △H3
CH3OH(g) △H3
①△H3=_______ kJ/mol。
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=________ (用K1、K2表示)。
(1)已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
CH3OH(g)+H2O(g) △H=-49.0kJ•mol-1。T℃下,向体积为2L的恒容密闭容器中充入2molCO2(g)和6molH2(g),测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图。
①T℃时,计算该反应的平衡常数为
②若保持温度和容器体积不变,13min时,向容器中充入1molCO2(g)和1molH2O(g),此时,该反应的v正
③已知下列物质总键能(1mol物质所含化学键的键能之和)的数据如表,由此可计算表中a=
| 物质 | CO2 | H2 | CH3OH | H2O |
| 总键能/kJ•mol | 1620 | a | 2047 | 930 |
 CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.0kJ•mol-1(Ⅱ)CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.1kJ•mol-1
CO(g)+H2O(g) △H2=+41.1kJ•mol-1(Ⅲ)2H2(g)+CO(g)
 CH3OH(g) △H3
CH3OH(g) △H3①△H3=
②在一定温度下,已知反应Ⅰ、Ⅱ、Ⅲ的平衡常数分别为K1、K2、K3,则K3=
您最近一年使用:0次
解题方法
7 . 填空。
(1)23gC2H6O(l)和一定量的氧气混合点燃,恰好完全反应,生成CO2(g)和H2O(l),放出683.5kJ的热量。写出该反应的热化学方程式___________ 。
(2)白磷与氧气可发生如下反应: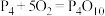 。已知断裂下列化学键需要吸收的能量分别为:
。已知断裂下列化学键需要吸收的能量分别为: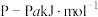 、
、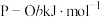 、
、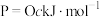 、
、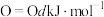 。
。
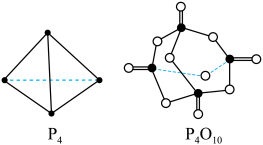
根据图中的分子结构和有关数据估算
___________ 
(3)在1200℃时,天然气脱硫工艺中会发生下列反应
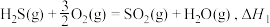
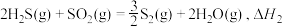
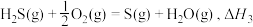
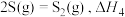
则
___________ (用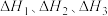 表示)
表示)
(4)合成氨反应 过程中的能量变化如图所示。回答下列问题:
过程中的能量变化如图所示。回答下列问题:
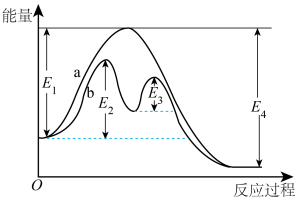
该反应的
___________  (用
(用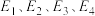 表示,
表示,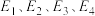 均>0)。反应达到平衡时,升高温度,N2的转化率
均>0)。反应达到平衡时,升高温度,N2的转化率___________ 。该反应过程___________ (填“a”或“b”)有催化剂参与。反应达到平衡时,加入催化剂,N2的转化率___________ 。
(1)23gC2H6O(l)和一定量的氧气混合点燃,恰好完全反应,生成CO2(g)和H2O(l),放出683.5kJ的热量。写出该反应的热化学方程式
(2)白磷与氧气可发生如下反应:
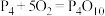 。已知断裂下列化学键需要吸收的能量分别为:
。已知断裂下列化学键需要吸收的能量分别为: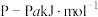 、
、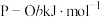 、
、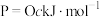 、
、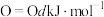 。
。
根据图中的分子结构和有关数据估算
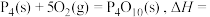

(3)在1200℃时,天然气脱硫工艺中会发生下列反应
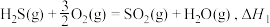
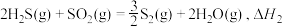
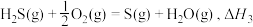
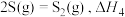
则

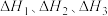 表示)
表示)(4)合成氨反应
 过程中的能量变化如图所示。回答下列问题:
过程中的能量变化如图所示。回答下列问题:
该反应的

 (用
(用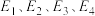 表示,
表示,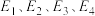 均>0)。反应达到平衡时,升高温度,N2的转化率
均>0)。反应达到平衡时,升高温度,N2的转化率
您最近一年使用:0次
名校
解题方法
8 . 依题意回答下列问题。
(1)标准状况下,0.3mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2摩尔燃烧焓的热化学方程式:_______ 。
(2)用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
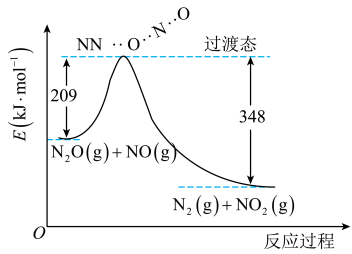
写出气态肼和N2O4反应的热化学方程式:_______ 。
(1)标准状况下,0.3mol C2H2(g)在O2(g)中完全燃烧生成CO2(g)和H2O(l),放出389.7 kJ热量,请写出表示C2H2摩尔燃烧焓的热化学方程式:
(2)用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1

写出气态肼和N2O4反应的热化学方程式:
您最近一年使用:0次
解题方法
9 . 甲醇是重要的化工原料。回答下列问题:
(1)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)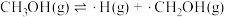 ;
;
(ii)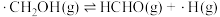 ;
;
(iii)
①(i)中反应物的总能量___________ (填“>”“=”或“<”)生成物的总能量。
②某温度时反应(i)、(ii)、(iii)的平衡常数依次为K1、K2、K3,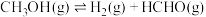 的平衡常数为K,则K=
的平衡常数为K,则K=___________ (用含K1、K2、K3的代数式表示)。
(2)向体积为1L恒容反应器中加入2mlCH3OH及适量催化剂,发生反应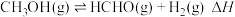 ,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
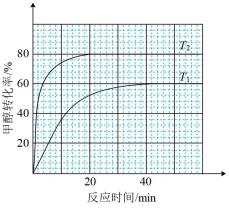
①T2温度下,20min时甲醇的体积分数为___________ %(保留三位有效数字),前20min平均反应速率v(HCHO)=___________  。
。
②T1温度下该反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压 物质的量分数,反应器内的初始压强为1
物质的量分数,反应器内的初始压强为1 103kPa)。
103kPa)。
(3)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。
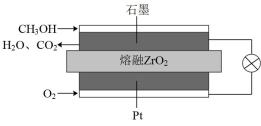
①石墨极上的反应式为___________ 。
②若通过用电器的电子的物质的量为1.2mol,则消耗标准状况下O2的体积为___________ L。
(1)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)
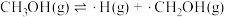 ;
;(ii)
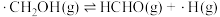 ;
;(iii)

①(i)中反应物的总能量
②某温度时反应(i)、(ii)、(iii)的平衡常数依次为K1、K2、K3,
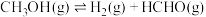 的平衡常数为K,则K=
的平衡常数为K,则K=(2)向体积为1L恒容反应器中加入2mlCH3OH及适量催化剂,发生反应
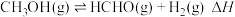 ,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
①T2温度下,20min时甲醇的体积分数为
 。
。②T1温度下该反应的平衡常数Kp=
 物质的量分数,反应器内的初始压强为1
物质的量分数,反应器内的初始压强为1 103kPa)。
103kPa)。(3)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。

①石墨极上的反应式为
②若通过用电器的电子的物质的量为1.2mol,则消耗标准状况下O2的体积为
您最近一年使用:0次
10 . 化学反应原理对化学反应的研究具有指导意义。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
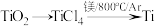
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=_______ 。
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2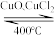 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.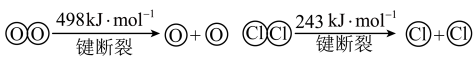
(2)写出该条件下,反应A的热化学方程式为_______ 。
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为_______ kJ。
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
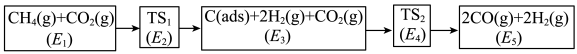
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的 可表示为
可表示为_______ kJ·mol-1。
(5)若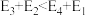 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为_______ 。
(1)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
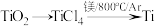
已知:①C(s)+O2(g)=CO2(g);ΔH=-3935kJ·mol-1
②2CO(g)+O2(g)=2CO2(g);ΔH=-566kJ·mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);ΔH=+141kJ·mol-1则
(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=
(2)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2
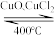 2Cl2+2H2O
2Cl2+2H2O已知:ⅰ.此条件下反应A中,4molHCl被氧化,放出115.6kJ的热量。
ⅱ.
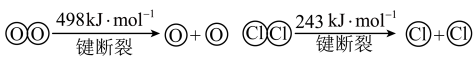
(2)写出该条件下,反应A的热化学方程式为
(3)断开1molH-O键与断开1molH-Cl键所需能量相差约为
(3)利用CO2与CH4制备合成气(CO、H2),可能的反应历程如图所示:
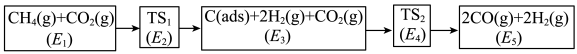
说明:C(ads)为吸附性活性炭,E表示方框中物质总能量(单位:kJ/mol),TS表示过渡态。
(4)制备合成气总反应的
 可表示为
可表示为(5)若
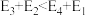 ,则决定速率步骤的化学方程式为
,则决定速率步骤的化学方程式为
您最近一年使用:0次



